- Промышленный методы получения уксусной кислоты
- История открытия уксусной кислоты, основные характеристики, производство и применение. Основные способы получения уксусной кислоты, технологический процесс производства уксусной кислоты окислением ацетальдегида, получение из метанола и оксида углерода.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
- Основные способы получения уксусной кислоты
Промышленный методы получения уксусной кислоты
История открытия уксусной кислоты, основные характеристики, производство и применение. Основные способы получения уксусной кислоты, технологический процесс производства уксусной кислоты окислением ацетальдегида, получение из метанола и оксида углерода.
| Рубрика | Химия |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 19.04.2012 |
| Размер файла | 173,0 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Уксусная кислота — первая из органических кислот, которая стала известна человеку. Впервые она была получена И. Глаубером в 1648 г. и в концентрированном виде путем вымораживания ее водных растворов и разложением ацетата кальция серной кислотой Г. Шталем в 1666—1667 гг. Элементный состав уксусной кислоты был установлен Я. Берцелиусом в 1814 г. До начала XIX века уксусную кислоту производили исключительно из природного сырья: пирогенетической обработкой древесины и окислительным уксуснокислым брожением пищевого этанола. В настоящее время производство уксусной кислоты из лесохимического сырья имеет второстепенное значение, хотя масштабы его измеряются сотнями тысяч тонн. В этом методе уксусную кислоту выделяют из сконденсированной части парообразных продуктов термической обработки древесины (жижки), получаемой в процессе углежжения. Выход кислоты составляет около 20 кг на 1 м 3 древесины.
Биохимический метод производства уксусной кислоты используют только для производства натурального пищевого уксуса.
Появление синтетических методов производства уксусной кислоты связано с разработкой и промышленной реализацией реакции получения ацетальдегида по Кучерову. В1910—1911 гг. патентуется способ производства уксусной кислоты окислением ацетальдегида, а в годы первой мировой войны в Германии и Канаде по этому методу было организовано промышленное производство. С некоторыми технологическими изменениями этот метод сохранил свое значение и в течение более пятидесяти лет является одним из основных.
Уксусная кислота была единственной, которую знали древние греки.
Отсюда и ее название: «оксос» — кислое, кислый вкус. Уксусная кислота это простейший вид органических кислот, которые являются неотъемлемой частью растительных и животных жиров. В небольших концентрациях она присутствует в продуктах питания и напитках и участвует в метаболических процессах при созревании фруктов. Уксусная кислота часто встречается в растениях, в выделениях животных. Соли и эфиры уксусной кислоты называются ацетатами.
1. Аналитический обзор
Уксусная кислота — слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов.
Получают уксусную кислоту окислением ацетальдегида и другими методами, пищевую уксусную кислоту уксуснокислым брожением этанола. Применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов. Уксусная кислота участвует во многих процессах обмена веществ в живых организмах. Это одна из летучих кислот, присутствующая почти во всех продуктах питания, кислая на вкус и главная составляющая уксуса. Строение уксусной кислоты заинтересовало химиков со времени открытия Дюма трихлоруксусной кислоты, так как этим открытием был нанесен удар господствовавшей тогда электрохимической теории Берцелиуса. Последний, распределяя элементы на электроположительные и электроотрицательные, не признавал возможности замещения в органических веществах, без глубокого изменения их химических свойств, водорода (элемента электроположительного) хлором (элементом электроотрицательным), а между тем по наблюдениям Дюма («Comptes rendus» Парижской академии, 1839) оказалось, что «введение хлора на место водорода не изменяет совершенно внешних свойств молекулы почему Дюма и задается вопросом «покоятся ли электрохимические воззрения и представления о полярности, приписываемой молекулам (атомам) простых тел, на столь ясных фактах, чтобы их можно было считать предметами безусловной веры; если же их должно рассматривать как гипотезы, то подходят ли эти гипотезы к фактам? Должно признать, продолжает он, что дело обстоит иначе.
Берцелиусу пришлось допустить возможность замещения водорода хлором без изменения химической функции первоначального тела, в котором происходить замещение. Не останавливаясь на приложении его воззрений к другим соединениям, переходим к работам Кольбе, который для уксусной кислоты, а затем и для других предельных одноосновных кислот нашел ряд фактов, гармонировавших со взглядами Берцелиуса (Жерара). Исходной точкой для работ Кольбе послужило изучение кристаллического вещества, состава CCl4SO2, полученного ранее Берцелиусом и Марсэ при действии царской водки на CS2 и образовавшегося у Кольбе при действии на CS2 влажного хлора. При действии света и хлора на C2Cl4, находившийся под водою, Кольбе получил на ряду с гексахлорэтаном и трихлоруксусную кислоту и выразил превращение таким уравнением: (Так как С2Сl4 может быть получен из CCl4 при пропускании его через накаленную) трубку, а ССl4 образуется при действии, при нагревании, Cl2 на CS2 то реакция Кольбе была первым по времени синтезом уксусной кислоты из элементов.
Работами Кольбе строение уксусной кислоты, а вместе с тем и всех других органических кислот было окончательно выяснено и роль последующих химиков свелась только к делению — в силу теоретических соображений и авторитета Жерара, формул Кольбе пополам и к переведению их на язык структурных воззрений, благодаря чему формула C2H6.C2O4H2 превратилась в CH3CO(OH).
Мировое производство уксусной кислоты составляет в настоящее время свыше 3,5 млн. т в год, в нашей стране в 1980 г. было произведено 250 тыс. т. Основная масса уксусной кислоты производится из ацетальдегида, окислением бутановой и бензиновой фракций.
Первая установка по производству синтетической уксусной кислоты каталитическим окислением ацетальдегида была пущена на Чернореченском химическом заводе в 1932 г., а в 1948 г. было организовано ее промышленное производство. К 60-м годам уксусная кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос в три раза.
В 1963 г. были введены в строй новые предприятия по совместному производству уксусной кислоты и уксусного ангидрида каталитическим окислением ацетальдегида в жидкой фазе и к 1965 г. производство уксусной кислоты этим методом составляло уже 17% от общего объема ее производства в стране. В эти же годы было освоено в промышленном масштабе производство уксусной кислоты карбонилированием метанола.
1.1 Теоретические сведения об уксусной кислоте
Карбоновые кислоты — органические соединения, содержащие одну или несколько карбоксильных групп — СООН, связанных с углеводородным радикалом. Карбоксильная группа сочетает в себе две функциональные группы — карбонил и гидроксил, взаимно влияющие друг на друга: кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О-Н.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
Уксусная кислота (этановая кислота) представляет бесцветную жидкость с резким запахом, с температурой кипения 118,1°С, температурой плавления 16,75°С и плотностью 1,05 т/м3. Безводная, так называемая «ледяная» уксусная кислота образует за счет водородных связей димер циклического строения.
Критическая температура составляет 321,6°С. Уксусная кислота смешивается во всех отношениях с этанолом, диэтиловым эфиром, бензолом и другими органическими растворителями и с водой. Растворяет некоторые неорганические и органические вещества, например, серу, фосфор, ацетаты целлюлозы. С воздухом уксусная кислота образует взрывчатые смеси с пределами воспламенения от 3,3 до 22,0% об. Температура вспышки равна 34°С, температура самовоспламенения 354°С.
Уксусная кислота слабая. Константа ее диссоциации 1,75*10-5. Образует многочисленные растворимые в воде соли (ацетаты) и этерифицируется спиртами с получением сложных эфиров. Уксусная кислота обладает высокой коррозионной активностью по отношению ко многим металлам, особенно в парах и при температуре кипения, что необходимо учитывать при выборе материалов для аппаратуры. В ледяной кислоте стойки как на холоду, так и при температуре кипения, алюминий, кремнистый и хромистый чугуны, некоторые сорта нержавеющей стали, но разрушается медь. Техническая уксусная кислота обладает большей коррозионной активностью, которая усиливается в контакте с воздухом. Из неметаллических материалов стойки по отношению к уксусной кислоте специальные сорта керамики и эмали, кислотоупорные цементы и бетоны и некоторые виды полимерных материалов (полихлорвиниловые и фенолальдегидные пластмассы). Ингибитор коррозии в растворах уксусной кислоты — перманганат калия.
В парах уксусная кислота обладает раздражающим действием на дыхательные пути, ПДК для нее составляет 5 мг/м3.
Синтетическая пищевая уксусная кислота — легковоспламеняющаяся жидкость, по степени воздействия на организм относится к веществам 3-го класса опасности. При работе с уксусной кислотой следует применять индивидуальные средства защиты (фильтрующие противогазы). Первая помощь при ожогах — обильное промывание водой.
Синтетическую пищевую уксусную кислоту заливают в чистые железнодорожные цистерны, автоцистерны с внутренней поверхностью из нержавеющей стали, в контейнеры, емкости и бочки из нержавеющей стали вместимостью до 275 дм 3 , а также в стеклянные бутыли и полиэтиленовые бочки вместимостью до 50 дм 3 . Полимерная тара пригодна для залива и хранения уксусной кислоты в течение одного месяца. Синтетическую пищевую уксусную кислоту хранят в герметичных резервуарах из нержавеющей стали. Контейнеры, емкости, бочки, бутыли и полиэтиленовые фляги хранят в складских помещениях или под навесом.
Не допускается совместное хранение с сильными окислителями (азотная кислота, серная кислота, перманганат калия и др.).
Транспортируется в ж/д цистернах, изготовленных из нержавеющей стали марки 12Х18H10Т или 10Х17H13М2Т, с верхним сливом.
Таблица 1. Физические свойства уксусной кислоты
Бесцветная, прозрачная жидкость без механических примесей
Источник
Основные способы получения уксусной кислоты
1.3 Основные способы получения уксусной кислоты
1.3.1 Получение уксусной кислоты окислением ацетальдегида
Процесс получения уксусной кислоты окислением ацетальдегида разработан фирмой Shawinigan (США). Окисление проводится кислородом в колоннах, футерованных алюминием, при 50—70°С и давлении до 0,7 МПа. В качестве растворителя используется уксусная кислота или ее водный раствор. Повышенное давление способствует поддержанию необходимой концентрации альдегида в жидкой фазе н увеличению надежности работы конденсационной системы. В качестве катализатора используется ацетат марганца. Окислительная колонна в нижней части снабжена перфорированной перегородкой для равномерного распределения кислорода по ее сечению. Процесс окисления протекает через стадию образования надуксусной кислоты, и катализатор играет активную роль в предотвращении ее накопления в значительных количествах.
Основными побочными продуктами окисления ацетальдегида являются ме-тилацетат, формальдегид, муравьиная кислота, ацетон, диацетил, этилиденди-ацетат. Это требует тщательной очистки товарного продукта от примесей.
В случае окисления ацетальдегида с использованием сложных катализаторов Со—Сu, Мn—Сu и в присутствии водоотводящих агентов (диизопропиловый эфир, этилацетат и т. д.) одновременно с уксусной кислотой образуется уксусный ангидрид.
Окисление ацетальдегида молекулярным кислородом представляет гомогенную каталитическую реакцию, протекающую в жидкой фазе и выражаемую общим уравнением:
Реакция протекает по цепному механизму через стадию образования надуксусной кислоты (НУК):
Которая, являясь сильным окислителем, окисляет ацетальдегид до уксусного ангидрида:
Уксусный ангидрид при достаточном количестве воды гидролизуется до уксусной кислоты:
Таким образом, в системе всегда сосуществуют уксусная кислота, уксусный ангидрид и вода.
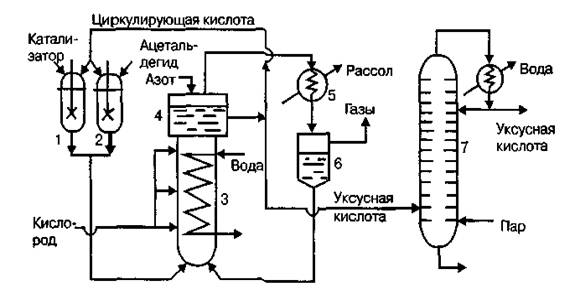
Технологическая схема производства уксусной кислоты окислением ацетальдегида
На рис. 1.1 представлена технологическая схема производства уксусной кислоты из ацетальдегида на марганцевом катализаторе.
1-смеситель катализаторного раствора,2-смеситель раствора ацетальдегида,3-окислительная колонна(реактор),4-брызгоулавитель,5- рассольный конденсатор, 6-сепаратор жидкости и газа, 7-ректификационная колонна
Рисунок 1.1 Технологическая схема производства уксусной кислоты окислением ацетальдегида
Технологический процесс производства уксусной кислоты окислением ацетальдегида состоит из трех последовательных стадий:
1) окисление ацетальдегида,
2) выделение непрореагировавшего ацетальдегида из паро-газа,
3) выделение уксусной кислоты из реакционной смеси и ее очистка.
Растворы катализатора и ацетальдегида в циркуляционной уксусной кислоте подаются из смесителей 1 и 2 в нижнюю часть окислительной колонны — реактора барботажного типа 3. Температурный режим в колонне поддерживается с помощью размещенных в ней охлаждающих змеевиков, по которым циркулирует вода. По всей высоте в колонну через несколько труб подается под давлением 4*10 5 Па кислород, который барботирует через жидкость, заполняющую колонну. Парогазовая смесь, содержащая продукты окисления, выводится из колонны 3 через брызгоуловитель 4 и поступает в конденсатор 5, охлаждаемый рассолом, и из него в сепаратор 6. Из сепаратора конденсат, состоящий из уксусной кислоты и ацетальдегида, возвращается в окислительную колонну, а несконденсировавшиеся газы промываются водой и выпускаются в атмосферу. Для предотвращения возможности взрыва НУК парогазовая смесь, выходящая из колонны, разбавляется азотом, который подается в брызгоуловитель 4. Жидкая уксусная кислота, выходящая из брызгоуловителя колонны 3, делится на два потока. Меньший из них (циркуляционная кислота) направляется в смесители 1 и 2 для приготовления растворов катализатора и ацетальдегида, а больший поступает на ректификацию в колонну 7 для получения товарного продукта. Из нижней части колонны 7 выводится в виде кубового остатка раствор катализатора, поступающий на регенерацию.
Основной аппарат технологической схемы — окислительная колонна. Она представляет цилиндр с расширенной верхней частью, играющей роль брызгоуловителя, высотой 12 и диаметром 1 м. Колонна изготовлена из алюминия или хромоникелевой стали, мало подверженных коррозии в уксуснокислой среде. Внутри колонна имеет полки, между которыми размещены змеевиковые холодильники для отвода реакционного тепла и несколько труб для подачи кислорода.
Товарным продуктом в этом методе является уксусная кислота концентрацией после двухкратной ректификации 97,5— 98,5% мас. Выход уксусной кислоты составляет 92% при степени превращения ацетальдегида 0,98.
Источник