Производство серной кислоты
Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита (серного колчедана) FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
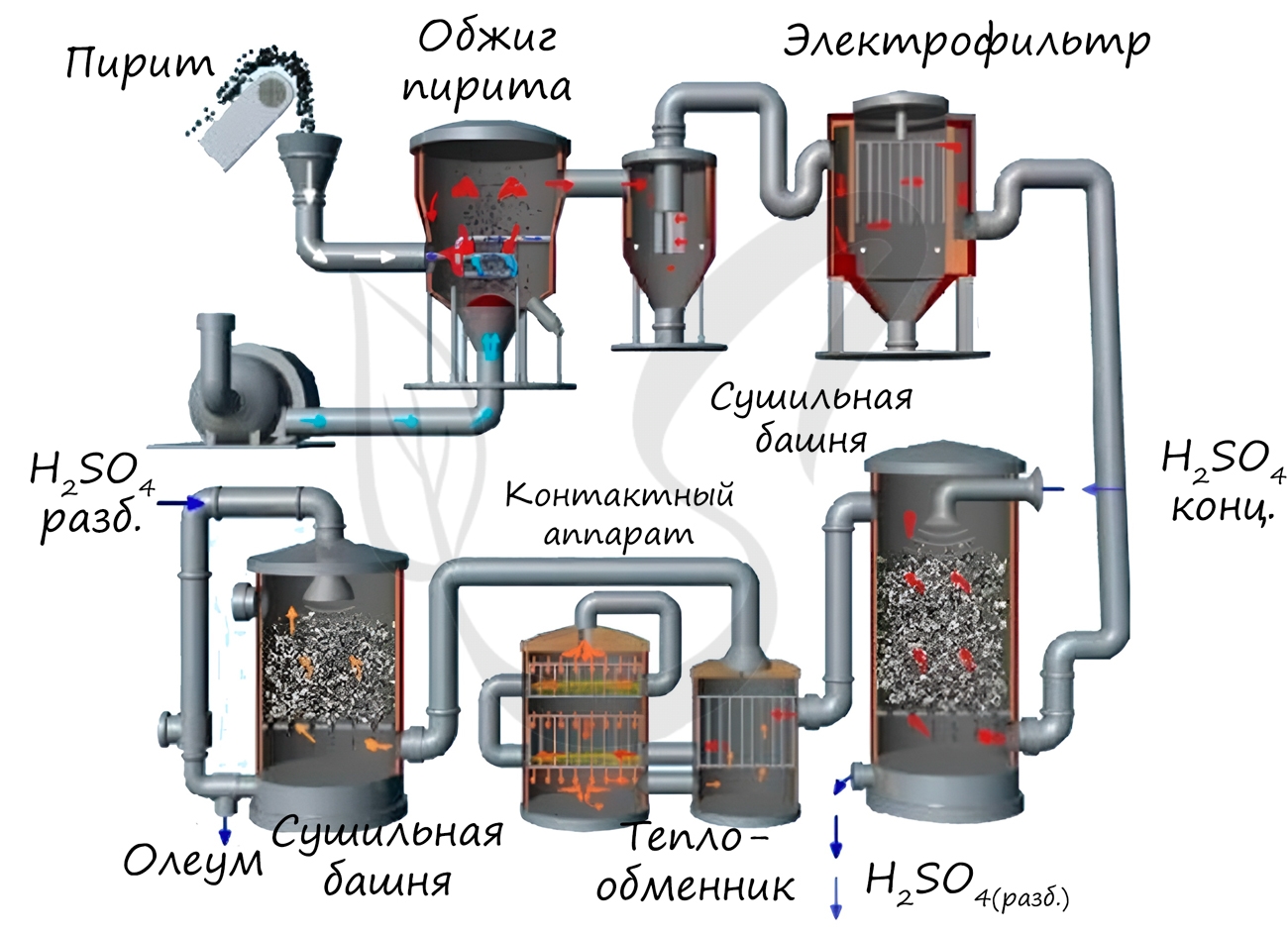
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое«. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня |
 |
Рисунок 1 – Области применения серной кислоты
Серной кислотой называют не только моногидрат H2SO4, но и его водные растворы (H2SO4 + H2O), а также растворы SO3 в моногидрате (олеум H2SO4 + SO3). Основные виды серной кислоты, выпускаемые российскими заводами:
– башенная, содержащая 75% H2SO4 в смеси с водой;
– контактная, содержащая 92,5-94% H2SO4 в смеси с водой;
– олеум, содержащий 18,5-24% SO3 в смеси с H2SO4.
Сырье и способы получения серной кислоты
Основными видами сырья для производства серной кислоты являются элементарная сера (
50% производства) и серный или железный колчедан FeS2 (
30%). Особое место в сырьевом балансе занимают также отходящие газы цветной металлургии с высоким содержанием SO2.
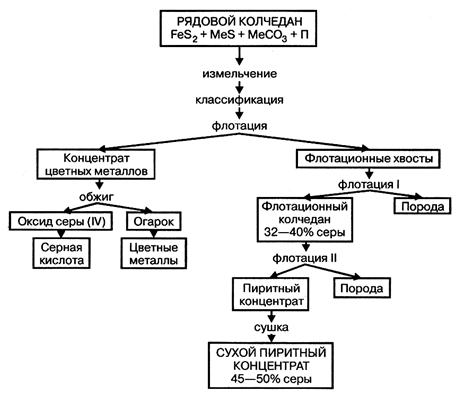
1. ЖЕЛЕЗНЫЙ КОЛЧЕДАН. Природный железный колчедан представляет сложную породу, состоящую из сульфида железа FeS2, сульфидов других металлов (меди, цинка, свинца, никеля, кобальта и др.), карбонатов металлов и пустой породы. На территории РФ существуют залежи колчедана, на Урале и Кавказе, где его добывают в рудниках в виде рядового колчедана. Процесс подготовки рядового колчедана к производству ставит целью извлечение из него ценных цветных металлов и повышение концентрации дисульфида железа. Схема подготовки рядового колчедана представлена на рис. 2.
Рисунок 2 – Схема подготовки железного колчедана
2. СЕРА. Элементарная сера может быть получена из серных руд или из газов, содержащих сероводород или оксид серы (IV). В соответствии с этим различают серу самородную и серу газовую (комовую).
На территории РФ залежей самородной серы практически нет. Источниками газовой серы являются Астраханское газоконденсатное месторождение, Оренбургское и Самарское месторождения попутного газа.
Из самородных руд серу выплавляют в печах, автоклавах или непосредственно в подземных залежах (метод Фраша). Для этого серу расплавляют непосредственно под землей, нагнетая в скважину перегретую воду, и выдавливают расплавленную серу на поверхность сжатым воздухом.
3. СЕРОВОДОРОД. Источником сероводорода служат различные горючие газы: коксовый, генераторный, попутный, газы нефтепереработки. Извлекаемый при их очистке сероводородный газ достаточно чист, содержит до 90% сероводорода и не нуждается в специальной подготовке.
4. ГАЗЫ ЦВЕТНОЙ МЕТАЛЛУРГИИ. В этих газах содержится от 4 до 10% оксида серы (IV) и они могут непосредственно использоваться для производства серной кислоты.
Доля сырья в себестоимости продукции сернокислотного производства достаточно велика. Поэтому технико-экономические показатели этого производства существенно зависят от вида используемого сырья.

Замена колчедана серой приводит к снижению капитальных затрат на строительство и улучшению экологической обстановки в результате ликвидации отвалов огарка и уменьшению выбросов токсичных веществ в атмосферу.
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце XIX и начале XX в. Контактный способ вытесняет нитрозный (башенный), им производится свыше 90% кислоты.
Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяется с водой с получением серной кислоты. Окисление SO2 в SO3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В нитрозном способе, источником кислорода для окисления и катализатором служат оксиды азота. Окисление SO2 происходит в основном в жидкой фазе и осуществляется в башнях с насадкой (по аппаратурному признаку способ называют башенным). Конечным продуктом сразу является H2SO4:
Этим способом получают загрязненную примесями разбавленную 75-77%-ную серную кислоту, которая используется для производства минеральных удобрений.
В контактном способе, который уже практически вытеснил нитрозный, окисление SO2 до SO3 осуществляется кислородом воздуха на твердых катализаторах:
Серную кислоту получают на последующей стадии процесса путем абсорбции.
2. Структурная схема производства H2SO4 из колчедана контактным способом
Общая схема химического производства серной кислоты из колчедана состоит из четырех химико-технологических процессов (ХТП):
1. получение обжигового газа с высоким содержанием SO2;
2. очистка обжигового газа от примесей и осушка;
3. каталитическое окисление содержащегося в газе SO2 до SO3;
4. абсорбция SO3 из газа с получением серной кислоты или олеума.
На структурной схеме производства (рис. 3) показана последовательность осуществления процессов и получаемые на разных стадиях продукты.
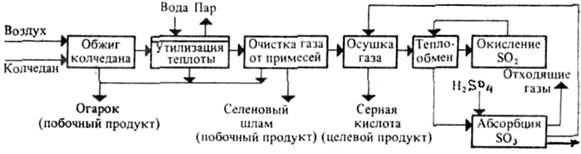
Рисунок 3 – Структурная схема производства H2SO4 из колчедана
Каждый из перечисленных процессов имеет свои особенности, поэтому рассмотрим процесс получения серной кислоты постадийно.
Источник