- Основные способы получения металлов заполнение таблицы
- Основные способы получения металлов заполнение таблицы
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Общая характеристика и способы получения металлов
- Пирометаллургия
- Гидрометаллургия
- Электрометаллургия
- Химия. 11 класс
- Урок: Общие способы получения металлов
- Ход урока
- Организационный момент. Запись даты и темы урока. Активизация учащихся на урок.
- Много веков металлы верно служат человеку, помогая ему покорять стихию, овладевать тайнами природы, создавать замечательные машины и механизмы.
- Сдающим ЕГЭ:
- II. Повторение «Металлургическая разминка».
- III. Изучение нового материала.
Основные способы получения металлов заполнение таблицы
Природные соединения металлов:
сильвинит КСl ∙ NaCl, каменная соль NaCl;
серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS;
мел, мрамор, известняк СаСО3, магнезит MgCO3,
доломит CaCO3 ∙ MgCO3;
глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О;
магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н2О.
чилийская селитра NaNO3;
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
Способы получения металлов из руд.
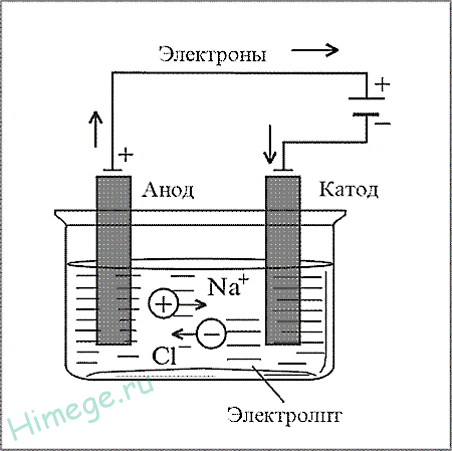
1. Электрометаллургический способ — это способы получения металлов с помощью электрического тока (электролиза). Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы.
При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
катод Na+ + e à Na0 ¦ 2
анод 2Cl — — 2e à Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.) – (э. ток)à 2Na + Cl2
Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
катод Al3+ +3e à Al 0 ¦ 4
анод 4AlO33– –12 e à 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э. ток)à 4Al + 3O2 .
2. Пирометаллургический способ — это восстановление металлов из их руд при высоких температурах с помощью восстановителей: неметаллических : кокс, оксид углерода (II), водород; металлических: алюминий, магний, кальций.
Fe+32O3 +2Al = 2Fe0 + Al2O3
Получают железо, хром.
Восстановление оксидов металлов водородом (водородотермия ):
Cu +2O + H2 –(t)à Cu0 + H2O
Получают малоактивные металлы – медь, вольфрам.
В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды:
3Fe2O3 + CO –(t)à 2Fe3O4 + CO2 ,
Fe3O4 + 4CO –(t)à 3FeО + 4CO2
FeO + CO –(t)à Fe+ CO2
Восстановление углём (коксом):
ZnO + C –(t)à Zn + CO
Получают цинк, никель.
3. Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения:
CuSO4 + Fe = FeSO4 + Cu.
Таким способом получают серебро, цинк, молибден, золото, ванадий.
Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
а) из сульфида – обжигом в кислороде: 2ZnS + 3O2 = 2ZnO + 2SO2
б) из карбоната – разложением: СаСО3 –(t)à СаО + СО2
Производство железа основано на карботермическом восстановлении оксидных металлсодержащих руд.
1) Сульфидные и другие руды вначале подвергают окислительному обжигу : 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
2)Восстановление оксидных руд осуществляется в доменных печах, при этом протекают следующие реакции:
3Fe2O3 + CO –(t)àCO2 + 2Fe3O4, Fe3O4 + CO–(t)àCO2 + 3FeO, FeO + CO–(t)àCO2 + Feили FeO + C –(t)àCO + Fe.
Полученное железо насыщено углеродом. 3)Затем происходит «выжигание» углерода в сталеплавильных или конверторных печах с образованием стали.
Источник
Основные способы получения металлов заполнение таблицы
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Общая характеристика и способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.
В соответствии с этим существуют следующие способы получения металлов:
Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк)
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe 2 Fe 3 2)O4+ CO2
(Fe 2 Fe 3 2)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);
Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
а) NaCl (электролиз расплава) → 2Na + Cl2
Источник
Химия. 11 класс
Конспект урока
Урок № 10. Общая характеристика и способы получения металлов
Перечень вопросов, рассматриваемых в теме: урок посвящён веществам, которые относят к группе металлов, и их взаимодействиям. В ходе урока школьники познакомятся с общими способами получения металлов.
Алюмотермией называют реакции, протекающие между оксидами металлов и алюминием, с образованием соответствующего свободного металла и оксида алюминия.
Гидрометаллургия — вытеснение металлов из руд с помощью растворов различных реагентов без применения высоких температур.
Катион – положительно заряженный ион, который притягивается к катоду в процессе электролиза.
Кристаллическая решётка вещества – это структура с геометрически упорядоченным расположением частиц (атомы, молекулы либо ионы) в определённых точках пространства.
Ко́вкость – способность металлов и сплавов подвергаться изменению при обработке давлением.
Магниетерми́я – метод металлотермии, процесс восстановления элементов из их оксидов, хлоридов, фторидов магнием.
Металлическая связь – химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов – алюминия, магния.
Пласти́чность — свойство твердых тел необратимо деформироваться при действии механических нагрузок.
Теплопрово́дность – способность материальных тел проводить энергию (теплоту) от более нагретых частей тела к менее нагретым частям тела, осуществляемому хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.).
Электро́лиз – физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ.
Эле́ктроотрица́тельность – количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
Электропроводность – способность тела или среды проводить электрический ток, определяющее возникновение в них электрического тока под воздействием электрического поля.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
На сегодняшний день известно 118 элементов, 96 из которых являются металлами. Открыты и исследованы они были в разное время.
Химические элементы по времени открытия
Источник
Урок: Общие способы получения металлов
Тема урока: Общие способы получения металлов
Цель урока: Познакомить учащихся со способами получения металлов и историческим развитием металлургии.
Задачи урока:
Повторить основные способы получения металлов и развитие металлургии;
Рассмотреть роль металлов в истории человеческого общества;
Знакомство полезными ископаемыми и с коллекцией минералов.
Расширить кругозор учащихся и повысить познавательный интерес к изучению минералов и химии.
Оборудование и материалы: Коллекции руд металлов, природные соединения металлов из числа имеющихся в лаборатории веществ.
Тип урока: интегрированный урок (химия, география, история).
Урок изучения нового материала.
Ход урока
Организационный момент. Запись даты и темы урока. Активизация учащихся на урок.
Много веков металлы верно служат человеку, помогая ему покорять стихию, овладевать тайнами природы, создавать замечательные машины и механизмы.
Проверка домашнего задания.
У доски 2 человека.
А) ОВР
Б) Задача
Тест
Вариант 1.
1.Дополнить:
Химический элемент магний находится в____________периоде, _________группе, ___________подгруппе.
2.Выбрать правильный ответ:
Атом кислорода имеет следующее распределение электронов по энергетическим уровням:
3.Дополнить:
В периоде с возрастанием порядкового номера у химических элементов металлические свойства___________, а неметаллические свойства____________.
4.Выбрать правильный ответ:
В веществах, имеющих химические формулы O2, HCI, M9O
ковалентная неполярная связь
ковалентная полярная связь
Указать степень окисления химических элементов
5.Установить соответствие:(назвать вещества)
HCl, CuO, SO2, KOH, H2SO3, CuSO4, NaCl
Вариант 2.
1 .Дополнить :
Химический элемент натрий находится в____________периоде, _________группе, ___________подгруппе.
2. Выбрать правильный ответ:
Атом натрия имеет следующее распределение электронов по энергетическим уровням:
3. Дополнить:
В главной подгруппе с возрастанием порядкового номера у химических элементов металлические свойства___________, а неметаллические свойства____________.
4. Выбрать правильный ответ :
В веществах, имеющих химические формулы H2, CuO, H2O
ковалентная неполярная связь
ковалентная полярная связь
Указать степень окисления химических элементов
5. Установить соответствие:(назвать вещества)
H2SO4, NaOH, CO2, K2O, CuCl2, CaCO3
Сдающим ЕГЭ:
II. Повторение «Металлургическая разминка».
Какой элемент имеет одинаковое название с предметом кухонного оборудования? ( титан ).
Какой металл первым начали добывать и обрабатывать люди? ( медь ).
Какой металл пишет, как карандаш? ( свинец ).
Какой металл называют металлом консервной банки? ( олово ).
Какой металл лучше всех других металлов проводит тепло и электрический ток? ( серебро ) (слайд 4)
Что такое металлургия? (версии учащихся – развитие логического мышления)- в рабочей тетради
Цветная, черная, грязная и т.д.
Производит, загрязняет, выплавляет и т.д.
Часть экономики страны
Опора, металл, НТР и т.д.
III. Изучение нового материала.
Учитель выдает тексты ученикам
1. В поэме «О природе вещей» древнеримский поэт и философ-материалист
Тит Лукреций Кар (1 в. н.э.) пишет:
«Чтобы оружье иметь и орудья для рубки деревьев,
Чтобы обтёсывать лес и выстругивать гладкие брусья,
Чтобы буравить, долбить и просверливать в дереве дыры,
Это они серебром или золотом делать пытались,
Тщетно: слабей была стойкость у этих металлов, и с медью
Вровень они не могли выдерживать грубой работы»
Таков же мастер, твой волшебный сказ – связуя вязью, тонкой и богатой,
Торжественно тревожный век двадцатый и быль веков, – обворожая нас.
Да будет это творческое слово, грядущему являя мир былого,
Оружьем столь же мощным на века, как эта сталь и как душа народа,
Как с ней одноименная свобода – крылатый конь уральского клинка”
Металлов много есть, но дело не в количестве:
В команде работящей, металлической
Такие мастера, такие личности!
Преуменьшать нам вовсе не пристало
Заслуги безусловные металлов.
Греческое слово «металлон» означало первоначально копи, рудники; отсюда и произошёл термин «металл». В древности и в средние века считалось, что существует только 7 металлов: золото, серебро, медь, олово, свинец, железо, ртуть. В 1789 г. французский химик А. Л. Лавуазье в своём руководстве по химии дал список простых веществ, в который включил все известные тогда 17 металлов (Sb, Ag, As, Bi, Co, Cu, Sn, Fe, Mn, Hg, Mo, Ni, Au, Pt, Pb, W, Zn) (слайд 6) По мере развития методов химического исследования число известных металлов стало быстро возрастать. В первой половине XIX в. были открыты спутники платины (платиновые металлы); получены путём электролиза некоторые щелочные и щелочноземельные металлы, положено начало разделению редкоземельных металлов; при химическом анализе минералов открыты неизвестные ранее металлы. В начале 1860-х гг. с помощью спектрального анализа были открыты рубидий, цезий, индий, таллий. Блестяще подтвердилось существование металлов предсказанных Д. И. Менделеевым на основе его периодического закона (галлия, скандия и германия). Открытие радиоактивности в конце XIX в. повлекло за собой поиски радиоактивных металлов, увенчавшиеся полным успехом. Наконец, методом ядерных превращений начиная с середины XX в. были получены не существующие в природе радиоактивные металлы, в том числе и те, что принадлежат к трансурановым элементам . Руды – это минералы и горные породы, содержащие металлы и их соединения. Пригодные для промышленного получения металлов, если в состав руды входят два или несколько металлов или их соединения – руды называются полиметаллическими (хромистый железняк, свинцово-серебрянные руды).
2. Всего за годы войны учеными и конструкторами было разработано более 80 опытных образцов боевых машин. Большая часть их выпускалась крупносерийным поточным производство. Поставили на поток изготовление танков. Необходимо увеличивать производство вооружения, боевой техники и боеприпасов для освобождения страны от фашистских захватчиков.
В годы войны были увеличены мощности металлургических комбинатов алюминиевых (Каменск-Уральский) и магниевого заводов, комбината «Южуралникель»(Орск). В короткие сроки были построены крупные заводы:Челябинский и Чебаркульский металлургические,Богословский алюминиевый, Миасский автомобильный, Челябинская и Соликамская ТЭЦ. В период войны на Урале вступили в строй 10 доменных, 28 мартеновских, 9 электролитных печей, 2 бессемеровских конвертора, 11 коксовых батарей, более 100 шахт и угольных бассейнов.
Значительные масштабы обрели модернизация станков, агрегатов. В машиностроении технический прогресс был ускорен организацией на заводах поточных линий и конвейеров.
До войны броневая сталь на Урале не производилась. Чтобы удовлетворить потребности фронта в специальных сортах черных металлов, ученым и металлургам, и прежде всего коллективу Магнитогорского металлургического комбината, пришлось в короткий срок освоить технологию выплавки броневой стали в больших мартеновских печах. Впервые в истории мировой и отечественной металлургии магнитогорцы применили блюминг для получения танковой брони, совершив технический переворот в металлургическом деле. Производство броневой стали возросло с сентября 1941 г. по январь 1942 г. в 98 раз.
3. Ведущей отраслью рыночной специализации Центрально-Черноземного экономического района является горнорудная и металлургическая промышленность.
В экономике Белгородской области сформировался крупный производственный комплекс на базе железорудных ресурсов КМА. Географическое положение комплекса было исключительно выгодное, гак как его территорию пересекают в широтном и меридиальном направлениях железнодорожные магистрали, которые дают выход в Центральный район, промышленно развитые регионы Украины, Поволжье и на Северный Кавказ. Территория обладает разветвленной сетью автомобильных дорог, газопроводов, линий электропередачи. Энергетическая база комплекса создана за счет мощностей Курской и Нововоронежской атомных электростанций. Освоение КМА способствовало созданию в центрально-европейской части России металлургической базы.
Современная структура металлургической базы образована крупными металлургическими компаниями.
ОАО «НЛМК» — вертикально-интегрированная металлургическая компания, в структуру которой входят: Новолипецкий металлургический комбинат (г. Липецк); ОАО «Стойленский ГОК» (Белгородская область), являющийся основным поставщиком железорудного сырья; ОАО «Доломит», производящее флюсовый и конвертерный доломит (г. Данков Липецкой области); ОАО «Студеновская акционерная горнодобывающая компания (Стагдок)» (г. Липецк), добывающее и перерабатывающее флюсовый и технологический известняк; и другие предприятия, в том числе за пределами района. Группа HJIM К производит около 15% всей российской стали.
В горнорудный дивизион холдинга «Металлоинвест» входят Лебединский (Белгородская область) и Михайловский (Курская область) горнообогатительные комбинаты. Металлургический дивизион на территории района представлен Оскольским электрометаллургическим комбинатом по производству высококачественной стали методом прямого восстановления железа, минуя доменный процесс. Он является единственным в России с бездоменной экологически чистой технологией.
ОАО «Липецкий металлургический завод „Свободный сокол» производит чугун и широкий спектр трубной продукции.
Машиностроение и металлообработка — ведущая рыночная отрасль промышленности. На заводах района производят горное оборудование, экскаваторы, тракторы, сельскохозяйственные машины, оборудование для пищевой и цементной промышленности, химическую аппаратуру, станки, приборы, радиотехнические и электротехнические изделия.
Источник