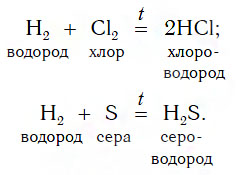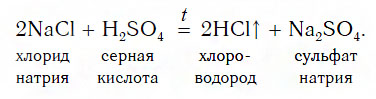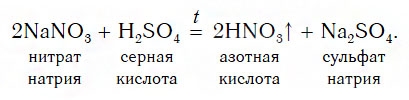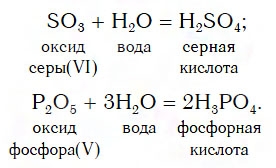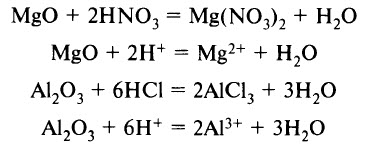- Урок 36. Получение и применение кислот
- Получение кислот
- Взаимодействие некоторых простых веществне — металлов с водородом
- Взаимодействие серной кислоты с твердыми солями
- Взаимодействие кислотных оксидов с водой
- Применение кислот
- Основные способы получения кислот конспект
- ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- ПОЛУЧЕНИЕ КИСЛОТ
- Дополнительные материалы (схемы, таблицы)
- Конспект урока по химии на тему «Получение и применение кислот» (8 класс)
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Методическая работа в онлайн-образовании
- Оставьте свой комментарий
- Безлимитный доступ к занятиям с онлайн-репетиторами
- Подарочные сертификаты
Урок 36. Получение и применение кислот
В уроке 36 «Получение и применение кислот» из курса «Химия для чайников» изучим все возможные способы получения кислот в лабораторных условиях, а также узнаем о широком спектре применения серной кислоты.
Получение кислот
Для получения неорганических кислот используют реакции разных типов. Рассмотрим важнейшие из них.
Взаимодействие некоторых простых веществне — металлов с водородом
Образующиеся газообразные продукты реакций — HCl и H2S — растворяют в воде и получают соответствующие бескислородные кислоты — хлороводородную и сероводородную. Таким же образом можно получить и бромоводородную кислоту — раствор газа бромоводорода HBr в воде. К какому типу относятся рассмотренные реакции получения HCl и H2S?
Взаимодействие серной кислоты с твердыми солями
Этот способ основан на том, что нелетучая серная кислота H2SO4 при нагревании вытесняет летучие кислоты — HCl и HNO3— из их солей. Поэтому хлороводородную кислоту можно получить, нагревая смесь ее соли — твердого хлорида натрия с серной кислотой:
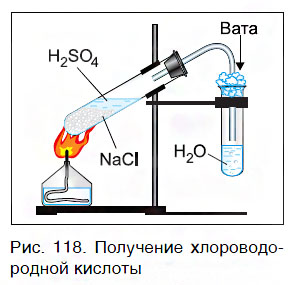
Газообразный хлороводород, выделяющийся в этой реакции, растворяют в воде и получают хлороводородную кислоту (рис. 118). Поскольку она образуется из хлорида натрия NaCl, называемого в быту просто «соль», то эту кислоту очень часто называют «соляной кислотой».
Для получения азотной кислоты нагревают смесь ее соли — нитрата натрия NaNO3 — с серной кислотой:
Пары азотной кислоты, образующиеся в результате этой реакции, охлаждают до комнатной температуры, и она переходит в жидкое состояние.
Взаимодействие кислотных оксидов с водой
Вы уже знаете, что кислотные оксиды, кроме SiO2, реагируют с водой. Это их свойство используют для получения некоторых кислородсодержащих кислот, например серной и фосфорной:
Поскольку оксид кремния SiO2 с водой не реагирует, то соответствующую ему кислоту H2SiO3 получают другими способами.
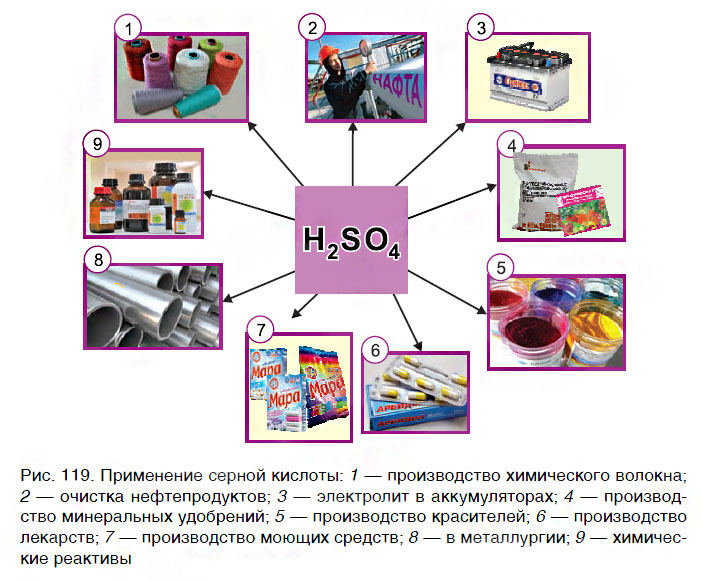
Применение кислот
Кислоты широко используются практически во всех сферах деятельности человека — в быту, в различных отраслях промышленности, в медицине. Наибольшее применение находит серная кислота (рис. 119). Так как кислоты оказывают разрушающее действие на кожу, бумагу, ткани, обращаться с ними следует осторожно, соблюдая правила безопасности.
Краткие выводы урока:
- Для получения кислот используют реакции: водорода с некоторыми простыми веществами (хлор и сера); кислотных оксидов с водой; солей с кислотами.
- Кислоты находят широкое применение в промышленности и в быту.
- Кислоты — едкие вещества, обращаться с которыми следует осторожно.
Надеюсь урок 36 «Получение и применение кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Источник
Основные способы получения кислот конспект
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н + (точнее – катионы гидроксония H3O + ):
НCl = Н + + Cl – (НCl + H2O = H3O + + Cl – )
HNO3 = Н + + NO3 – (HNO3 + H2O = H3O + + NO3 – )
Кислоты – вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными химическими связями. Чем более поляризована связь между атомом водорода, способным отщепляться в виде катиона водорода, и атомом какого–либо другого элемента, тем легче происходит её распад с образованием ионов, тем сильнее кислота.
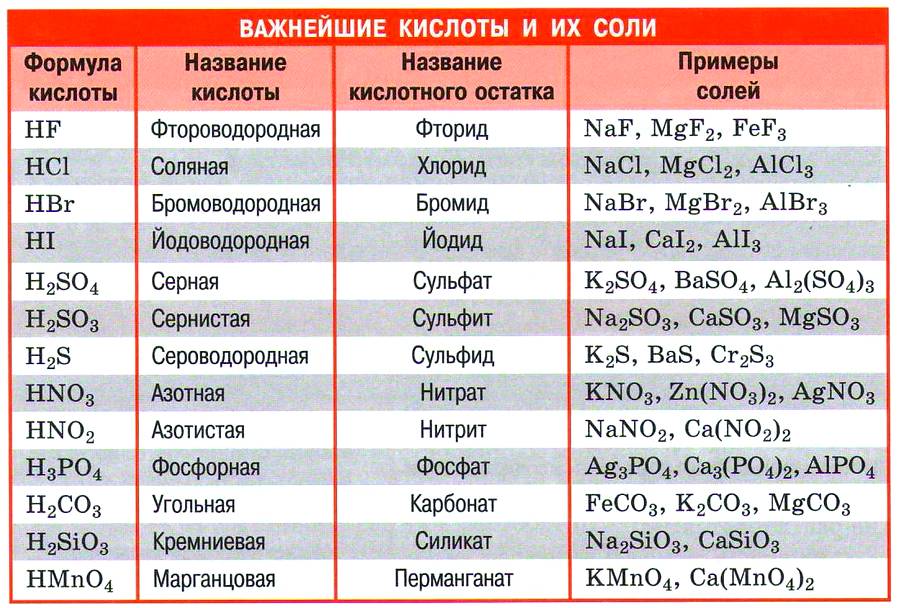
Классифицировать кислоты можно по разным признакам.
- По содержанию кислорода кислоты могут быть бескислородными (например, НCl, НВг, HI, H2S, HCN) и кислородсодержащими (например, H2SO4, HNO3, H3PO4).
- По числу атомов водорода в молекуле кислоты, способных замещаться атомами металлов (по основности), кислоты могут быть одноосновными (НCl, НВг, HI, HNO3), двухосновными (H2SO4, H2SO3, H2СО3, H2S), трёхосновными (H3PO4, H3AsO4) и т. д. Существуют и кислоты большей основности, например пирофосфорная Н4Р2O7 – четырёхосновная.
- По степени диссоциации кислоты могут быть сильными (НCl, НВг, HI, HNO3, H2SO4) и слабыми (H2S, H2SiO3, H2CO3, СH3СООН).
- По растворимости кислоты могут быть растворимыми в воде (H2SO4, HNO3, НCl, СH3СООН) и нерастворимыми в воде (H2SiO3, C17H35СООН).
- По стабильности кислоты могут быть стабильными (H2SO4, НCl, H3РO4) и нестабильными (H2CO3, H2SO3, HNO2). Нестабильные кислоты, как правило, невозможно выделить в свободном состоянии, они существуют только в растворах.
- По летучести кислоты могут быть летучими (НCl, HNO3, СH3СООН) и нелетучими (H2SO4, H3PO4, H2SiO3).
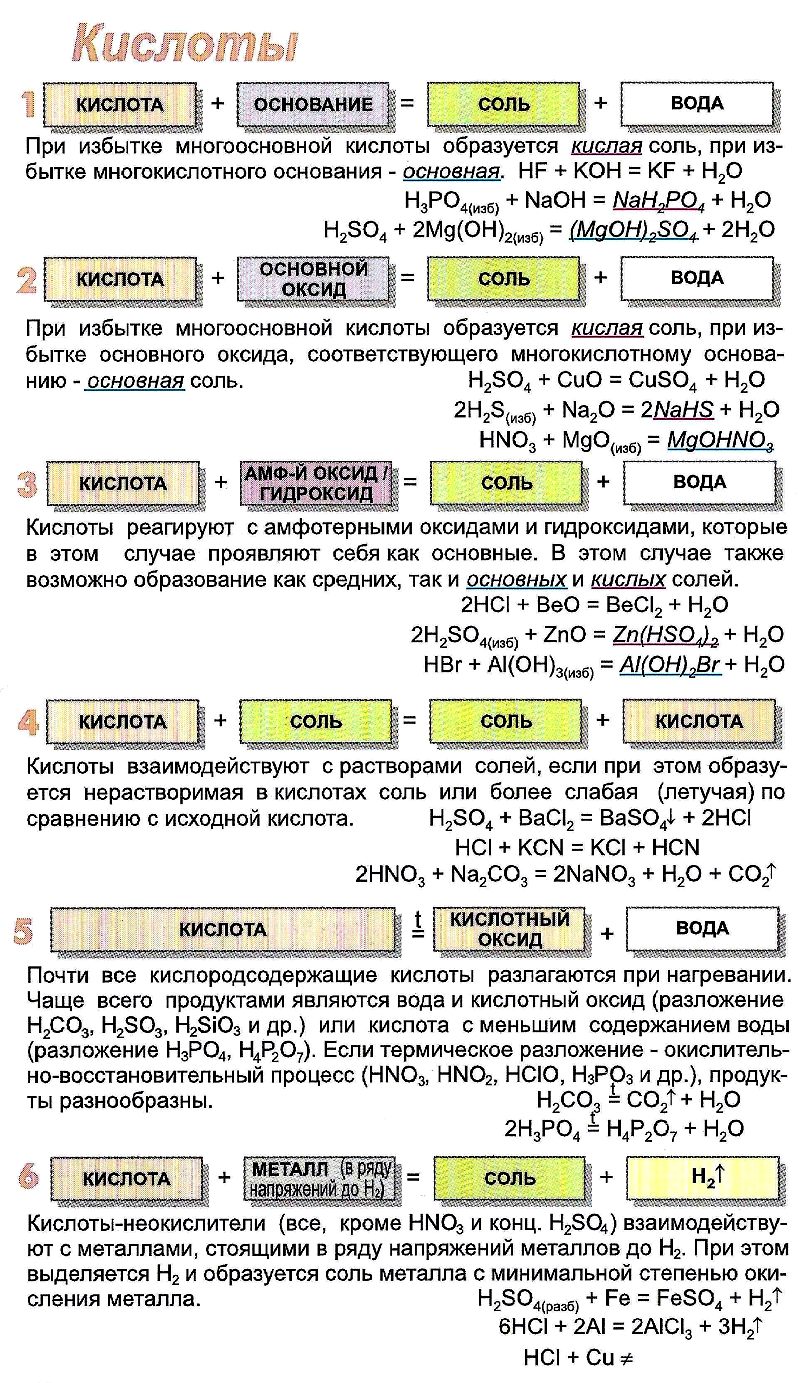
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
- Кислоты реагируют с металлами. Металлы, расположенные в электрохимическом ряду напряжений металлов до водорода H2, вытесняют водород из растворов кислот. Происходит реакция замещения, образуется соль и водород:
Металлы, расположенные в ряду напряжений после водорода, с кислотами не реагируют.
Важное примечание: с серной концентрированной кислотой и с азотной кислотой любой концентрации реакции идут за счёт аниона кислотного остатка, водород в этих случаях не выделяется:
Cu+ 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Cu+ 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O
- Киcлоты реагируют с основными и амфотерными оксидами с образованием соли и воды:
- Кислoты реагируют с основаниями и с амфотерными гидроксидами с образованием соли и воды:
(Взаимодействие сильных кислот с сильными основаниями – реакция нейтрализации.)
Al(ОН)3 + 3НCl = AlCl3 + 3H2O
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
(Реакция амфотерного гидроксида с сильной кислотой.)
- Сильные кислоты реагируют с солями слабых кислот. Слабые кислоты при этом могут быть вытеснены из солей. Например, сильная соляная кислота НCl вытесняет слабую сероводородную кислоту H2S:
FeS + 2НCl = FeCl2 + H2S↑
FeS + 2Н + = H2S↑ + Fe 2+
Нелетучие кислоты могут вытеснить летучую из её соли. Например, нелетучая серная кислота H2SO4 вытесняет более летучую азотную HNO3. Обе кислоты – сильные. В растворе такая реакция не происходит. Она осуществима, если соль находится в кристаллическом виде (не в растворе), а серная кислота концентрированная:
Аналогично можно получить газообразный хлороводород, раствор которого – соляная кислота.
- Кислoты можно обнаружить индикаторами. Индикаторы реагируют на наличие в растворе ионов Н + (H3O + ). Лакмус в кислой среде приобретает красный цвет, метиловый оранжевый – красный, фенолфталеин – бесцветный. Для обнаружения кислот удобно использовать лакмус.
ПОЛУЧЕНИЕ КИСЛОТ
Бескислородные кислоты, состоящие из двух элементов, могут быть получены синтезом простых веществ:
Кислородсодержащие кислоты могут быть получены в результате взаимодействия с водой соответствующих кислотных оксидов:
Р2O5 + 3H2O = 2H3РO4
SO3 + H2O = H2SO4
Слабые или летучие киcлoты могут быть вытеснены из солей более сильными или менее летучими кислотами. Например, сильная соляная кислота НCl вытесняет слабую уксусную кислоту СH3СООН:
CH3COONa + НCl = СH3СООН + NaCl
СH3СОО – + Н + = СH3СООН
Летучие киcлoты могут быть вытеснены из солей менее летучими кислотами. Например, нелетучая серная кислота H2SO4 может вытеснить более летучую соляную НCl. Но в растворе такая реакция не пойдёт (обе киcлoты сильные). Она осуществима, если соль в кристаллическом состоянии (не в растворе) обработать серной концентрированной кислотой:
В результате этой реакции образуется газообразный хлороводород, при растворении которого в воде образуется соляная кислота.
Для получения слабых нелетучих кислот (например, ортофосфорной киcлоты или сернистой кислoты) лучше воспользоваться концентрированной серной кислотой, причём образующаяся сернистая кислота H2SO3 разлагается на сернистый газ SO2 и воду:
Са3(РO4)2 (тв.) + 3H2SO4 (конц.) = 3CaSO4 + 2H3РO4
Na2SO3 (тв.) + H2SO4 (конц.) = Na2SO4 + SO2↑ + H2O
Дополнительные материалы (схемы, таблицы)
Конспект урока по химии в 8 классе «Кислоты: классификация, свойства, получение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
- Смотреть конспект по химии в 11 классе «Неорганические и органические кислоты«
Источник
Конспект урока по химии на тему «Получение и применение кислот» (8 класс)
План-конспект «___» ________201__
по учебному предмету «Химия» в 8 классе
Тема: Получение и применение кислот
Цель: формирование представления о способах получения и применении кислот
Сформировать представления о способах получения и применении кислот.
Совершенствовать умения записывать соответствующие уравнения реакций и производить расчеты по формулам и химическим уравнениям
а) Формирование познавательной потребности.
б) Формирование стремления к глубокому усвоению знаний.
в) Воспитание аккуратности в оформлении записи уравнений
Приветствие учащихся. Проверка отсутствующих. Организация внимания.
Проверка домашнего задания
Индивидуальная работа учащихся на карточках.
№ 1 Согласны ли Вы с тем, что
Среди кислот, содержащих атомы серы, имеются как кислородсодержащие, так и бескислородные?
В присутствии кислот некоторые вещества (индикаторы) изменяют свою окраску?
В состав всех кислот входят атомы кислорода?
При взаимодействии всех металлов с кислотами образуется водород?
Известны кислоты, которые являются простыми веществами?
Реакцию между кислотой и основанием с образованием соли и воды называют реакцией нейтрализации?
Азотная кислота относится к кислородсодержащим?
Кислоты не реагируют с солями?
№ 2 С какими веществами будет реагировать соляная кислота: K 2 SO 4 , Na 2 O , H 2 SO 4 , H 2 O , KOH , CuO, AgNO 3 , Mg(OH) 2 . Составьте уравнения соответствующих реакций. Назовите все вещества.
Практически все важнейшие кислоты в промышленности получают с помощью различных химических реакций. Познакомимся со способами получения некоторых кислот.
Изучение нового материала
Способы получения кислот
HCl, HBr, HI, HF, H 2 S
1. Прямое взаимодействие неметаллов
1. Кислотный оксид + вода = кислота
2. Реакция обмена между солью и менее летучей кислотой
2 NaCl ( тв .) + H 2 SO 4 ( конц .) = Na 2 SO 4 + 2HCl
Кислоты широко используются практически во всех сферах деятельности человека — в быту, в различных отраслях промышленности, в медицине.
Применение кислот в промышленности
Cодержится во всех газированных водах и напитках. Их изготавливают, насыщая под давлением соответствующие жидкости углекислым газом. Он при этом реагирует с водой, образуя угольную кислоту.
Применение кислот в медицине
Борная кислота обладает антисептическими свойствами, её используют при приготовлении борной мази.
Фосфорная кислота широко применяется в стоматологии при пломбировании зубов. Ею протравливают зубную эмаль перед процедурой. Также в незначительных количествах фосфорная кислота применяется в составах отбеливателей для зубов.
Разбавленную соляную (хлороводородную) кислоту применяют для лечения некоторых заболеваний желудочно-кишечного тракта.
Применение кислот в быту
Лимонная кислота используется в кулинарии, а также для выведения всевозможных пятен: от вина, различных ягод, красок, ржавчины, чернил.
Уксусная кислота применяется либо в виде столового уксуса, с массовой долей кислоты до 9 %, или в виде семидесяти-восьмидесятипроцентной эссенции. Уксус применяется в качестве консерванта, а также приправы к блюдам, удаления фруктовых пятен с тканей.
МЕРЫ ПРЕДОСТОРОЖНОСТИ ПРИ РАБОТЕ С КИСЛОТАМИ
Кислоты разрушают кожу и ткани. Поэтому с кислотами нужно обращаться очень осторожно!
При работе с ними следует надевать средства защиты – специальные халаты, перчатки, очки.
При разбавлении кислот, их следует тонкой струйкой вливать в воду при перемешивании стеклянной палочкой.
При попадании на кожу или одежду ее необходимо нейтрализовать раствором соды, а затем смыть водой.
Обобщение и систематизация изученного
Перечислите известные вам способы получения кислот.
Какие кислоты наиболее широко используются в промышленности?
Какие меры предосторожности нужно соблюдать при работе с кислотами? Что делать, если кислота попала на кожу, или в глаза?
1. Как получить азотную кислоту из ее соли – нитрата натрия. Напишите уравнение соответствующей реакции. К какому типу она относится?
2. Приведите уравнения реакций, с помощью которых можно осуществить следующие превращения?
MgO – MgSO 4 – Mg ( OH )2 – MgO – MgCl2
3. Рассчитайте общий объем ( н.у.) водорода и хлора, необходимый для получения хлороводорода массой 7,3 г.
Информация о домашнем задании
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 832 человека из 77 регионов
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
- Курс добавлен 23.09.2021
- Сейчас обучается 47 человек из 23 регионов
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
- Сейчас обучается 22 человека из 11 регионов
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-508818
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Минпросвещения будет стремиться к унификации школьных учебников в России
Время чтения: 1 минута
В Минпросвещения предложили организовать телемосты для школьников России и Узбекистана
Время чтения: 1 минута
В Осетии студенты проведут уроки вместо учителей старше 60 лет
Время чтения: 1 минута
Путин попросил привлекать родителей к капремонту школ на всех этапах
Время чтения: 1 минута
В проекте КоАП отказались от штрафов для школ
Время чтения: 2 минуты
В российских школах оборудуют кабинеты для сообщества «Большой перемены»
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник