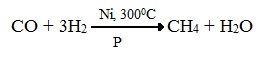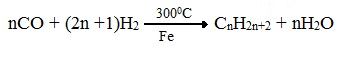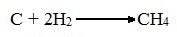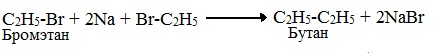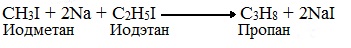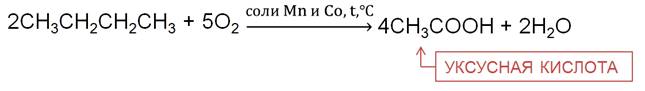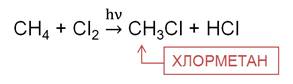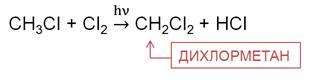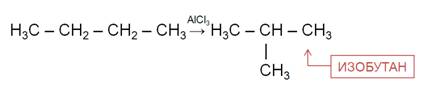Основные способы получения алканов кратко
Алканы выделяют из природных источников (природный и попутный газ, нефть, каменный уголь).
Газообразные алканы получают из природного и попутных нефтяных газов, а твердые алканы — из нефти. Природной смесью твердых высокомолекулярных алканов является горный воск — природный битум.
Метан широко распространен в природе. Он является главной составной частью многих горючих газов как природных (80-97%), так и искусственных, выделяющихся при сухой перегонке дерева, торфа, каменного угля, а также при крекинге нефти. Природные газы, особенно попутные газы нефтяных месторождений, помимо метана содержат этан, пропан, бутан и пентан.
Метан выделяется со дня болот и из каменноугольных пластов в рудниках, где он образуется при медленном разложении растительных остатков без доступа воздуха. Поэтому метан часто называют болотным или рудничным газом.
В промышленности
1. Получение алканов из природных источников (нефть, природный газ)
2. Синтезом на основе водяного газа из оксида углерода (II) и водорода можно получить метан:
3. Синтезом из водяного газа (СО+Н2) получают смесь алканов:
В лаборатории
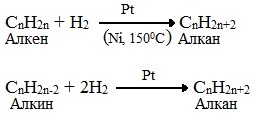
1. Метан можно получить синтезом из простых веществ при нагревании, повышенном давлении в присутствии катализатора (Ni):
2. Гидролиз карбида алюминия (получение метана)
3. Взаимодействие карбида алюминия с сильными кислотами
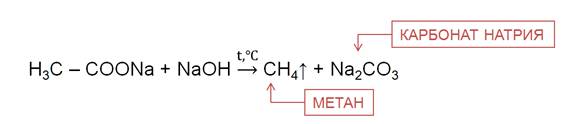
4. Сплавление солей уксусной кислоты со щелочами (реакция Дюма)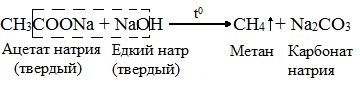
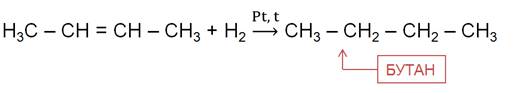
5. Каталитическое гидрирование (+Н2) непредельных углеводородов
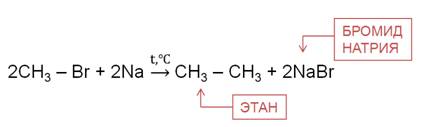
6. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Происходит димеризация углеродной цепи исходного галогеналкана, образуется алкан с четным числом атомов углерода в цепи:
Если в реакции участвуют разные галогеналканы, то образуется смесь алканов:
7. Электролиз растворов солей карбоновых кислот (реакция Кольбе)
Источник
Алканы
Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы
Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos — соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp 3
- Валентный угол (между химическими связями) составляет 109°28′
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
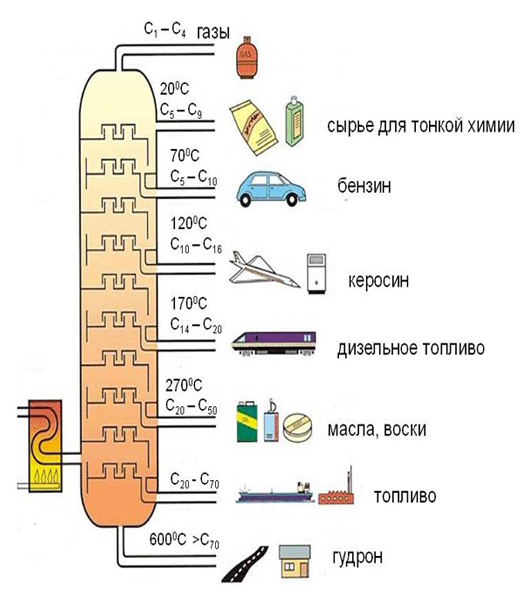
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
Гидрогенизацией угля (торфа, сланца)
Гидрированием оксида углерода II
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Гидрированием ненасыщенных углеводородов
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее — у вторичного и значительно труднее — у первичного.
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
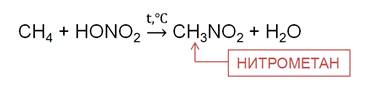
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.
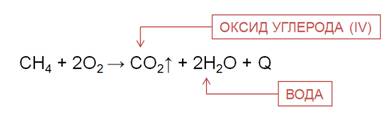
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
Алканы: свойства, получение и применение
Урок 10. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Алканы: свойства, получение и применение»
Предельные углеводороды – алканы, при обычных условиях достаточно инертны. Для них свойственны реакции замещения атомов водорода и реакции расщепления. Эти реакции требуют жёстких условий: нагревания, действия света, наличия катализаторов. Поэтому алканы ещё называют парафинами, что означает мало сродства.
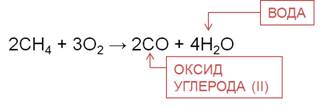
Для алканов характерны реакции окисления. При полном окислении, например, метана образуется углекислый газ, вода и выделяется большое количество теплоты.
По этой причине метан в составе природного газа используют в качестве топлива в домах, на электростанциях, горючего для машин.
Смеси метана с кислородом (1 : 2 по объёму или воздухом 1 : 10) опасны и приводят к взрывам.
При частичном окислении, например, при недостатке кислорода, образуется оксид углерода (II) и вода.
При частичном окислении бутана в присутствии катализаторов образуется уксусная кислота.
Для алканов свойственны реакции замещения (галогенирования). Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов.
С фтором реакция идёт со взрывом, с йодом алканы не взаимодействуют, а с хлором и бромом в присутствии инициаторов.
В реакции метана с хлором на свету на первой стадии образуется хлорметан. Хлорметан представляет собой газ, легко сжижается, он применяется в холодильных установках.
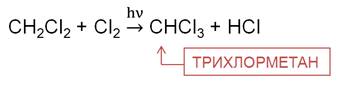
На второй стадии образуется дихлорметан. Это растворитель, его используют для склеивания пластика.
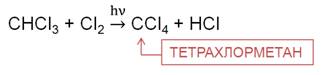
На третьей стадии хлорирования метана образуется трихлорметан. Трихлорметан – бесцветная летучая жидкость с эфирным запахом, используется при производстве фреонового хладагента, в качестве растворителя в фармакологии, для производства красителей и пестицидов.
На четвёртой стадии образуется тетрахлорметан, который применяют как растворитель, а также для получения фреонов, как экстрагент в медицине, тетрахлорметан применялся как наполнитель для переносных огнетушителей в советской бронетехнике.
При нагревании алканов до 140 0 C с разбавленной (10 %) HNO3 под давлением идёт реакция нитрирования, то есть замещения атома водорода нитрогруппой. Эту реакцию называют ещё реакцией М. Н. Коновалова. В результате реакции метана с азотной кислотой образуется нитрометан.
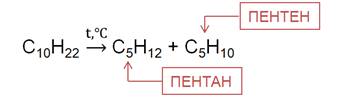
При температуре более 500 0 C в присутствии катализаторов алканы подвергаются расщеплению, то есть крекингу. Это приводит к образованию смеси алкенов и алканов.
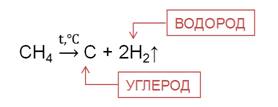
При температуре 1000 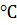
Таким образом, получают технический углерод – пигмент для изготовления типографической краски и наполнителя резины для автомобильных шин.
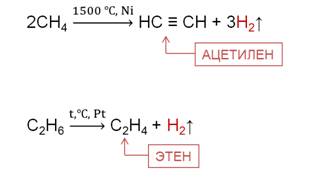
При повышенных температурах алканы образуют, главным образом, непредельные углеводороды. Например, в реакции дегидрирования метана при температуре 1500 0 C образуется ацетилен и водород, в реакции дегидрирования этана образуется этен и водород.
Под влиянием катализаторов и при температуре углеводороды нормального строения подвергаются изомеризации с образование углеводородов разветвлённого строения. Так, в присутствии катализатора хлорида алюминия происходит изомеризация бутана с образованием изобутана.
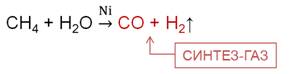
При конверсии метана образуется синтез-газ, который представляет собой смесь угарного газа с водородом.
Рассмотрим получение алканов.
В промышленности насыщенные углеводороды – алканы получают при переработке нефти.
В лаборатории алканы можно получить различными способами. Например, из солей карбоновых кислот при нагревании с твёрдыми щелочами.
Реакция Вюрца используется для увеличения углеводородной цепи.
Алканы также можно получить гидрированием ненасыщенных углеводородов.
Алканы имеют широкое применение. Бутан используется для получения бутадиена-1,3, необходимого в производстве синтетического каучука. Метан используется для получения синтез-газа, метанола, ацетилена, как топливо, горючее для двигателей внутреннего сгорания, для получения растворителей.
Таким образом, при облучении светом или при высоких температурах алканы вступают в реакции окисления и замещения. Алканы в промышленности получают из нефти, а в лаборатории реакциями гидрирования ненасыщенных углеводородов, нагреванием солей карбоновых кислот со щелочами, реакцией Вюрца.
Источник