4.1 Очистка твердых веществ
Очистка твердых веществ от примесей является частным случаем более общей задачи – разделения твердых смесей органических соединений. Применяются различные методы разделения и очистки твердых смесей, выбор метода определяется свойствами веществ, подвергаемых разделению или очистки, характером примесей, степенью требуемой чистоты, а также экономичностью метода.
Очистка и разделение твердых веществ могут осуществляться с помощью различных видов перегонки (простая перегонка, вакуум перегонка, перегонка с водяным паром), а также возгонки. Органические соединения, принадлежащие к различным классам, обладают разной растворимостью. Это свойство используется для очистки и разделения органических веществ путем кристаллизации, в частности дробной кристаллизации.
4.1.1 Кристаллизация
Кристаллизация – это процесс образования и роста кристаллов из раствора, расплава или газовой фазы. Кристаллизация или перекристаллизация представляет собой процесс, при котором твердое вещество растворяют при нагревании в определенном растворителе, отфильтровывают горячий раствор от нерастворимых примесей и затем путем охлаждения выкристаллизовывают основное вещество, выпавшие кристаллы отфильтровывают. Определение температуры плавления и контроль хроматографическими методами (например, ТСХ – тонкослойная хроматография – см. п.4.4.3) позволяет при этом легко оценить чистоту полученного вещества.
Для получения чистого вещества перекристаллизацию повторяют несколько раз до получения вещества с постоянной температурой плавления, т.е. не меняющейся при последующей кристаллизации.
В результате перекристаллизации, по сравнению с другими способами очистки твердых веществ, получается наиболее чистый продукт, но в то же время, она сопряжена с относительно большими потерями вещества в маточнике. Поэтому в тех случаях, когда перед химиком стоит задача получить наибольший выход продукта, следует использовать другие методы очистки — перегонку при обычном или пониженном давлении, перегонку с водяным паром и др . Иногда подобные перегонки дают возможность произвести предварительную очистку.
Основным оборудованием для проведения кристаллизации является: круглодонная колба; обратный холодильник; баня с соответствующим теплоносителем.
Метод перекристаллизации из раствора основан на том, что растворимость твердых соединений в горячих растворителях намного выше, чем в холодных, а так же на различии растворимости веществ в одном и том же растворителе. Поэтому, выбор растворителя имеет важное значение.
Растворитель, применяемый для очистки твердого вещества перекристаллизацией, должен удовлетворять следующим основным требованиям:
∙ хорошо растворять примеси . Очистка дает тем лучшие результаты, чем больше разница в растворимости очищаемого вещества и примесей;
∙ очищаемое вещество должно плохо растворятся в выбранном растворителе на холоду . В противном случае потери вещества в маточ-
ном растворе будут велики;
∙ растворимость очищаемого вещества должна резко возрастать
с повышением температуры;
∙ растворитель не должен реагировать с кристаллизуемым веще-
ством , должен способствовать образованию устойчивых кристаллов и легко удаляться с поверхности кристаллов при отмывании и высушивании;
∙ температура кипения растворителя должна быть ниже температуры плавления вещества , которое необходимо перекристаллизовать, как минимум на 30 ºС. При нарушении такого интервала температур вещество, как правило, выделяется в виде масла.
Температура для наилучшего образования зародышей кристаллов лежит приблизительно на 100 ºС выше, а для наилучшего роста кристаллов на 50 ºС ниже температуры плавления кристаллизующегося соединения.
В тех случаях, когда в литературе отсутствуют данные о растворимости, выбор растворителя производится опытным путем, при этом следует учитывать известную зависимость между строением растворяемого вещества и растворителя: «подобное растворяется в подобном». Например, углеводороды обычно хорошо растворяются в углеводородных растворителях (бензол, толуол, четыреххлористый углерод и т.д.), соединения, содержащие гидроксильные группы (низшие спирты, фенолы, карбоновые кислоты и другие вещества) легко растворяются в воде и спирте. В более общем виде, это правило выглядит так: полярные соединения растворимы в полярных растворителях, таких как вода, спирты, кетоны, кислоты, и значительно менее растворимы в неполярных растворителях, таких как бензол, четыреххлористый углерод и т.д.
Это правило верно только для веществ простого строения, для сложных соединений оно не всегда соблюдается. На растворимость вещества оказывает влияние в этих случаях наличие разных функциональных групп, их число, величина молекулярного веса и другие факторы. Окончательный выбор растворителя можно произвести только опытным путем.
Проведение подбора растворителя для перекристаллизации
Кончиком шпателя берут пробу вещества, помещают ее в пробирку и прибавляют некоторое количество растворителя. Если вещество растворяется уже на холоду, то данный растворитель непригоден для перекристаллизации. Если вещество на холоду растворяется плохо или совсем не растворяется, то пробирку нагревают до кипения на нагретой водяной бане (при температуре кипения растворителя меньше 100 ºС) или на электроплитке, если растворителем является вода. В случае необходимости добавляют в пробирку еще немного растворителя, чтобы добиться полного растворения вещества.
Если вещество кристаллизуется при охлаждении горячего насыщенного раствора, либо, наоборот, нерастворимо или мало растворимо даже при нагревании, то данный растворитель непригоден для целей перекристаллизации.
Если после охлаждения пробирки из раствора выпадут кристаллы, то растворитель пригоден для проведения кристаллизации. Более точным критерием пригодности растворителя служит температура плавления образовавшихся кристаллов. Если температура плавления кристаллизуемого вещества известна, то температура плавления выпавших из подбираемого растворителя кристаллов должна си ней совпадать. Если температура плавления вещества неизвестна, то критерием пригодности
растворителя служит постоянство температур плавления кристаллов при повторных кристаллизациях.
В качестве растворителей при кристаллизации наиболее часто применяются вода, этиловый и метиловый спирты, ацетон, петролейный эфир, хлороформ, ледяная уксусная кислота, этилацетат, толуол, ксилол.
При использовании легколетучих растворителей (диэтиловый эфир, спирт, ацетон и др.), растворение следует вести очень осторожно . Находящиеся поблизости нагревательные приборы или источники открытого огня должны быть потушены и выключены.
В тех случаях, когда не удается подобрать индивидуальный растворитель для перекристаллизации, применяют смеси, состоящие из двух, а иногда и трех растворителей. Для этого вещество растворяют в том растворителе, в котором оно растворяется очень легко, и к полученному раствору по каплям добавляют горячий растворитель, плохо растворяющий данное вещество, до тех пор, пока не образуется устойчивое помутнение. Эту смесь нагревают до получения прозрачного раствора и оставляют для кристаллизации. Растворители, применяемые совместно, должны смешиваться друг с другом во всех отношениях. В большинстве случаев применяют следующие смеси: спирт–вода, спирт– бензол, спирт–ледяная уксусная кислота, ацетон–вода, эфир–ацетон– бензол, хлороформ–петролейный эфир и т.д.
После проведения кристаллизации кристаллы отфильтровывают, сушат и взвешивают. Низкий выход очищаемого вещества указывает на то, что используемый растворитель не был идеальным или его было взято слишком много. В таких случаях из фильтрата (маточного раствора) можно дополнительно выделить кристаллы после удаления избытка растворителя на роторном испарителе и охлаждении оставшегося раствора. Как правило, эти последующие порции вещества менее чистые, чем выделенные ранее.
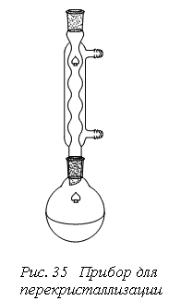
Для проведения перекристаллизации в колбу, снабженную обратным холодильником помещают небольшое количество рабочего вещества (рис. 35). Во избежание перегрева жидкости и толчков при кипячении раствора, в колбу перед нагреванием вносят «кипелки».
После этого в колбу вливают растворитель в несколько меньшем объеме, чем это необходимо для полного растворения вещества, и нагревают смесь до кипения. Нагревание ведут на водяной бане, за исключением тех случаев, когда работают с высококипящими растворителями. Затем через обратный холодильник осторожно добавляют такое количество растворителя, которое необходимо для полного растворения всего вещества при кипячении. Для обесцвечивания раствора от окрашенных примесей (если это необходимо) к реакционной смеси добавляют активированный уголь в количестве 1-2 % от количества очищаемого вещества. Раствор кипятят в течение нескольких минут с активированным углем до обесцвечивания, а затем еще горячий раствор фильтруют от угля.
После того как все механические примеси будут удалены фильтрованием, горячий прозрачный раствор либо оставляют в колбе для медленного охлаждения, либо быстро охлаждают, поместив колбу в холодную воду со льдом или снег. При быстром охлаждении получаются мелкие кристаллы, а при медленном – крупные .
Некоторые вещества очень трудно кристаллизуются даже при охлаждении. Это явление чаще всего связано с очень медленным ростом кристаллов или очень медленным образованием центров кристаллизации.
При этом используют два приема :
1. Введение «затравки». Этот приём заключается в том, что в раствор вносят кристаллы того же вещества (затравку), т.е. искусственно создают центры кристаллизации. Если чистого вещества нет, можно смочить раствором стеклянную палочку и резко охладить её, поместив в пустую охлаждаемую снаружи пробирку. В тонкой плёнке жидкости на поверхности стеклянной палочки образуются кристаллы.
2. Трение стеклянной палочкой о стенки сосуда. Для этого берут неоплавленную стеклянную палочку, вносят её в раствор и осторожно потирают о стенки сосуда. При этом образуется мелкая стеклянная пыль, отдельные пылинки могут оказаться подходящими центрами кристаллизации. Кристаллизация всегда начинается от стенок и от поверхности к центру, на твёрдых поверхностях или на границе раздела фаз. Электрическое и магнитное поля, ультразвук, иногда сильное охлаждение (например, в жидком азоте) – все это способствуют процессу кристаллизации.
Кристаллизация считается законченной, когда дальнейшее выпадение кристаллов не наблюдается. Образовавшиеся кристаллы отделяют от маточного раствора фильтрованием под вакуумом. На воронке Бюхнера полученные кристаллы дважды промывают соответствующим хо-
Источник
Кристаллизационные методы очистки – основы материаловедения
Электрофизические свойства кристаллов определяются, как было выяснено в гл. 3, содержащимися в них структурными дефектами и примесями. Требование продолжительности и стабильности работы полупроводниковых приборов делает одной из важнейших задач технологии задачу получения совершенных монокристаллов с заданным значением параметров. Однако получение чистых элементарных веществ, необходимых для производства различных, в том числе легированных и сложных, полупроводников, используемых для создания приборов, является чрезвычайно сложным технологическим процессом.
В основе всех способов очистки полупроводниковых материалов лежит различие в химических и физических свойствах разделяемых веществ. При существенном различии в свойствах разделяемых материалов их легко отделить, и, наоборот, проблема очистки становится сложной, если очищаемый материал и примесь очень близки по своим физико-химическим характеристикам. Как правило, для получения чистых веществ применяют многоступенчатые технологические схемы, включающие различные химические и металлургические методы очистки.
Анализ содержания примесей в чистых веществах осуществляется с применением широкого круга химических, физико-химических и физических методов. Наиболее перспективным для анализа чистых веществ и полупроводников является масс-спектральный анализ, который позволяет в ходе одного сравнительно нетрудоемкого анализа определить большое число элементов с высокой точностью. Другой, не менее перспективный, но более трудоемкий и длительный метод анализа — радиоактивационный — позволяет исключить загрязнения, вносимые в в анализируемый материал в ходе самого анализа. Чувствительность радиоактивационного метода очень велика. Для полупроводниковых материалов наибольшее распространение получили косвенные, физические методы оценки чистоты на основании измерения концентрации носителей заряда, удельного сопротивления, подвижности и др. Физические методы анализа чистых веществ гораздо менее трудоемки и длительны, чем обычные аналитические методы определения содержания примесей. Однако результаты, полученные такими методами, дают представление только о суммарном содержании примесей. Тем не менее они позволяют надежно судить о возможности использования проанализированных чистых веществ в технологии полупроводниковых материалов.
Понятие химической чистоты материалов, а также способы ее выражения различны и зависят от области применения материала. В нашей стране для чистых веществ, использующихся в химической и металлургической практике, в зависимости от степени очистки установлены следующие классификации: «чистый» (марка Ч, содержание примесей от 2 · 10−5 до 1.0%), «чистый для анализа» (марка ЧДА, содержание примесей от 1 · 10−5 до 0.4%), «химически чистый» (марка ХЧ, содержание примесей от 5 · 10−6 до 0.5%) и «особо чистый» (марка ОЧ, содержание примесей 0.05%). Особо чистые вещества для
полупроводниковой техники разделяют на классы A, B и C. В класс A входят вещества, чистоту которых по содержанию основного компонента можно надежно охарактеризовать современными аналитическими методами. Классы чистоты B и C характеризуют чистоту по содержанию определяемых примесей. В последнем случае о содержании основного компонента можно говорить только условно, понимая под этим разницу между 100% и суммарным содержанием определяемых примесей.
Неметаллы и химические соединения относят к высоко чистым веществам, если содержание лимитирующих примесей в них не менее чем на порядок ниже по сравнению с соответствующей маркой ХЧ, на два порядка — для марки ЧДА и на три порядка — для марки Ч. К высоко чистым веществам принято относить также металлы и полупроводниковые материалы, если содержание каждой из контролируемых примесей в них не превышает
1 · 10−4% (по массе).
Высоко чистым веществам в зависимости от количества и суммарной концентрации контролируемых примесей присваивают марки двух категорий: ВЭЧ («вещества эталонной чистоты») и ОСЧ («особо чистые вещества»). В веществах марки ВЭЧ лимитируется общее содержание примесей и содержание некоторых нежелательных примесей. В веществах марки ОСЧ лимитируется содержание большого числа нежелательных примесей.
В зарубежной литературе принято квалифицировать вещества по чистоте числом (n) атомов (молекул) примесей, приходящихся на: 1) 1000 атомов (молекул) основного вещества, что обозначают n%o (n promille); 2) 106 атомов (молекул) основного вещества, n ppm (n parts per million); 3) 109 атомов (молекул) основного вещества, n ppb (n parts per billion). Кроме такой квалификации для обозначения веществ высокой степени чистоты используют символ N и различают вещества по качеству цифровыми индексами.
До сих пор речь шла о химической чистоте вещества. Однако понятие чистоты вещества значительно шире. В частности, в электронной технике при использовании полупроводников важна не только степень химической чистоты, но и отсутствие собственных дефектов в кристаллической решетке. Эти дефекты, так же как и химические примеси, сильно влияют на свойства полупроводников. Следует отметить, что концентрации собственных дефектов («физическая» чистота) и примесей (химическая чистота) взаимосвязаны, поскольку структурное совершенство кристаллов во многом зависит от наличия примесей в кристаллической решетке, а предел химической чистоты кристалла часто определяется типом и количеством собственных дефектов, образующихся при выращивании.
Итак, получение чистых полупроводниковых материалов производится химическими и металлургическими методами. Химическая очистка, например, германия и кремния заключается в получении их летучих соединений (как правило, галогенидов, см. гл. 6), которые легко отделяются от примесей и их соединений, а затем в восстановлении предварительно очищенных летучих соединений до элементарных Ge и Si. Металлургические методы заключаются в многократной перекристаллизации слитка основного вещества путем последовательного расплавления его участков. В этом курсе мы не будем рассматривать химические методы очистки веществ, так как они специфичны для каждого вещества, а остановимся на металлургических (кристаллизационных) методах очистки, при которых вещество может очищаться в процессе его выращивания. Кристаллизационные методы очистки основаны на различии содержания примесей в жидкой и твердой фазах, находящихся в равновесии при данной температуре (см. рис. 5.1). Следствием этого свойства является оттеснение примеси к концу слитка или ее захват в начальных частях слитка в ходе кристаллизации, то есть очистка вещества от примеси в любом случае.
В полупроводниковой технологии кристаллизация из жидкой фазы, как правило, применяется на последнем этапе технологического процесса очистки вещества. При этом наряду с высокой степенью очистки материала от примесей достигается и необходимое совершенство кристаллической структуры, то есть в конечном счете полупроводники получают в виде высокочистых монокристаллов.
Ge и Si — это два важнейших полупроводниковых элемента. Их способность к взаимодействию друг с другом и с другими химическими элементами имеет большое значение для электронной промышленности, поэтому процессы очистки мы будем рассматривать на их примере. Для разработки методов кристаллизационной очистки вещества необходимо знание фазовой диаграммы состояния вещества с присутствующими в нем примесями. Ge и Si кристаллизуются в кубической структуре типа алмаза и могут образовывать неограниченные твердые растворы только с немногочисленными элементами, которые также имеют структуру типа алмаза и атомные радиусы не сильно отличающиеся от атомных радиусов Ge и Si. Как правило, растворимость большинства примесей в Ge и Si очень невелика (≈0.1 ат.%). Кроме того, как уже упоминалось, кристаллизационные методы применяются на конечной стадии процесса очистки, а содержание остаточных примесей в очищаемом веществе настолько мало, что их взаимное влияние или взаимодействие между собой в среде основного материала практически отсутствует. Все это позволя
Рис. 5.1. Диаграмма состояния системы Ge–Sb.
ет при описании кристаллизационных методов очистки заменить одну сложную многокомпонентную систему совокупностью фазовых диаграмм бинарных систем: основной компонент — примесь.
Для бинарных систем диаграммы плавления–затвердевания, как уже обсуждалось ранее, весьма разнообразны и сложны. На рис. 5.1 приведена типичная диаграмма полупроводниковой системы: диаграмма состояния системы Ge–Sb. Однако для небольших концентраций примеси в полупроводнике все сложные диаграммы можно свести к двум типам без потери общности рассуждений при описании процессов кристаллизационной очистки. Действительно, в области малых концентраций примеси, то есть в области, примыкающей к точке плавления чистого компонента, различия между разными типами фазовых диаграмм пропадают: линии ликвидуса L и солидуса S в этих областях можно аппроксимировать прямыми линиями, касательными к кривым L и S в точке плавления основного компонента (рис. 5.2). В результате имеем два типа диаграмм:
если прямые L и S направлены вверх, то примесь понижает температуру плавления (рис. 5.2,а); 2) если прямые направлены вниз, то примесь повышает температуру плавления (рис. 5.2,б).
Для фиксированной температуры, при которой в системе сосуществуют жидкая и твердая фазы, концентрации примеси в кристалле и в жид
Рис. 5.2. Аппроксимация участка фазовых диаграмм вблизи точки плавления основного компонента отрезками прямых, касательных к кривым солидуса S и ликвидуса L в точке плавления основного компонента TA: а — примесь, понижающая температуру плавления; б — примесь, повышающая температуру плавления.
кости оказываются различными: концентрация примеси в твердой фазе CS определяется по абсциссе точки пересечения коноды с линией солидуса, а концентрация примеси в жидкой фазе CL — по абсциссе точки пересечения коноды с линией ликвидуса (рис. 5.2). В случае, когда примесь понижает температуру плавления, CS оказывается меньше CL (рис. 5.2,а), а в случае, когда примесь повышает температуру плавления, CS > CL (рис. 5.2,б). В процессе кристаллизации примесь будет либо оттесняться в расплав (в первом случае), либо захватываться кристаллом (во втором случае).
Действительно, для любой температуры из интервала, соответствующего области сосуществования жидкой и твердой фаз, концентрации основного вещества и примеси в этих фазах различны. Тем не менее, в равновесных условиях кристаллизации после завершения процесса весь закристаллизовавшийся слиток должен иметь состав, равный составу расплава (см. гл. 4). Соответственно этому не должно возникать никаких закономерных неоднородностей состава в кристаллизующемся материале, то есть в результате перекристаллизации никакой очистки твердой фазы не происходит. Однако в реальных условиях выращивания кристаллов твердая фаза кристаллизуется неоднородной по своему составу. Это происходит из-за медленных диффузионных процессов выравнивания состава в твердой фазе (предполагают, что равновесие в жидкой фазе и на границе раздела фаз успевает непрерывно устанавливаться, а диффузия в твердой фазе идет настолько медленно, что изменениями в составе твердой фазы можно пренебречь). Кроме того, при выращивании кристаллов создают такие градиенты температур, при которых нарастающие слои твердой фазы попадают в область с пониженной температурой, что также снижает скорость диффузионного выравнивания состава. Все эти процессы приводят к фиксации неоднородностей состава, возникающих в твердой фазе, и к очистке веществ при кристаллизации.
Если затруднена диффузия в жидкой фазе, то на границе раздела фаз в ходе процесса будет увеличиваться избыток компонента, которым обеднена образующаяся твердая фаза, и недостаток компонента, которым твердая фаза обогащена. Кристаллизация твердой фазы при этом будет происходить не из основной массы жидкой фазы, а из прилегающего к фронту кристаллизации слоя, что приводит к снижению эффекта очистки. Таким образом, затрудненность диффузии компонентов в жидком состоянии снижает эффективность очистки при кристаллизации. Еще одним важнейшим фактором, влияющим на эффективность очистки, являются условия проведения кристаллизации, которые должны обеспечивать монокристалличность получаемого материала.
Источник: И. А. Случинская, Основы материаловедения и технологии полупроводников, Москва — 2002
Источник