- Презентация на тему Культуры животных клеток
- Слайды и текст этой презентации
- Культивирование клеточных культур(растений и животных). Методы, виды и типы сред для культивирования. — презентация
- Похожие презентации
- Презентация на тему: » Культивирование клеточных культур(растений и животных). Методы, виды и типы сред для культивирования.» — Транскрипт:
Презентация на тему Культуры животных клеток
Презентация на тему Презентация на тему Культуры животных клеток, предмет презентации: Биология. Этот материал содержит 43 слайдов. Красочные слайды и илюстрации помогут Вам заинтересовать свою аудиторию. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас — поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций ThePresentation.ru в закладки!
Слайды и текст этой презентации
Культуры животных клеток
Животные клетки гораздо сложнее культивировать in vitro по сравнению с растительными клетками по следующим причинам:
Требуются более сложные по составу питательные среды.
Клетки очень чувствительны к механическим воздействиям.
3. Рост клеток происходит преимущественно после прикрепления к поверхности.
Культуры клеток животных классифицируют по следующим признакам:
способу культивирования;
происхождению;
продолжительности культивирования
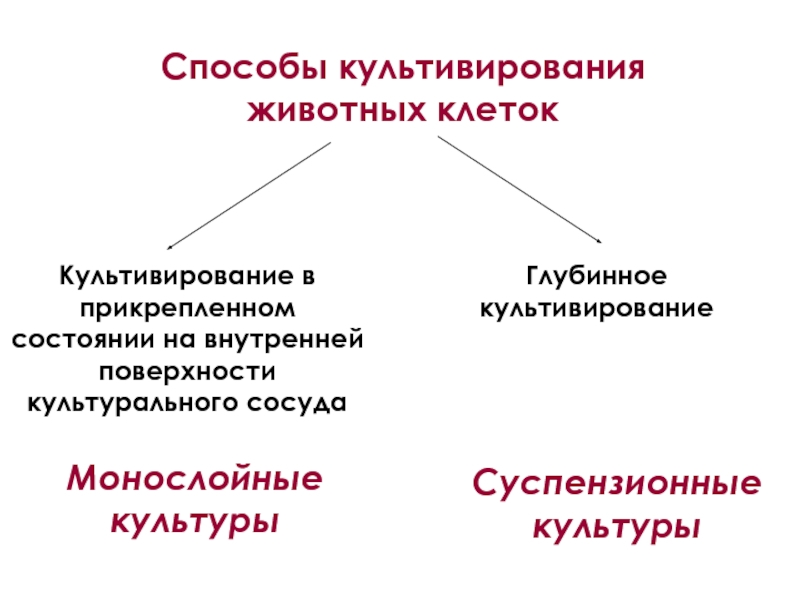
Способы культивирования животных клеток
Культивирование в прикрепленном состоянии на внутренней поверхности культурального сосуда
Монослойные (опорно-зависимые) культуры – культуры, клетки которых размножаются в форме монослоя, прикрепившись к субстрату
В качестве субстрата для опорно-зависимых клеток используют:
Пластик (полистирол, поликарбонат, поливинилхлорид, тефлон и др.)
Стекло (пирекс (алюмоборосиликатное стекло))
3. Металлы (нержавеющая сталь, титан)
Клетки связываются с субстратом не непосредственно, а с участием факторов адгезии
К факторам адгезии относятся белки:
• фибронектин;
• коллаген;
• поли-L-лизин;
• хондронектин (адгезия хондроцитов);
• ламинин (адгезия эпителиальных, нервных клеток)
культуры, растущие в неподвижных культуральных сосудах
культуры, растущие в сосудах, вращаемых вдоль своей продольной оси
Площадь, занимаемая клетками, увеличивается на порядок по сравнению со стационарными культурами
Роллерные культуры (до 700 бутылок в каждой установке, сотни литров) используют для получения противовирусных вакцин и интерферона
Суспензионные культуры – культуры, клетки которых способны расти во взвешенном (суспендированном) состоянии в жидкой питательной среде
Преимущества суспензионных культур:
простота субкультивирования;
экономия площадей;
простота сбора клеток
!Не все типы животных клеток могут расти в суспендированном состоянии
Типы культур животных клеток в зависимости от происхождения
А) в зависимости от типа исходной ткани:
— элементы соединительной ткани (фибробласты, лимфоциты, клетки хряща и др.);
мышечные ткани (скелетные, сердечные и гладкие мышцы);
эпителиальные ткани (печень, легкие, почки и др.);
клетки нервной системы;
эндокринные клетки (надпочечники, гипофиз и др.);
опухолевые клетки
Широко используемые культуры клеток животных: а – фибробласты; , б – эпителиальные клетки; с – мышечные клетки; d – лимфоциты; e — нейроны
Культура фибробластов ВНК 21 от сибирского хомяка впервые была получена в 1964 г.
Отличаются легкостью культивирования.
Используются для изучения клеточных, биохимических, молекулярных аспектов патогенеза ряда болезней.
Данные, полученные на культивируемых фибробластах, могут быть перенесены (экстраполированы) на условия in vivo.
Фибробласты – клетки молодости
Используются для омоложения в косметологии, лечения ожогов и рубцов
Клетки почек мыши (первичная культура)
Клетки почек хомяка (после нескольких субкультивирований)
Лоскут эпидермальной ткани, выращенной из клеток кожи человека in vitro
Могут расти в виде суспензионной культуры
Б) в зависимости от степени специализации ткани (эмбриональная либо взрослая ткань)
В) в зависимости от физиологического состояния (нормальная либо опухолевая ткани)
Одна из первых и наиболее широко используемых культур опухолевых клеток человека
8 января 1951 г.: выделена из раковой опухоли шейки матки (Henrietta Lacks (1920-1951))
Henrietta Lacks (circa 1945)
Recent National (US) Bestseller story about Henrietta Lacks
Опубликовано более чем 60,000 научных статей с использованием клеток HeLa.
Интенсивно используется для исследования раковых заболеваний.
Клетки HeLa называют «бессмертными», они способны делиться бесконечное число раз, в отличие от обычных клеток.
Были заражены геномом вируса папилломы, от которого умерла женщина. Обладают аномальным кариотипом: различные сублинии HeLa имеют 49 — 78 хромосом.
Типы культур животных клеток в зависимости от продолжительности культивирования
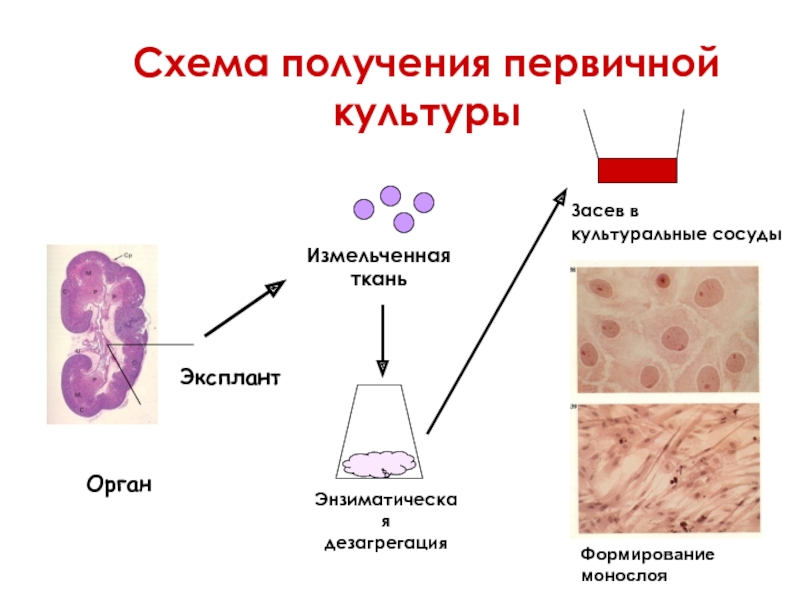
Получение первичной культуры
Этап 1. Стерильное удаление фрагмента ткани, органа животного
Источником получения первичных культур клеток чаще всего являются эмбриональные ткани (например, птиц и других экспериментальных животных, абортированных 8-14-недельных плодов человека)
Этап 2. Механическая и ферментативная дезагрегация экспланта
2.1. Ткань измельчается до кусочков объемом до 1-3 мм, экспланты отмываются от эритроцитов раствором Хенкса с антибиотиками пока жидкость не станет почти прозрачной
Получение первичной культуры
2.2. Для разрушения межклеточного вещества используют ферменты: трипсин или коллагеназу
Обработку раствором трипсина можно проводить при комнатной (холодная трипсинизация) либо повышенной температуре (+37ºС).
Кусочки ткани заливают раствором трипсина и в смесителе на магнитной мешалке перемешивают взвесь в течение 10-30 мин
Этап 3. Центрифугирование полученной суспензии клеток
Получение первичной культуры
Для отделения крупных комочков ткани и соединительнотканных волокон содержащую клетки жидкость фильтруют через марлю, затем центрифугируют при 800-1000 об/мин в течение 5 мин.
Этап 4. Ресуспендирование клеток в питательной среде, перенос в культуральные сосуды
Получение первичной культуры
Надосадочную жидкость сливают, осадок отмывают и разводят питательной средой, чтобы получить в 1 мл 100 000-400 000 клеток.
Взвесь клеток разливают в матрацы, плотно закрывают пробками и помещают в термостат при температуре 37 °С.
Этап 5. Формирование монослойной культуры
Получение первичной культуры
Прикрепляясь к субстрату, клетки в течение нескольких суток (как правило, 5-7) образуют монослой в виде пласта, сцепленного со стенками матрацев
Схема получения первичной культуры
Как определить, что клеточную культуру пора рассевать?
клетки образуют плотный монослой;
индикатор-краситель меняет цвет (например, индикаторный краситель Phenol Red (феноловый красный) меняет цвет с ярко-красного в свежей среде до желто-оранжевого в среде с культивируемыми в течение некоторого времени клетками)
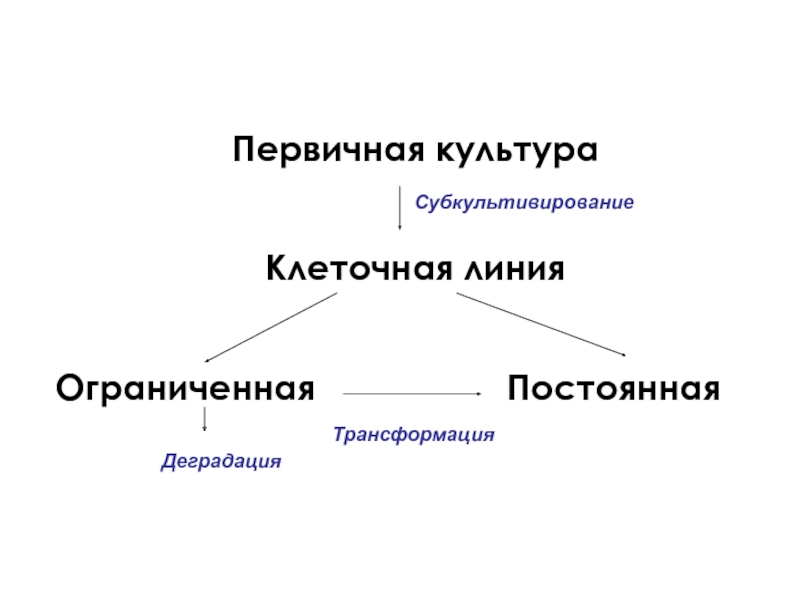
1. Клеточные линии с ограниченным ростом – культуры клеток, которые сохраняют способность к делению в течение определенного времени
К ним относятся диплоидные культуры (диплоидные штаммы).
В зависимости от вида животного продолжительность жизни диплоидных штаммов различна: для свиней – 25-40 пассажей, овец – 30-35 пассажей, крупного рогатого скота – 30-45 пассажей, лошадей – 50-60 пассажей.
Человек 50±10 пассажей
Наиболее активное размножение клеток диплоидных штаммов наблюдают в период от 5 до 20 пассажей, затем активность клеточного метаболизма снижается.
Предел или лимит Хейфлика — число делений соматических клеток Максимальное число делений различно в зависимости от типа клеток и ещё сильнее различается в зависимости от организма. Для большинства человеческих клеток предел Хейфлика составляет 52 деления.
Граница Хейфлика связана с сокращением размера теломер — участков ДНК на концах хромосом
Раковые клетки производят фермент теломеразу, которая наращивает теломеры на концах ДНК хромосом
2009 г. — присуждение Нобелевской премии за исследования в области применения теломеразы.
После определенного количества пассажей ограниченная клеточная линия либо стареет и дегенерирует, либо трансформируется и превращается в постоянную клеточную линию
2. Постоянная клеточная линия – линия клеток, которая поддерживается в результате последовательных субкультивирований неограниченно долгое время.
Полностью адаптированы к существованию вне организма. Автономно размножаются подобно бактериям.
Получают из раковых и реже нормальных тканей.
Преимущества постоянной клеточной линии:
•более высокая скорость роста;
высокая плотность, а следовательно, и больший выход биомассы;
возможность поддержания в более простых средах;
способность к росту в суспензии
Источник
Культивирование клеточных культур(растений и животных). Методы, виды и типы сред для культивирования. — презентация
Презентация была опубликована 2 года назад пользователемалиса богач
Похожие презентации
Презентация на тему: » Культивирование клеточных культур(растений и животных). Методы, виды и типы сред для культивирования.» — Транскрипт:
1 Культивирование клеточных культур(растений и животных). Методы, виды и типы сред для культивирования.
2 Клеточная культура это клетки (как правило, клетки животных или человека, принадлежащие одной ткани), выращиваемые обычно в пластиковых флаконах, планшетах или чашках Петри в специальной питательной среде при контролируемых температуре, влажности и уровне углекислого газа. Большая часть медико-биологических исследований проводится на клетках in vitro (то есть, не на живом организме, а на клетках «в пробирке»). Клетки используют в качестве модельного биологического объекта в научных исследованиях, при тестировании и производстве лекарств. Кроме этого, ученые научились исправлять генетические ошибки в клетках и наделять их способностью противостоять некоторым заболеваниям, что служит основой для медицинских технологий будущего генной и клеточной терапий.
4 Выделение клеток из тканей
5 Основное оборудование для культуральных работ Ламинарный шкаф CO 2 -инкубатор
6 Разновидности клеточных культур В лабораторной практике наиболее распространены раковые клетки. Они не имеют предела числа делений, будучи фактически бессмертными, что позволяет наращивать их в неограниченном количестве. Поскольку при постоянном росте клеток место в чашке Петри (или в объеме культуры) периодически кончается, время от времени их нужно пересевать: откреплять от поверхности, разбивать клеточные скопления с помощью ферментов и ЭДТА (хелатор кальция), а потом заново сеять в меньшей плотности, что позволяет им размножаться дальше. Эта процедура называется пассированием, а возраст культуры часто считают по числу таких пассажей.
7 Для получения культуры «нормальных» клеток Леонард Хейфлик выделял клетки из абортивного материала и обнаружил наличие предела числа делений клеток в культуре, получившего название предела Хейфлика. Для человеческих клеток этот предел составляет 50–70 делений и обусловлен укорочением теломер фундаментальным механизмом старения клеток.
8 Некоторым компромиссом между раковыми и нормальными являются иммортализованные клетки: полученные из нормальной ткани, они приобрели способность к неограниченному числу делений. Такой переход к бессмертию может происходить либо спонтанно, либо в результате искусственного введения определенных генов или слияния с раковыми клетками, как в случае гибридом. «Бессмертие» клеткам могут придать онкогены: большой Т-антиген вируса SV40, H-Ras, c-myc, E1A. Эти гены по сути вызывают опухолевую трансформацию клеток со всеми вытекающими недостатками (нестабильность генома, потеря физиологических функций и т.д.). Наиболее деликатный и получающий все большее распространение способ иммортализации это введение в клетку гена теломеразной обратной транскриптазы (TERT), которая достраивает теломеры и предотвращает их укорачивание при делении. Дифференцированные клетки (которые приобрели свою конечную специализацию) составляют большую часть клеток организма и практически не делятся. Будучи основными составляющими и «рабочими лошадками» во всех органах и тканях, они служат мишенью действия большинства лекарств, что делает их весьма востребованными для исследований. В культуре их можно получить путем направленной дифференцировки плюрипотентных стволовых клеток в нужный тип клеток, однако этот путь имеет существенные технические и, в случае человеческих клеток, еще и этические сложности.
9 Наиболее распространенными культурами дифференцированных клеток являются первичные клеточные культуры клетки, выделенные из зрелой ткани и не пассированные in vitro Число делений таких клеток критически зависит от условий культивирования, но редко составляет более 5–10 раз. Исключением являются стволовые, прогениторные и некоторые специализированные клетки, например, активированные Т- и B-лимфоциты. Кроме того, при длительном культивирование первичная культура склонна к замещению фибробластами.
11 Методы трансфекции и трансдукции
12 Схема получения и микрофотография колонии эмбриональных стволовых клеток (ЭСК) Эмбриональные клетки (
100 шт) получают на 5–9 день после экстракорпорального оплодотворения из внутренней клеточной массы бластоцисты. Эти клетки высаживают на фидер из умерщвленных фибробластов. Примерно через неделю можно обнаружить образованные ими колонии эмбриодные тельца (справа).
13 Индуцированные плюрипотентные стволовые клетки (ИПСК) Клетки взрослого организма получают путем биопсии, после чего их трансфецируют набором транскрипционных факторов (факторов Яманаки) и высаживают на фидер. Для репрограммирования клеток и формирования эмбриодных телец необходимо 16 дней. После этого из ИПСК можно получать клетки заданного типа путем направленной дифференцировки и при необходимости корректировать неисправные гены. Полученные клетки могут быть использованы для введения пациенту с целью восстановления функций ткани.
14 Применение Схема технологического процесса производства вакцин. Для биореактора клетки из флакона сначала размножают, для чего обычно используют роллерные бутыли. С поверхности бутылей клетки в виде суспензии переносят в биореактор, где постоянно перемешивают, в результате чего они формируют клеточные сфероиды. Это позволят более эффективно использовать объем и питательную среду и многократно увеличить концентрацию вируса на литр среды. При достижении максимальной плотности клетки заражают вирусом, после чего они начинают его производить в большом количестве. Вирус собирают из культуральной среды, инактивируют, очищают и в итоге получают готовую вакцину.
15 Биотехнологическое производство белков Аналогично вирусам клетки могут производить и отдельные белки, но, в отличие от вирусов, белки не способны сами себя воспроизводить в клетках. Чтобы клетка начала производить нужный белок в нее необходимо внедрить ген этого белка. В этом заключается суть биотехнологического производства, при котором клетки программируются на генетическом уровне на выработку того или иного белка. Полученные таким образом белки называют рекомбинантными.
16 Схема процесса производства антител гибридомная технология. B-клетки, производящие антитела, получают из селезенки иммунизированных мышей. Далее для наработки антител эти В-клетки необходимо размножить, но поскольку они имеют ограниченную способность к делению, их иммортализуют путем слияния с линией раковых клеток (миеломой). Клетки гибридом рассаживают по лункам планшета с сильным разведением для обеспечения попадания не более одной клетки в лунку. Далее выращивают потомков одной клетки клеточный клон. Антитела, производимые клоном клеток, идентичны и называются моноклональными.
17 Клеточная терапия Схема трансплантации аутологичных (своих) кроветворных СК из костного мозга (КМ) и периферической крови. СК из периферической крови получают после предварительной стимуляции их выхода в кровоток из КМ, вводя препарат рекомбинантного белка (гранулоцитарный колониестимулирующий фактор). После этого путем афереза из крови отбирают небольшие ядросодержащие клетки. Эта процедура проводится в непрерывном режиме, при котором кровь из одной руки поступает в центрифугу, где расслаивается на фракции. Необходимая фракция отбирается, а остальные возвращаются обратно пациенту в другую руку. СК костного мозга получают из тазобедренных костей, прокалывая их в нескольких местах с помощью специальной иглы. При этом получают в общей сложности около 1 л суспензии. Кроветворные СК выделяют путем иммуномагнитной сепарации по маркеру CD34 или путем культивирования в специальных условиях. После проведения химиотерапии эти клетки вводят в кровоток для восстановления клеток крови.
18 Среды для культивирования клеток Метод культивирования клеток и тканей находит применение в биотехнологии, молекулярной и клеточной биологии, фармацевтике и др. смежных областях. Клетки, ткани или органы выделяются из животных или растений и помещаются в искусственную питательную среду для поддержания роста и/или пролиферации. Основными условиями, необходимыми для оптимального роста клеток являются: контролируемый температурный режим, субстрат для прикрепления клеток (для адгезивных культур клеток), подходящая культуральная среда, СО2-инкубатор для контроля уровня рН, поддержание осмотического давления. Наиболее важным моментом для обеспечения оптимального роста/пролиферации клеток является выбор подходящей культуральной среды. Культуральная среда представляет собой жидкость или гель, разработанная для поддержания роста/пролиферации клеток различного происхождения. Среда для культивирования клеток состоит из определенного соотношения аминокислот, витаминов, солей, глюкозы, гормонов, факторов прикрепления, факторов роста; поддерживает буферную систему и осмотическое давление.
19 Основные компоненты культуральной среды Компоненты, обеспечивающие буферную систему культуральной среды. Культивируемые клетки сильно реагируют на изменение рН среды. Оптимальное значение рН для большинства клеток лежит в пределах 7,2-7,4. Бикарбонат натрия поддерживает «естественную» буферную систему культуральной среды (CO32- /HCO3-); требуя содержания 5-10 % СО2 в атмосфере, что легко выполнимо при культивировании клеток в СО2-инкубаторе. ХЕПЕС представляет собой фосфатную соль с буферной емкостью в пределах 7,2-7,4 рН. Не требует контролируемой газовой среды, но в больших концентрациях может быть токсичен для некоторых типов клеток. Феноловый красный используется как индикатор рН: красный при рН 7,4 и меняет свой цвет до оранжевого или желтого при уменьшении значения рН. Для культивирования клеток, чувствительных к эстрогену рекомендуется использовать среду без фенола красного. Соли Неорганические соли поддерживают осмотическое давление в среде и помогают в регуляции мембранного потенциала, обеспечивая среду ионами натрия, калия и кальция. Осмоляльность среды так же важна, как уровень рН при культивировании клеток. Оптимальное значение осмоляльности лежит в пределах мосмоль/кг в зависимости от типа культивируемых клеток. Аминокислоты Аминокислоты являются строительным материалом для белков; незаменимые аминокислоты всегда входят в состав культуральной среды. Особенно важен L-глутамин; обеспечивает азотом НАД, НАДФН и нуклеотиды, являясь вторичным источником энергии для метаболизма клетки. Заменимые аминокислоты также иногда добавляются в культуральную среду. Углеводороды Большинство сред включают в себя глюкозу и галактозу как источник энергии для клеток.
20 Белки и пептиды Наиболее часто используемыми белками и пептидами является альбумин, трансферрин и фибронектин; они особенно важны при бессывороточном культивировании. Альбумин связывает воду, соли, гормоны и витамины и транспортирует их между клетками и тканями. Фибронектин играет ключевую роль в адгезии клеток. Трансферрин – белок-переносчик железа, обеспечивающий железом клеточную мембрану. Жиры и жирные кислоты Особенно важны при бессывороточном культивировании, так как сыворотка обычно содержит их. Витамины Многие витамины необходимы для клеточного роста и пролиферации. В культуральную среду обычно добавляют рибофлавин, тиамин и биотин. Добавки Наиболее важным компонентом культуральной среды является сыворотка; она добавляется перед применением, примерно 5-10 %. Сыворотка представляет собой смесь альбуминов, факторов роста и ингибиторов роста; является источником витаминов, аминокислот, белков, углеводородов, жиров, микроэлементов, факторов роста. Наиболее часто используют бычью и телячью эмбриональную сыворотку. Факторы роста, цитокины, гормоны добавляются в культуральную среду для пролиферации и активации клеток. Антибиотики добавляются для предотвращения контаминации культуральной среды бактериями и грибами; однако антибиотики не предотвращают заражение культуральной среды микоплазмой.
21 Среда MEM (Minimum Essential Medium), или среда Игла была разработана Гари Иглом и является наиболее распространенной средой для культивирования клеток наряду со средой DMEM. Среда МЕМ содержит 13 аминокислот, 6 водорастворимых витаминов, холин и инозит, выполняющие роль углеводородного субстрата. Есть модификации среды МЕМ с солями Эрла и Хэнкса, а также α-модификация среды MEM с содержанием всех 21 аминокислот и солями Эрла. Среда DMEM (Dulbeccos Modified Eagles Medium) является модификацией среды BME (Basal Medium Eagle) и содержит в четыре раза больше аминокислот и витаминов, а также различные добавки, улучшающие рост клеток. Изначально среда DMEM была с содержанием глюкозы 1 г/л и применялась для культивирования эмбриональных клеток мыши. Затем появились модификации среды DMEM (с высоким и пониженным содержанием глюкозы, пирувата натрия, различных добавок) для культивирования клеток различных типов, в том числе нетрансформированных клеток и гибридом. Среда DMEM является наиболее распространенной средой для культивирования клеток наряду со средой MEM. Среда DMEM/F-12 в соотношении 1:1 применяется для выращивания широкого спектра клеточных культур. Изначально среда F12 была разработана для бессывороточного культивирования СНО клеток, клеток легких и мышиных L- клеток. В связи с богатым содержанием питательных веществ в среду DMEM/F12 можно добавлять относительно небольшое количество эмбриональной бычьей сыворотки (FBS–fetal bovine serum), либо использовать без сыворотки, но тогда необходимо добавлять такие факторы, как инсулин, трансферин, эпидермиальный фактор роста и др.. Среда RPMI-1640 была разработана в Roswell Park Memorial Institute (откуда и берет свое название) в 1966 Муром и его коллегами для культивирования лейкоцитов. В настоящее время используется для широкого спектра клеточных культур.
Источник