Основной способ репликации днк консервативный
Biology exam запись закреплена
Экзаменационный вопрос №5.Способы репликации ДНК: консервативный, полуконсервативный, дисперсионный. Опыты Мезельсон и Сталь
В 1957 г. Метью Мезелсон и Франклин Сталь поставили один из самых красивых биологических экспериментов, исследуя механизмы репликации ДНК. Для определения способа репликации ДНК необходимо четко различать материнские и дочерние молекулы. Мезелсон и Сталь выращивали бактерии кишечной палочки (Escherichia coli) на среде, содержащей в качестве источника азота его тяжелый изотоп – 15N. Молекула ДНК содержит большое количество атомов азота, при делении ДНК азот для новых цепочек берется из внешней среды. Тяжелый изотоп азота включался в состав молекулы ДНК и служил надежной меткой. Для того чтобы пометить практически всю бактериальную ДНК, необходимо было культивировать E. coli на такой среде в течение как минимум 12 поколений.
Мезелсон и Сталь длительное время культивировали E. coli на среде с 15N. После этого бактерии быстро переносили на среду, содержащую более легкий изотоп азота 14N. Благодаря тому, что клетки E. coli культивировались на двух различных средах, в состав молекул их ДНК входили оба изотопа азота: 14N и 15N. Отличить такие молекулы друг от друга можно было по плотности, поскольку масса нуклеотидов молекулы ДНК, содержащих 15N больше, по сравнению с обычной молекулой. ДНК бактериальных клеток, выращенных на среде с 15N, имела плотность 1,724 г/см3, а ДНК клеток, выращенных на среде с 14N – 1,710 г/см3.
После переноса культуры E. coli с одной среды на другую через каждое поколение Мезелсон и Сталь отбирали пробы. Контролем служила бактериальная культура, содержавшаяся на среде с 15N. Из каждой пробы бактериальных клеток путем центрифугирования извлекали ДНК. После этого ее смешивали с раствором хлористого цезия (CsCl) плотностью 1,7 г/см3, и вновь центрифугировали с очень высокой скоростью в течение нескольких дней. В результате осаждения молекул CsCl его раствор приобретал градиент плотности от 1,65 г/см3 в верхней части пробирки до 1,8 г/см3 у ее дна. В соответствии с этим, молекулы ДНК концентрировались в строго определенной области: у дна, в центре или в верхней части пробирки. Локализация ДНК устанавливалась на спектрофотометре, поскольку было известно, что она поглощает лучи с длиной волны 260 нм. Этот метод Мезелсон и Сталь разработали и опубликовали совместно с Джермом Виноградом (1913–1976) в 1957 г., непосредственно перед проведением эксперимента по репликации ДНК. пределяя плотность ДНК в каждой из проб, Мезелсон и Сталь обнаружили, что спустя одно поколение после переноса культуры E. coli со среды с 15N на среду с 14N плотность ДНК была промежуточной между 15N-ДНК и 14N-ДНК. Спустя два поколения половина бактериальных клеток содержала ДНК с легким изотопом азота (14N), а другая половина – такую же, как и в предыдущем поколении, ДНК промежуточной плотности. Через три поколения на среде с 14N в ¾ клеток содержалась легкая ДНК, а ¼ часть клеток сохраняла ДНК промежуточной плотности. Т. о., соотношение между числом генераций и распределением плотности ДНК точно соответствовало полуконсервативному типу репликации.
месте с тем, из гипотезы полуконсервативной репликации следовало, что ДНК с промежуточной плотностью между 15N-ДНК и 14N-ДНК должна быть гибридной. Это значит, что одна из ее цепей должна содержать только тяжелый изотоп азота (15N), а другая – только легкий (14N). Проверяя это предположение, Мезелсон и Сталь нагревали полученную ими ДНК промежуточной плотности в течение 30 минут при температуре 100 °С на водяной бане. При таких условиях двойная спираль молекулы ДНК денатурирует, образуя две отдельных цепочки, однако ковалентные связи между нуклеотидами в каждой из них не разрушаются. Проведя центрифугирование денатурировавшей ДНК в градиенте плотности хлористого цезия, Мезелсон и Сталь обнаружили, что в результате образовалось две фракции различной плотности. Плотность одной из них совпадала с плотностью молекул ДНК, содержащих тяжелый изотоп азота (15N), тогда как плотность другой была идентична плотности молекул ДНК с легким изотопом азота (14N). Из этого следовало, что молекула ДНК промежуточной плотности, образовавшаяся в первом поколении после переноса со среды с тяжелым изотопом азота на среду с легким изотопом, представляет собой гибридную молекулу. В ее состав входят две цепи – материнская, содержащая исключительно 15N и вновь синтезированная дочерняя, содержащая только 14N. Эти данные также подтвердили верность модели Уотсона–Крика и полуконсервативный характер репликации ДНК.
— Консервативная репликация:
Молекула ДНК служит матрицей для образования совершенно новой молекулы ДНК. В результате одна из образующихся клеток получает исходную молекулу ДНК, а другая – вновь синтезированную.
— Полуконсервативная репликация:
Две цепи исходной молекулы ДНК расходятся вследствие разрыва слабых водородных связей между азотистыми основаниями. Каждая из них служит матрицей для образования новой цепи, а возникающие между азотистыми основаниями водородные связи соединяют старую и новую цепи, восстанавливая целостность молекулы. В результате каждая новая клетка получает гибридную молекулу ДНК, состоящую из одной старой и одной новой цепи.
— Дисперсная репликация:
ДНК распадается на короткие фрагменты, используемые в качестве матриц для построения фрагментов двух новых молекул ДНК, которые затем каким-то образом соединяются между собой.
Источник
Биология. 11 класс
§ 16. Клеточный цикл. Репликация ДНК
Клеточный цикл . Все новые клетки образуются путем деления уже существующих. Этот принцип, как уже отмечалось, сформулировал Р. Вирхов еще в середине XIX в. Деление клеток обеспечивает непрерывность существования жизни на нашей планете. Именно благодаря ему осуществляются различные способы бесполого и полового размножения организмов. В основе процессов роста, регенерации и индивидуального развития многоклеточных организмов также лежит деление клеток.
Период существования клетки от момента ее образования из материнской клетки до собственного деления (включая это деление) или гибели называется клеточным циклом.
Продолжительность клеточного цикла у разных организмов и различных клеток в составе одного организма варьирует. Так, у бактерий в благоприятных условиях он длится примерно 20 мин. Короткие клеточные циклы (30—60 мин) характерны для бластомеров рыб и земноводных на этапе дробления, в то время как у млекопитающих промежуток времени между делениями бластомеров может достигать 10 ч и более. У взрослых мышей клетки кишечного эпителия делятся каждые 11—22 ч, а роговицы глаза — приблизительно один раз в трое суток. Для регулярно делящихся клеток многоклеточных организмов длительность клеточного цикла обычно составляет 12—36 ч.
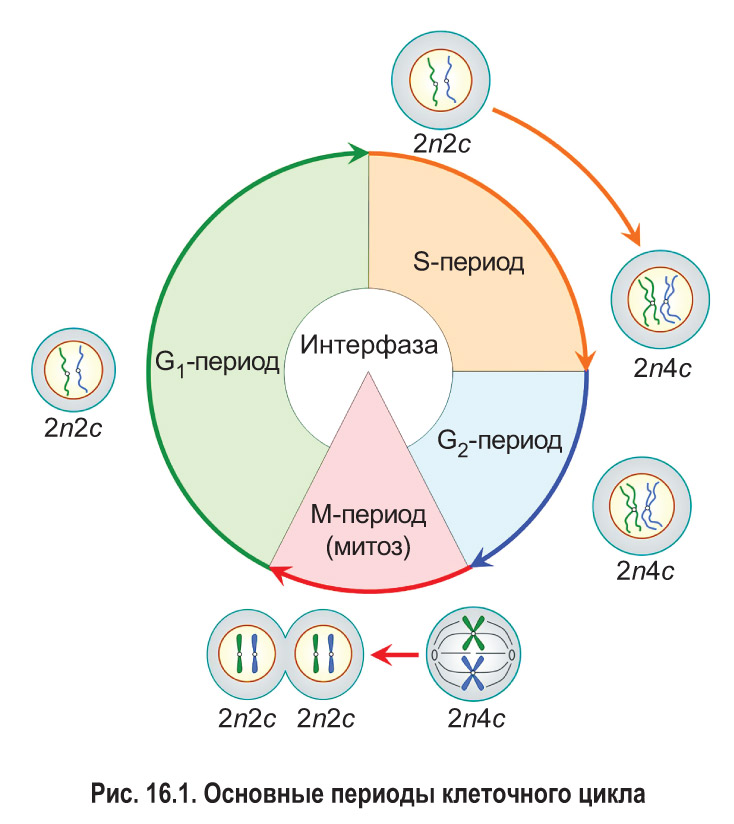
Пресинтетический, или G1-пе риод (от англ. gap — промежуток), начинается с момента образования новой клетки в результате деления материнской. Обычно это самый длительный период интерфазы и клеточного цикла в целом. В течение G1-периода молодая клетка интенсивно растет, в ней увеличивается количество органоидов и синтезируются различные соединения, необходимые для протекания процессов жизнедеятельности. В том числе образуются вещества, которые будут нужны для последующего удвоения молекул ДНК.
Вы уже знаете, что набор хромосом обозначают как n: например, 1n — гаплоидный набор, 2n — диплоидный. Набор молекул ДНК в клетках принято записывать с помощью буквы с. Из § 14 вам известно, что каждая хроматида содержит одну молекулу ДНК, т. е. количество молекул ДНК и хроматид в составе хромосом всегда совпадает. Таким образом, записи типа 1с, 2с, 4с отражают содержание в клетках не только молекул ДНК, но и соответствующих хроматид.
В пресинтетическом периоде каждая хромосома состоит из одной хроматиды. Следовательно, в G1-периоде число хромосом (n) и хроматид (с) в клетке одинаковое. Набор хромосом и хроматид диплоидной клетки в G1-периоде клеточного цикла можно выразить записью 2n2c.
В синтетическом, или S-периоде (от англ. synthesis — синтез), происходит удвоение молекул ДНК — репликация, а также удвоение центриолей клеточного центра (в тех клетках, где он имеется). После завершения репликации каждая хромосома состоит уже из двух идентичных сестринских хроматид, которые соединены друг с другом в области центромеры. Количество хроматид в каждой паре гомологичных хромосом становится равным четырем. Таким образом, набор хромосом и хроматид диплоидной клетки в конце S-периода (т. е. после репликации) выражается записью 2n4c.
Постсинтетический, или G2-период, продолжается от окончания синтеза ДНК (репликации) до начала деления клетки. В это время клетка активно запасает энергию и синтезирует белки для предстоящего деления (например, белок тубулин для построения микротрубочек, образующих впоследствии веретено деления). В течение всего G2-периода набор хромосом и хроматид в клетке остается неизменным — 2n4c.
Итак, интерфаза обычно включает три периода: пресинтетический (G1), синтетический (S) и постсинтетический (G2). На протяжении всей интерфазы хромосомы не спирализованы. Они располагаются в ядре клетки в виде хроматина .
После завершения интерфазы начинается деление клетки. Основным способом деления клеток эукариот является митоз, поэтому данный этап клеточного цикла обозначают как М-период. При митозе происходит спирализация хроматина . Это приводит к формированию компактных двухроматидных хромосом. После этого сестринские хроматиды каждой хромосомы отделяются друг от друга и затем попадают в разные дочерние клетки. Значит, дочерние клетки, образовавшиеся в результате митоза и вступающие в новый клеточный цикл, имеют набор 2n2c.
Обобщенная информация об основных периодах клеточного цикла представлена в таблице 16.1.
Таблица 16.1. Основные периоды клеточного цикла
Период
Содержание наследственного материала в диплоидной клетке
Источник
Лекция № 2. Репликация ДНК
Лекция № 2. Репликация ДНК
Согласно гипотезе Дж. Уотсона и Ф. Крика, каждая из цепей двойной спирали ДНК служит матрицей для репликации комплементарных дочерних цепей. При этом образуются две дочерние двухцепочечные молекулы ДНК, идентичные родительской, причем каждая из этих молекул содержит одну неизменную цепь родительской ДНК. Этот механизм репликации ДНК, названный полуконсервативным, был подтвержден в опытах на клетках Е. соli в 1957 г. М. Мезелсоном и Ф. Сталем. Исключены консервативный способ репликации, при котором одна дочерняя ДНК должна содержать обе исходные цепи, а вторая состоять из двух новосинтезированных цепей, и дисперсивный механизм репликации, при котором каждая дочерняя цепь ДНК состоит из участков родительской и новообразованной ДНК (рис.1, слайд 1).
Рис.1. Три механизма репликации ДНК: а) полуконсервативный;
б) консервативный; в) дисперсивный
Основные принципы репликации ДНК:
1. субстратами, из которых синтезируются новые церии ДНК, являются дезоксинуклеозидтрифосфаты (дНТФ), а не дезоксинуклеозидмонофосфаты (дНМФ), входящие в состав ДНК; в ходе включения в цепь ДНК от каждого нуклеотида отщепляются 2 фосфатных остатка (в виде пирофосфата, который вскоре гидролизуется до фосфатов):
свободные дНТФ→остатки дНМФ в новых цепях ДНК+пирофосфат
Использование дНТФ объясняется энергетическими причинами: образование межнуклеотидной связи требует энергии; источником ее и служит разрыв межфосфатной связи;
2. репликация ДНК – матричный процесс: каждая синтезируемая (дочерняя) цепь ДНК строится, используя в качестве матрицы одну из цепей исходной (родительской) ДНК. Основой при этом является принцип комплементарности.
3. процесс является симметричным: матрицами служат обе цепи родительской ДНК; также его можно назвать полуконсервативным;
4. удлинение цепи ДНК (или отдельного ее фрагмента) всегда происходит в направлении от 5’-конца к 3’-концу. Это означает, что очередной новый нуклеотид присоединяется к 3’ –концу растущей цепи. Кроме того, поскольку в любой молекуле ДНК комплементарные цепи антипараллелльны, то и растущая цепь антипараллельна матричной цепи. Следовательно, последняя считывается в направлении 3’→5’ (слайд 2 и 3).
5. неспаренная цепь ДНК, которая служит матрицей, и цепь-затравка, к которой присоединяются новые нуклеотиды;
Процесс репликации осуществляется сложным ферментным комплексом. При репликации ДНК у эукариот на каждой хромосоме работает не один, а сразу большое количество таких комплексов. Т. о. на хромосоме имеется много точек начала репликации ДНК. И удвоение ДНК совершается не последовательно от одного конца до другого, а одновременно во многих местах сразу, что значительно сокращает продолжительность процесса (слайд 5). Репликация распространяется в обе стороны от каждой точки начала репликации, при этом образуются репликативные вилки. Между вилками появляется постепенно расширяющееся «вздутие» или «глазок» — это уже реплицированные отделы ДНК. Соседние «вздутия» в конечном счете сливаются и ДНК оказывается удвоенной.
Ферментный комплекс работает так, что одна из двух синтезируемых им цепей растет с некоторым опережением по сравнению с другой цепью. Соответственно, первая цепь называется лидирующей, а вторая – запаздывающей. Лидирующая цепь образуется ферментным комлексом в виде непрерывного очень длинного фрагмента. Его длина (например для сперматогоний) 1 600 000 нуклеотидовю запаздывающая же цепь образуется в виде серии коротких фрагментов – примерно по 1 500 нуклеотидов. Это т. н. фрагменты Оказаки.
Образованию каждого фрагмента ДНК предшествует синтез короткой последовательности (из 10-15 нуклеотидов) РНК-затравки. Дело в том, что ДНК-полимераза (основной фермент синтеза ДНК) не может начинать процесс «с нуля», т. е. в отсутствие олигонуклеотидной прследовательности. А вот фермент синтеза РНК (РНК-полимераза) такой способность обладает; и этот фермент и начинает образование каждого нового фрагмента ДНК.
Ферменты и белки, участвующие в синтезе ДНК: ДНК-полимеразы, топоизомеразы (гиразы), хеликазы и лигазы, праймаза, ssb-белки. Весь комплекс, состоящий более чем из 20 репликативных ферментов и факторов, называется ДНК-репликазной системой, или реплисомой.
ДНК-зависимые ДНК-полимеразы – ключевые ферменты репликативного процесса, использующие принцип комплементарности для наращивания полинуклеотидных цепей. У прокариот есть три ДНК-полимеразы: Pol I, Pol II и Pol III. В репликации ДНК участвуют Pol I и Pol III. ДНК-полимераза I обладает полимеразной и (3’→5’, 5’→3’)-экзонуклеазной активностью, участвует в удалении праймера, застройке бреши, образовавшейся на месте праймера, коррекции ошибок при репликации, а также в репарации ДНК. В клетках E. coli насчитывается около 400 молекул этого фермента. Pol III осуществляет репаративный синтез ДНК.
Основным ферментом, катализирующим биосинтез новообразованной ДНК у прокариот, является ДНК-полимераза III (Pol III). Она обладает полимеразной и 3’→5’- экзонуклеазной активностью; синтезирует лидирующую и отстающую цепь ДНК, обладает корректорской функцией. В клетке содержится 10-20 молекул Pol III, она обладает повышенным сродством к матрице и обеспечивает высокую эффективность копирования.
Рис. 2. Субъединичная структура ДНК-полимеразы III
Кор-фермент состоит из субъединиц (αθε) (альфа, тета, эпсилон), β-белок выполняет функцию «скользящего зажима», τ (тау)-белок участвует в сборке и димеризации холофермента ДНК-полимеразы. γ(гамма)-комплекс (γ,δ(дельта),δ´,χ(хи),ψ(пси)) – ДНК-зависимая АТРаза, необходим для связывание затравки с матрицей и активации ДНК-полимеразы.


Для каждого короткого фрагмента ДНК-полимеразе требуется затравка (праймер) со спаренным 3¢-концом. Праймеры синтезируются ферментом ДНК-праймазой, которая формирует из рибонуклеозидтрифосфатов короткие РНК-затравки (праймеры), состоящие у эукариот примерно из 10 нуклеотидов (слайд). Затравки синтезируются с определенными интервалами на матрице отстающей цепи, далее их наращивает ДНК-полимераза, начиная всякий раз новый фрагмент Оказаки. Молекула ДНК-полимеразы продолжает наращивание до тех пор, пока она не достигнет затравки (праймера). Для того чтобы обеспечить непрерывность цепи ДНК из многих таких фрагментов, в действие вступает система репарации ДНК, которая удаляет РНК-затравку и заменяет ее на ДНК. Завершает процесс лигаза, соединяющая3¢-конец нового фрагмента с 5¢-концом предыдущего фрагмента.

Белки, подготавливающие родительскую ДНК к репликации
а) Точки начала репликации на молекуле ДНК имеют специфическую последовательность оснований, богатую парами А-Т.
Процесс начинается с того, что с каждой такой последовательностью связывается несколько молекул специальных узнающих белков. В случае бактерий такие белки называются DnаА (как первые белки, инициирующие репликацию). (Поэтому на рис. узнающий белок обозначен буквой А.)
Можно представить различные причины, по которым становится возможным взаимодействие узнающих белков с точками начала репликации. Среди этих причин:
— само появление в ядре узнающих белков или их определенная модификация;
— освобождение точек начала репликации от неких блокирующих элементов;
— появление в ядре каких-то третьих факторов, необходимых для рассматриваемого взаимодействия; и т. д.
Имеющиеся данные свидетельствуют в пользу первого варианта. Но в любом случае ясно, что здесь — одно из ключевых звеньев, контролирующих начало репликации.
Узнающие белки, обеспечив связывание ДНК-реплицирующего комплекса, видимо, далее не перемещаются вместе с ним по ДНК.
б) Одним же из «первопроходцев» выступает фермент геликаза (на рис. обозначен буквой Г). Он обеспечивает расплетение в районе репликативной вилки двойной спирали родительской ДНК: последняя разъединяется на одноцепочечные участки.
На это затрачивается энергия гидролиза АТФ — по 2 молекулы АТФ на разделение 1 пары нуклеотидов.
Видимо, одновременно происходит также вытеснение данного участка ДНК из связи с гистонами и другими хромосомными белками.
в) Однако расплетение спирали на некотором участке создает суперспирализацию перед этим участком.
Дело в том, что каждая молекула ДНК в целом ряде мест зафиксирована на ядерном матриксе. Поэтому она не может свободно вращаться при расплетении какого-то своего участка. Это и вызывает суперспирализацию, а с ней — образование структурного напряжения, блокирующего дальнейшее расплетение двойной спирали.
Проблема решается с помощью ферментов топоизомераз (И на рис.). Очевидно, они функционируют на еще нерасплетенном участке ДНК, т. е. там, где возникает суперспирализация. Топоизомеразы участвуют в процессе раскручивания двойной спирали в репликативной вилке. Эти ферменты изменяют степень сверхспирализации и приводят к образованию «шарнира», который создает условия для непрерывного движения репликативной вилки. Идентифицированы два типа топоизомераз: топоизомеразы I типа надрезают одну из двух цепей ДНК, в результате чего концевой участок двойной спирали может повернуться вокруг интактной цепи, и затем воссоединяют концы разрезанной цепи. Топоизомеразы типа II вносят временные разрывы в обе комплементарные цепи, изменяют степень сверхспирализации, а затем соединяют разорванные концы. Топоизомеразы помогают геликазе раскручивать ДНК для ее репликации. Имеется также топоизомераза II (бактериальная топоизомераза II называется гиразой). Этот фермент разрывает сразу обо цепи ДНК, опять-таки перенося соответствующие концы на себя. Это еще более эффективно позволяет решать проблему супервитков при расплетении ДНК.
Топоизомераза I разрывает одну из цепей ДНК, перенося ее проксимальный конец на себя (рис.). Это позволяет дистальному участку ДНК (от места расплетения до места разрыва) вращаться вокруг соответствующей связи целой цепи, что и предупреждает образование супервитков. Впоследствии концы разорванной цепи вновь замыкаются: один из них переносится с фермента на второй конец. Так что процесс разрыва цепи топоизомеразой легко обратим.
Хеликазы (от лат. helix — спираль, белок dnaB), осуществляют образование и продвижение вдоль спирали ДНК репликативной вилки – участка молекулы с расплетенными цепями. Эти ферменты для расплетения цепей используют энергию, высвобождающуюся при гидролизе АТР. Хеликазы действуют в комплексе с ssb-белками, которые связываются с одноцепочечными участками молекулы и тем самым стабилизируют расплетенный дуплекс.
г) Итак, «поддерживаемый» топоизомеразами, фермент геликаза осуществляет локальное расплетение двойной спирали ДНК на две отдельные нити.
С каждой из этих нитей сразу связываются специальные SSB-белки. Последние обладают повышенным сродством к одноцепочечным участкам ДНК и стабилизируют их в таком состоянии.
Заметим: тем самым данные белки отличаются от гистонов, которые связываются в первую очередь с двухцепочечными участками ДНК.
а) Специальный белок выполняет функции активатора праймазы (АП на рис.). После чего праймаза (П), используя в качестве матрицы соответствующий участок одноцепочечной ДНК, синтезирует короткую РНК-затравку, или праймер.
б) Далее в дело вступают ДНК-полимеразы. У эукариот известно 5 разных ДНК-полимераз. Из них β- и ε-полимеразы участвуют в репарации ДНК, γ-полимераза — в репликации митохондриальной ДНК, а α- и δ-полимеразы — в репликации ядерной ДНК.
При этом, по некоторым предположениям, α-полимераза связана и с праймазой, и с δ-полимеразой, а последняя, в свою очередь, — с белком РСNА (Р на рис.).
Данный белок выполняет роль «прищепки», которая крепит комплекс полимераз к реплицируемой цепи ДНК. Считается, что в «застегнутом» состоянии он, как кольцо, обхватывает цепь ДНК (рис.). Тем самым предупреждается преждевременная диссоциация полимераз от данной цепи.
Понятно, что ДНК-полимеразы осуществляют последовательное включение дезоксирибонуклеотидов в строящуюся цепь ДНК — комплементарно нуклотидам родительской цепи.
Но, кроме того, эти ферменты, видимо, имеют и ряд других важных активностей. Правда, для эукарио-тических ДНК-полимераз распределение данных активностей еще не вполне ясно. Поэтому приведем сведения относительно аналогичных бактериальных ферментов.
У бактерий основную «работу» по репликации ДНК выполняет ДНК-полимераза III, имеющая структуру димера. Именно с ней связан «зажим» типа белка РСNА.
Так вот, помимо ДНК-полимеразной активности, ДНК-полимераза III обладает еще одной — 3’→5′-экзонуклеазной. Последняя срабатывает в тех случаях, когда допущена ошибка и в строящуюся цепь включен «неправильный» нуклеотид. Тогда, распознав дефект спаривания оснований, фермент отщепляет с растущего (3′-) конца последний нуклеотид, после чего опять начинает работать как ДНК-полимераза.
Таким образом, происходит постоянный контроль системы за результатом своей деятельности.
в) Как мы знаем, новые цепи ДНК образуются вначале в виде фрагментов — относительно коротких (фрагментов Оказаки) и весьма длинных. И каждый из них начинается с праймерной РНК.
Когда ферментный комплекс, движущийся по родительской цепи, доходит до РНК-затравки предыдущего фрагмента, «зажим», связывающий ДНК-полимеразу III с родительской цепью ДНК, раскрывается, и данный фермент прекращает работу. В действие вступает ДНК-полимераза I (речь по-прежнему идет о бактериальных ферментах). Она присоединяется к З’-концу растущего фрагмента (рис. 1.14). При этом фермент уже не имеет устойчивой связи с данным фрагментом и с родительской цепью, но зато обладает даже не двумя, а тремя активностями.
Первая из них — «передняя», или 5’→3′-экзонуклеазная активность: последовательное отщепление нуклеотидов с 5′-конца РНК-затравки предшествующего фрагмента.
На освобождающееся место фермент включает дезоксирибонуклеотиды, присоединяя их, как обычно, к З’-концу «своего» фрагмента (ДНК-полимеразная активность).
И, наконец, подобно ДНК-полимеразе III, он «не забывает» проверять и при необходимости корректировать свою деятельность — с помощью «задней», или 3’→5′-экзонуклеазной, активности, направленной на удлиняемый фрагмент.
Функция ДНК-полимеразы I исчерпывается, когда растущий фрагмент вплотную доходит до дезоксирибонуклеотидов предыдущего фрагмента.
Что касается эукариот, то здесь функциональным аналогом бактериальной ДНК-полимеразы III является, видимо, комплекс α- и δ-ДНК-полимераз; при этом корректирующая 3’→5′-экзонуклеазная активность присуща δ-ДНК-полимеразе.
Функции ДНК-полимеразы I тоже распределены между двумя ферментами: 5’→3′-экзонуклеазная активность (удаление РНК-затравки) осуществляется, вероятно, специальной нуклеазой (Н на рис. 1.11), а ДНК-полимеразная активность (застраивание «брешей») — ДНК-полимеразой β (той, что участвует и в репарации).
г) Говоря о ферментах полимеризации, нельзя не сказать о самой трудной из связанных с ними проблем. Речь идет о синтезе запаздывающей цепи ДНК: как мы знаем, направление этого синтеза противоположно общему направлению распространения репликативной вилки.
Имеются, по крайней мере, две гипотезы, объясняющее это противоречие.
По одной из них (рис. 1.15, А), ферментный комплекс периодически прекращает образование лидирующей цепи, переходит на вторую родительскую цепь и синтезирует очередной фрагмент Оказаки запаздывающей цепи. Затем вновь возвращается на первую родительскую цепь и продолжает удлинять лидирующую цепь строящейся ДНК.
По другой версии (рис. 1.15, Б), на второй цепи родительской ДНК (матрице запаздывающей цепи) в процессе репликации формируется петля. Поэтому направление образования фрагмента Оказаки на внутреннем участке петли начинает совпадать с направлением движения полимеразного комплекса. Тогда последний может практически одновременно образовывать сразу обе цепи ДНК — и лидирующую, и запаздывающую.
Возможно, с этим связан тот факт, что бактериальная ДНК-полимераза III является димером, а у эукариот α- и δ-ДНК-полимеразы образуют единый комплекс. Но и при таком механизме запаздывающая цепь, как нетрудно убедиться, не может образовываться непрерывно, а только в виде фрагментов.
Ферменты, завершающие репликацию ДНК
В результате действия всех предыдущих ферментов каждая иовосинтезированная цепь оказывается состоящей из фрагментов, вплотную примыкающих друг к другу.
«Сшивание» соседних фрагментов осуществляется ДНК-лигазой (Л на рис. 1.11). Как и ДНК-полимеразы, этот фермент образует межнуклеотидную (фосфодиэфирную) связь.
Но если в полимеразной реакции одним из участников является свободный дНТФ (дезоксирибонуклеозидтрифосфат), то в ДНК-лигазной реакции оба участника — концевые дНМФ (дезоксирибонуклеозидмонофосфаты) в составе «сшиваемых» фрагментов.
По этой причине энергетика реакции иная, и требуется сопряженный гидролиз молекулы АТФ.
Заметим также, что ДНК-лигаза «сшивает» только такие одноцепочечные фрагменты, которые находятся в составе двухцепочечной ДНК.
Но и это еще не все. Молекула ДНК окажется реплицированной не полностью, если не произойдет специальный процесс репликации ее концов, или теломерных участков.
В этом процессе ключевую роль играет фермент теломераза.
Праймазы. Репликация ДНК требует РНК-праймеров. РНК-праймеры синтезируются праймазой (рис. 29.3), кодируемой dnaG геном.
Из рис 29.3 видно, что праймаза состоит из трех доменов:
■ – N-терминальный домен (110 аминокислот), содержит ДНК-связывающий мотив — цинковый палец;
■ – коровый (центральный) домен (322 аминокислоты) содержит каталитический центр;
■ – С-терминальный домен (151 аминокислота), взаимодействующий с dnaB.
Праймеры, синтезируемые праймазой E. coli, начинаются с последовательности pppAG на 5´-конце и состоят примерно из 10-12 нуклеотидов. Праймазы различаются как по структуре, так и по специфичности действия.
ДНК-лигазы катализируют процессы воссоединения фрагментов цепей ДНК, участвуя в образовании ковалентных связей между 5_-Р — и 3_-ОН-группами соседних дезоксирибонуклеотидов. Эти ферменты также используют энергию макроэргических связей, образующуюся при гидролизе АТР.
Репликация ДНК идет в три стадии: инициация, элонгация и терминация.
У бактерий инициация репликации ДНК начинается в уникальном сайте хромосомы, точке репликации – oriC, из которой репликация осуществляется двунаправлено до точки окончания (terminus). В результате образуются две репликативные вилки, которые продвигаются в противоположных направлениях, т. е. обе цепи реплицируются одновременно.
Инициаторный белок dnaA связывается с повторяющимися сайтами связывания на oriC, образуя специализированную нуклеопротеиновую структуру. Это приводит к локальному расхождению АТ-богатой последовательности oriC, которая служит зоной связывания для репликативной хеликазы (dnaB), и белка dnaC/
Далее dnaB активируется удалением dnaC, движется на определенное расстояние в направлении 5_→3_ и взаимодействует с праймазой dnaG. Праймаза синтезирует короткие РНК-праймеры для холофермента ДНК-полимеразы Ш. В месте инициации образуется промежуточный комплекс, состоящий по меньшей мере из пяти белков. Один из них – белок dnaB – может передвигаться вдоль ДНК, используя энергию гидролиза АТР, а также служит сигналом для активации праймазы (рис. 29.5).
Праймаза является компонентом праймосомы, состоящей из нескольких различных субъединиц. В состав праймосомы входит также комплекс белков DnaВ и DnaС, который вблизи репликационной вилки периодически участвует в формировании специфической вторичной структуры ДНК, подходящей для узнавания праймазой.
Инициация репликации ДНК заканчивается образованием репликативной вилки и синтезом РНК-затравки на лидирующей цепи ДНК (рис.29.5) благодаря формированию репликационного комплекса (рис.29.6).
В процессе элонгации происходит наращивание дочерних полинуклеотидных цепей ДНК. Каждая репликативная вилка включает, по крайней мере, две молекулы ДНК-полимеразы III, ассоциированные с несколькими вспомогательными белками. К последним относятся ДНК-топоизомеразы (гиразы), которые раскручивают плотно свернутую двойную спираль ДНК, и хеликазы, которые расплетают двухтяжевую ДНК на две цепи.
Ведущая цепь ДНК реплицируется непрерывно в направлении, совпадающем с движением репликативной вилки. Отстающая цепь считывается в направлении, противоположном движению репликативной вилки. Преодоление антипараллельности цепей ДНК при репликации, возможно, достигается путем образования петельной структуры (рис. 29.7).
Вначале на отстающей цепи синтезируются короткие фрагменты новой цепи ДНК, так называемые фрагменты Оказаки, названные так по имени их первооткрывателя. Каждый фрагмент начинается с короткой РНК-затравки (праймера), необходимой для функционирования ДНК-полимеразы. ДНК-полимераза III достраивает этот праймер до фрагмента ДНК длиной 1000-2000 дезоксинуклеотидных звеньев.
Источник










