- Промышленные способы получения водорода
- Способы получения водорода в промышленности и лаборатории
- Получение водорода в промышленности
- Потенциальные способы получения водорода в промышленности
- Получение водорода в лаборатории
- Переход на водород
- Технологические решения для широкого использования самого эффективного топлива уже существуют
- Как получить водород?
- Голубая мечта о зеленом водороде
Промышленные способы получения водорода



Федеральное агентство по образованию
Государственное образовательное учреждение
Высшего профессионального образования
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова
Кафедра общей химической технологии
Основные химические производства.
( для студентов V курса факультета “ Мененджмент, экология и экономика” по направлению № 060800 “Экономика и организация производства”)
Учебное пособие. Чабан Н.Г. –М.: ИПЦ МИТХТ им. М.В. Ломоносова, 2008.- 25 с.
Учебное пособие предназначено для студентов V курса дневного отделения факультета “Мененджмент, экология и экономика” по специальньности № 060800 “Экономика и организация производства”. В пособие представлены основные химические производства. Химизм процессов, оптимальные условия их проведения, технологические схемы, конструкции основных аппаратов.
Рекомендовано Библиотечно-издательской комиссией МИТХТ им. М.В. Ломоносова в качестве учебно-методического пособия.
Области применения: в производстве аммиака, метанола, соляной кислоты, в металлургии, используется при гидрокрекинге и гидроочистке нефтепродуктов и т.д.
Промышленные способы получения водорода.
1). Физический – извлечение водорода из коксового газа методом глубокого охлаждения фракционно-термическая конденсация).
2). Электрохимический метод – электролиз воды. Чистота получаемого водорода – 99,8%. Недостаток метода – большой расход электроэнергии.
3). Химический метод – конверсия углеводородных газов. В качестве исходного сырья применяются: углеводородный газ –метан или углеводороды бензиновой фракции нефти.
Конверсия метана – это окисление метана при высокой температуре кислородом или кислородосодержащими соединениями: Н2О или СО2.
По используемому окислителю и технологическому оформлению можно выделить следующие варианты процесса получения водорода: каталитическая парокислородная конверсия, высокотемпературная кислородная конверсия, каталитическая пароуглекислотная конверсия.
Окисление метана при получении синтез-газа протекает по следующим основным суммарным реакциям:
СН4 + Н2О 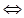
СН4 + СО2 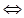
В реальных условиях ведения процесса реакции 1.1. и 1.3. являются обратимыми и эндотермическими, реакция 1.2. – необратимая и экзотермическая.
Первая ступень конверсии метана.
СН4 + Н2О 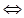
Помимо основной реакции возможно протекание побочной реакции разложения метана при температуре около 950 0 С:
Реакция (1.1.) в газовой фазе идет медленно (Е=62,2 кКал/моль). Для ее ускорения процесс проводят гетерогенно на поверхности твердого никелевого катализатора. Никель напыляет ся на твердый носитель Al2O3 или MgO. Катализатор изготавливается в виде гранул, таблеток или колец и состоит из пористого носителя и активного компонента. Наличие катализатора позволяет не только увеличить скорость основной реакции, но и при соответствующем избытке окислителей исключить протекание побочной реакции.
Срок службы катализаторов конверсии при правильной эксплуатации достигает трех лет и более. Их активность снижается при действии различных каталитических ядов. Никелевые катализаторы наиболее чувствительны к действию сернистых соединений. Отравление происходит вследствие образования на поверхности катализатора сульфидов никеля, совершенно неактивных по отношению к реакции конверсии метана. Отравленный серой катализатор удается почти полностью регенерировать в определенных температурных условиях при подаче в реактор чистого газа. Активность зауглероженного катализатора можно восстановить, обрабатывая его водяным паром. Поэтому перед конвектором метана газ подвергают сероочистке.
Никелевый катализатор работает в широком температурном интервале 600-1000 0 С.
С увеличением температуры увеличивается выход, но чем выше температура, тем больше затраты электроэнергии, выше требования к термической устойчивости материалов, и, соответственно, становится более дорогой аппаратура.

Так как часть метана конвертируется во второй ступени воздухом, реакцию (1.1.) не нужно доводить до конца. Поэтому оптимальная температура процесса определяется не условиями равновесия, а кинетикой реакции.
Кроме того, следует отметить, что при температуре 950 0 С начинает интенсивно проходить побочная реакция разложения метана с образованием сажи. Теряется активность катализатора.
Поэтому, наиболее оптимальной температурой проведения первой стадии конверсии метана является 800 0 С. В первой стадии конвертируется около 90% метана.
Для смещения равновесия в сторону образования продуктов необходимо давление снижать, так как процесс идет с увеличением числа молей. Однако, на практике процесс конверсии метана проводят при давлении 4 МПа. Отрицательное действие давления на выход компенсируют повышенной температурой и избытком водяного пара.
Преимущества повышенного давления:
1). Поскольку последующие процессы, в которых используют водород, ( производство аммиака и метанола) протекают при высоком давлении (30 МПа), то повышение давления при конверсии метана в целом позволяет снизить затраты на компримирование.
2). При повышенном давлении увеличивается скорость реакции, растет производительность.
3). Снижаются капитальные затраты на строительство водородной установки ( уменьшается объем водородной установки, объем трубопроводов, число компрессоров). Используется магистральное давление трубопроводов.
4). При повышенном давлении улучшается возможность использования скрытой теплоты водяного пара.
5). Улучшается очистка от СО2.
Выбор соотношения исходных компонентов.
Процесс конверсии метана проводят с избытком водяного пара. Избыток водяного пара выбирают с таким расчетом, чтобы скомпенсировать высокое давление, а также необходимостью его для последующего процесса конверсии СО.
Источник
Способы получения водорода в промышленности и лаборатории
Получение водорода в промышленности
В промышленности водород получают главным образом из природных и попутных газов, коксового газа и продуктов газификации топлива (водяного и паровоздушного газов), путем неполного окисления углеводородов.
Основным источником водорода в промышленности является конверсия (от лат. “превращение”) углеводородов, главным образом природного газа, парами воды (пароводяная конверсия):
CH4 + H2O → CO + 3H2, 800-900 °C, ΔH298 0 = 206,2 кДж/моль
С последующим каталитическим взаимодействием оксида углерода (II) с парами воды:
Катализатором этой реакции служит Fe2O3 с активирующими добавками (Cr2O3, Al2O3, K2O и др.).
Эндотермичность процесса конверсии метана можно частично восполнить энергией, выделяющейся при неполном его окислении.
Этот процесс называется кислородной конверсией метана. Поэтому в промышленности часто комбинируют все эти три процесса в один. Для этого природный газ смешивается с водяным паром и кислородом:
Диоксид углерода удаляют промывкой газовой смеси водой под давлением и окончательно – поглощением растворами щелочей.
Все описанные выше процессы используются как по отдельности, так и в сочетании друг с другом.
Помимо природного газа для получения водорода путем конверсии используют генераторный (CO + N2), водяной (CO + H2) – пароводяная конверсия, попутные газы – пароводяная и (или) кислородная конверсия.
В связи с уменьшением запасов углеводородного сырья большой интерес приобретает метод получения водорода восстановлением водяного пара раскаленным углем:
C + H2O → CO + H2, 1000 °C, ΔH298 0 = 131 кДж/моль
При этом образуется генераторный газ. Затраты энергии на его получение можно компенсировать за счет реакции неполного окисления угля:
C + 1/2O2 → CO, ΔH298 0 = -110,5 кДж/моль
При комбинировании этих процессов получается водяной газ, состоящий в основном из смеси водорода и угарного газа:
Важным следствием является то, что получаемые генераторный и водяной газы можно использовать для дальнейшего получения водорода методом пароводяной конверсии.
Из газовых смесей с большим содержанием водорода (коксовый газ, газы нефтепереработки) его получают путем глубокого охлаждения смеси, при котором практически все газы кроме водорода сжижаются.
Водород высокой чистоты получают электролизом водных растворов щелочей (NaOH или KOH). Раньше для этого использовалась серная кислота. Однако это нерационально из-за быстрого коррозионного разрушения стальной аппаратуры. Хотя образующаяся в процессе электролиза пероксодисерная кислота H2S2O8 может использоваться для получения пергидроля:
В случае щелочей концентрация этих растворов выбирается такой, которая отвечает их максимальной электрической проводимости (25% для NaOH и 34% для KOH). Электроды обычно изготавливают из листового никеля. Этот металл не подвергается коррозии в растворах щелочей, даже будучи анодом. В случае надобности получающийся водород очищают от паров воды и следов кислорода. Этим способом целесообразно получать водород в районах с дешевой электроэнергией.
Водород образуется также как побочный продукт в процессе получения хлора и щелочей электролизом водных растворов хлоридов щелочных металлов.
Потенциальные способы получения водорода в промышленности
1. Термолиз воды:
2H2O → 2H2 + O2, 2000 °C, электрическая дуга.
Недостаток – большие расходы энергии.
3. Биохимическое разложение воды под действием бактерий.
4. Химическое разложение воды, восстановление водорода:
Получение водорода в лаборатории
Восстановление металлами и неметаллами различных водородсодержащих соединений: воды, кислот, щелочей. Чаще используется взаимодействие разбавленных кислот (соляной, серной) с цинком, реже с железом. Если реакция выделения водорода проходит очень медленно, к кислоте добавляют несколько капель любого раствора CuCl2 (к соляной кислоте) или CuSO4 (к серной кислоте). Медь выделяется на цинке (или железе) и образует с ним гальваническую пару, что ускоряет выделение водорода. Реакции обычно проводят в аппарате Кипа.
Цинк обычно содержит примеси мышьяка, сурьмы и др. элементов, поэтому выходящий из аппарата водород немного загрязнен AsH3 и др. газами. Такой газ взрывоопасен, поэтому перед его использованием водород проверяют на чистоту. Для этого из аппарата Киппа через некоторое время после начала его работы отбирают в пробирку (держа ее вверх дном) пробу газа и подносят отверстие пробирки к пламени горелки. Если при этом водород горит спокойно (без хлопка), то он не содержит примеси воздуха. В противном случае следует еще раз удалить из аппарата часть газа и повторить испытание. Этот процесс повторяют до получения спокойного, слабо светящегося пламени водорода. В противном случае нужно менять цинк (железо) на более чистые.
Для демонстрационных опытов можно использовать такую установку:
Очень чистый водород в лаборатории можно получить электролизом водных растворов щелочей.
Для получения водорода в лаборатории также можно использовать гидрид кальция:
Пропускание паров воды через раскаленную железную трубку:
Источник
Переход на водород
Технологические решения для широкого использования самого эффективного топлива уже существуют
Водород — это самое энергоемкое и легкое вещество из всех видов топлива. Его производство не относится к инновациям — он производился миллионами тонн еще в советские времена, когда его использовали для производства аммиака для получения азотных удобрений.
Экспериментальная установка Wendelstein 7-X для исследования управляемого термоядерного синтеза. Грайфсвальд (Германия)
Фото: Getty Images
Экспериментальная установка Wendelstein 7-X для исследования управляемого термоядерного синтеза. Грайфсвальд (Германия)
Фото: Getty Images
Водород и сегодня используют для производства удобрений, повышения качества бензина, улучшения свойств стали, а также в пищевой промышленности для производства маргарина и твердых кондитерских жиров методом гидрогенизации растительных масел. Без него не обходятся все процессы гидроочистки, гидрообессеривания, гидрокрекинга, регенерации катализаторов. Его также широко применяют для охлаждения генераторов на электростанциях.
С тех пор как появилась перспектива перехода на водородную энергетику с углеводородной, потребность в водороде увеличилась на порядки. Сегодня эта перспектива стала реальностью, поскольку примерно десять лет назад была решена одна из основных проблем с его хранением для дальнейшего использования в качестве автомобильного топлива. Вместо тяжелых, дорогих и небезопасных стальных баллонов для сжатого под высоким давлением водорода стали применять легкие композитные емкости из углепластика, которые прекрасно помещаются в легковых автомобилях. Кроме того, стало возможным получать водород прямо по месту употребления. Появление таких технологий зажгло для водородной энергетики зеленый свет.
Около 20 лет назад во всем мире начали появляться автомобили на водороде, и бывшие выставочные центры пилотных моделей превратились в салоны-магазины серийных образцов. Количество автомобилей на водородном топливе сегодня исчисляется тысячами. Их стоимость составляет около $50–60 тыс. Серийные автомобили на водороде есть у Toyota, Hyundai, Honda. Предсерийные образцы тестируют Audi, Mercedes, BMW, Mazda, Ford и ряд других производителей. Все технические препятствия, столько десятилетий казавшиеся непреодолимыми, пройдены за считаные годы, и теперь вопрос только в экономической целесообразности для массового потребителя. В России такой автомобиль приобрел себе житель Красноярска, но в связи с отсутствием заправок в своем городе перевез машину в Москву и получает топливо в одном из научных институтов.
Как получить водород?
Для развития водородной энергетики нужно будет на государственном уровне решить вопрос, в каком виде доставлять водород к месту его получения. Дело в том, что водород содержится в очень многих видах ископаемых топлив.
«Наиболее дешевый водород получается методом паровой конверсии метана,— рассказывает заведующий отделом гетерогенного катализа Института катализа СО РАН Павел Снытников.— Другой способ — из аммиака. Для его транспортировки, как и для природного газа, в нашей стране даже существует трубопровод, так как аммиак сжижается всего при давлении 8,5 атмосферы. Третье решение — перевозка будущего водорода в виде метанола. В Китае метанол используют как автомобильное топливо. Но в России против метанола почему-то предубеждение, по-видимому, в связи с тем, что с давних пор у нас простой народ пил все, что горело, в том числе и метанол, и люди лишались зрения».
А вот получать его лучше всего там же, где будут потреблять, чтобы уйти от проблем транспортировки чистого водорода. Чтобы использовать водород, например, как автомобильное топливо, нужно закачать его в баллоны под давлением 700 атмосфер. Правда, на сжатие нужна дополнительная энергия. Не меньше энергии требуется на сжижение водорода, так что один из подходящих способов его транспортировки — это перевозка в химически связанном состоянии, например в виде метана, из которого водород должен производиться там же, где будет использоваться. То есть до заправки везут метан, а уже на самой заправке устанавливается небольшое производство, например, конвертер метана в водород. Но этот способ не очень хорош для экологии, поскольку на небольших производствах сложно обеспечить качественную очистку выбросов. Зато экономически он себя вполне оправдывает. Опыт Японии, Кореи и ряда других стран показал, что километр пробега на водороде выходит не дороже бензина. 4 кг водорода, закачанного в баллон, хватает примерно на 800 км пути обычного седана.
Получать водород можно практически из любого углеводородного топлива: из бензина, дизельного топлива или пропан-бутановых смесей. В Институте катализа им. Г. К. Борескова СО РАН ведется работа по гранту РНФ по тематике получения водорода из дизельного топлива. Также разрабатываются методы получения водорода даже из органических носителей, например из бор-гидридов. Главные задачи на будущее развитие водородной энергетики — это не только получение водорода, но и его хранение. Жидкий водород можно хранить только при низких температурах, поэтому его использовали только в критически важных областях, например, как ракетное топливо.
Если отвлечься от автомобилей и обратить внимание на энергообеспечение более крупных стационарных объектов, например жилых или промышленных комплексов, то вся идеология водородной энергетики строится на ее связке с другими источниками энергии. Например, с возобновляемыми — гидро-, ветряными, солнечными электростанциями или с крупными атомными электростанциями. Производство такой энергии идет в одном режиме, а тратится потребителями она в другом, поэтому, когда есть излишки энергии, ее можно тратить на получение водорода даже из обычной воды методом электролиза.
Голубая мечта о зеленом водороде
Электролиз — это способ получения водорода из воды, который, к сожалению, требует больших энергозатрат, поэтому он оправдан только в тех случаях, когда вырабатываемую энергию необходимо запасти, пусть даже и с невысоким КПД. Лучше всего использовать для этого источники, где постоянно возникают достаточно большие излишки энергии. Емкости аккумуляторов для ее сохранения не хватает, кроме того, аккумуляторы быстро разряжаются, а полученный методом электролиза водород — это гарантированный запас энергии, можно сказать, воплощение мечты о чистой энергии, так называемом зеленом водороде. К сожалению, пока всего 2% общего объема водорода в мире производится методом электролиза. 75% водорода получают из природного газа и 25% — сжиганием угля. Цены топлива, полученного по этим технологиям, также несопоставимы: $1,7 за 1 кг водорода из природного газа и $5–10 за водород, полученный электролизом. Впрочем, стоимость зависит от источника энергии. Например, от энергии АЭС зеленый водород вдвое дешевле ($3–5), чем от возобновляемых источников энергии.
Основные организации в России, заинтересованные в получении водорода — это компании «Росатом» и «Газпром». Атомные электростанции нуждаются в сохранении избытка энергии в виде водорода и дальнейшего его использования. А добывающая компания хочет перерабатывать природный газ в водород, имея соответствующие установки непосредственно в местах использования, например на автомобильных заправках. Для решения проблемы транспортировки водорода можно переводить его в спирты — метанол, диметиловый эфир, чтобы получать из них водород, что называется, «по требованию» для дальнейшего использования на энергоустановках. Это химия получения водородсодержащих компонентов, и она достаточно хорошо освоена.
Источник










