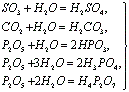- Основные оксиды — получение и химические свойства
- Получение основных оксидов
- Свойства основных оксидов
- Оксиды. Химические свойства и способы получения
- Оксиды: классификация, получение и химические свойства
- Классификация оксидов
- Получение оксидов
- Химические свойства оксидов
- Химические свойства основных оксидов
- Получение. Свойства
Основные оксиды — получение и химические свойства
Основными называются такие оксиды, которым соответствуют основания. Например, Na2O, CaO являются основными оксидами, так как им соответствуют основания NaOH, Ca(OH)2 .
Получение основных оксидов
- Взаимодействие металла с кислородом:
Этот метод неприменим для щелочных металлов, которые при окислении обычно дают пероксиды и супероксиды, и только литий, сгорая, образует оксид Li2O.
2. Обжиг сульфидов:
Этим методом нельзя получить оксиды щелочных металлов.
3. Разложение нерастворимых оснований (при t):
4. Разложение солей кислородсодержащих кислот — чаще нитратов и карбонатов (при t):
Свойства основных оксидов
Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О —2 , поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
1. Большинство основных оксидов не распадаются при нагревании, исключение составляют оксиды ртути и благородных металлов:
2. Типичные реакции с образованием солей:
| с кислотными оксидами: | BaO + SiO2 = BaSiO3 |
| с амфотерными оксидами: | MgO + Al2O3 = Mg(AlO2)2 |
| с кислотами: | СaО + Н2SО4 = CaSО4 + Н2О |
3. Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
4. Как и все другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
Источник
Оксиды. Химические свойства и способы получения
Оксиды — сложные вещества, состоящие из двух элементов, один из которых — атом кислорода в степени окисления -2.
По способности образовывать соли оксиды делят на солеобразующие и несолеобразующие (СО,SiO,NO,N2О). Солеобразующие оксиды, в свою очередь, классифицируют на основные, кислотные и амфотерные.
Основными называются оксиды, которым соответствуют основания, кислотными — оксиды, которым отвечают кислоты. К амфотерным относятся оксиды, проявляющие химические свойства как основных, так и кислотных оксидов.
Основные оксиды образуют только элементы-металлы: щелочные (Li2О, Na2О, К2О, Cs2О, Rb2О), щелочноземельные (CaO, SrO, BaO, RaO) и магний (MgO), а также металлы d-семейства в степени окисления +1, +2, реже +3(Cu2O, CuO, Ag2O, СrO, FeO, MnO, СоO, NiO). 
В обычных условиях оксиды могут находиться в трех агрегатных состояниях: все основные и амфотерные оксиды твердые вещества, кислотные оксиды могут быть жидкими (SO3,Сl2O7,Mn2O7), газообразными (CO2, SO2, NO2) и твердыми (P2O5, SiO2). Некоторые имеют запах (NO2, SO2), однако большинство оксидов запаха не имеют. Одни оксиды окрашены: бурый газ NO2, вишнево-красный CrO3, черные CuO и Ag2O, красные Cu2O и HgO, коричневый Fe2O3, белые SiO2, Аl2O3 и ZnO, другие — бесцветные (H2O, CO2, SO2).
Большинство оксидов устойчивы при нагревании; легко разлагаются при нагревании оксиды ртути и серебра. Основные и амфотерные оксиды имеют немолекулярное строение, для них характерна кристаллическая решетка ионного типа. Большинство кислотных оксидов вещества молекулярного строения (одно из немногих исключений — оксид кремния (IV), имеющий атомную кристаллическую решетку).
Источник
Оксиды: классификация, получение и химические свойства
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например , алюминий взаимодействует с кислородом с образованием оксида:
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например , фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
Но есть некоторые исключения .
Например , сера сгорает только до оксида серы (IV):
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например , при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
4. Еще один способ получения оксидов — разложение сложных соединений — солей .
Например , нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Источник
Получение. Свойства
Основные оксиды . К основным относятся оксиды типичных металлов, им соответствуют гидроксиды , обладающие свойствами оснований.
Получение основных оксидов:
1. Окисление металлов при нагревании в атмосфере кислорода:
2 Mg + О 2 = 2М g О,
2С u + О 2 = 2С u О.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды , поэтому оксиды Na 2 О, К2О крайне труднодоступны.
2. Обжиг сульфидов:
2 CuS + ЗО 2 = 2С u О + 2 S О2,
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
3. Разложение гидроксидов:
| t o | ||
| Cu(OH)2 | = | CuO + H2O |
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот:
| t o | ||
| BaCO3 | = | BaO + CO2 |
| t o | ||
| 2Р b ( N О3)2 | = | 2 Pb О + 4 NO 2 +O2 |
| t o | |
| 4FеSО4 | = |
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
| t o | |
| [ZnOH]2 | = |
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О 2 — , поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
| t o | |
| 2HgO | = |
| t o | |
| 2Ag2O | = |
Основные оксиды при нагревании могут вступать в реакции кислотными и амфотерными оксидами, с кислотами:
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
| t o | |
| Fe2O3+2Al | = |
| t o | |
| 3CuO+2NH3 | = |
| t o | |
| 4FeO+O2 | = |
Кислотные оксиды. Кислотные оксиды представляют ее оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
| t o | |
| 4P+5O2 | = |
| t o | |
| 2ZnS+3O2 | = |
| t o | |
| K2Cr2O7+H2SO4 | = |
| Nа2SiO3 + 2НСl | = | 2NаСl + SiO2↓ + Н2О |
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, с щелочами:
| t o | |
| P2O5+Al2O3 | = |
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
| t o | |
| CO2+C | = |
| 2SO2+O2 | t o |
 |
Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
К числу амфотерных оксидов относятся оксид алюминия А l 2 О3, оксид хрома ( III ) С r 2 О3, оксид бериллия ВеО , оксид цинка Zn О , оксид железа ( III ) Fe 2 О3 и ряд других.
Идеально амфотерным оксидом является вода Н2О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:
С u 2+ + Н2О 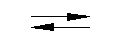
СО3 2- + Н2О 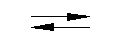
Источник