ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ УГЛЕКИСЛОГО ГАЗА
Определением количества СО2 широко пользуются как критерием оценки чистоты воздуха в помещениях для сельскохозяйственных животных и при расчетах вентиляции.
Углекислота – бесцветный газ, без запаха, кисловата на вкус. Масса 1 литра диоксида углерода при нормальных условиях (температуре 0°С и давлении 760 мм. рт. ст. ) 1,9769 г, 1 миллиграмм его занимает объем 0,509 см 3 (мл). Основным источником углекислоты в помещениях для животных является выдыхаемый воздух. Содержание СО2 в воздухе животноводческих помещений допускается 0,25. 0,3 % или 2,5. 3 литра на 1м 3 воздуха (4911,51. 5893,91 мг/м 3 ).
Существуют несколько методов определения углекислого газа в воздухе: объемные методы – содержание СО2 определяется при помощи газоанализаторов Холдена, Кудрявцева, Калмыкова; титрометрические методы Субботина-Нагорского и Гесса; сравнительный метод Прохорова.
Принцип титрометрических методов состоит в том, что диоксид углерода, содержащийся в определённом объёме воздуха, связывается едкой щёлочью – гидроксидом бария (Ва(ОН)2). Концентрация едкого бария при этом меняется и по разности титров поглощающего раствора до и после поглощения СО2 определяется количество углекислоты во взятом для исследования объеме воздуха.
Метод Д.В. Прохорова может быть использован как экспресс метод, основанный на сравнительном исследовании воздуха помещений и воздуха наружной атмосферы, в котором содержание СО2 сохраняется на уровне 0,03. 0,04 %.
Дата добавления: 2015-10-21 ; просмотров: 11634 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Самостоятельная работа студентов



Методика определения СО2 по Д.В.Прохорову.
Принцип метода: метод основан на сравнительном исследовании изучаемого воздуха помещений и атмосферного воздуха. Сущность метода состоит в нейтрализации нашатырного спирта (NH4ОН) двуокисью углерода исследуемого воздуха.
Ход работы:готовят рабочий раствор (500 мл дистиллированной воды, 1 капля нашатырного спирта, 2 капли спиртового раствора фенолфталеина). Затем шприцем Жане набирают 20 мл этого раствора, имеющего розовую окраску, и набирают исследуемый воздух в максимально возможном количестве (для чего поршень шприца оттягивают до упора). Затем отверстие шприца надежно закрывают маленькой резиновой пробочкой. Энергичным встряхиванием шприца (7-8 раз) воздух приводят в контакт с поглотителем. Вслед за этим пробочку снимают, воздух выпускают из шприца и аналогичным образом набирают следующие порции. Процедура продолжается до тех пор, пока раствор в шприце не обесцветится. Считают количество порций воздуха, необходимого для обесцвечивания. Чем меньше порций понадобилось для обесцвечивания реактива Прохорова, тем большая концентрация СО2 в исследуемом воздухе. При расчете исходят из того, что содержание углекислоты в исследуемом воздухе во столько раз больше, во сколько раз меньше требовалось взять шприцев воздуха для обесцвечивания щелочного раствора. Следовательно, концентрацию СО2 атмосферного воздуха (0,03-0,04 %) умножают на соотношение количества шприцев, потребовавшихся в первом (атмосфера) и втором (воздух помещения) случаях.
Пример. Для обесцвечивания раствора пришлось забрать шприцем 50 порций наружного воздуха, а в исследуемом помещении – 10 порций, следовательно, концентрация СО2в исследуемом воздухе:
0,04• 50:10 = 0,2 % (2 ‰).
Контрольные вопросы.
1.Химический состав атмосферного воздуха и значение отдельных компонентов воздуха.
2. Влияние повышенных и пониженных концентраций кислорода, углекислого газа и азота на организм человека при различных значениях атмосферного давления.
3. Источники загрязнения воздуха.
4. Вещества-загрязнители атмосферного воздуха и воздуха помещений.
5. Мероприятия, направленные на предотвращение загрязнения воздуха.
6. Показатели чистоты воздуха помещений и их гигиеническое значение.
7. Нормативные документы, обеспечивающие охрану атмосферного воздуха от загрязнения.
8. Методы отбора проб воздуха.
9. Определение содержания углекислого газа в воздухе помещений (по методу Д.В.Прохорова).
Литература.
1. Большаков А.М., Новикова И.М. «Общая гигиена». Учебная литература для студентов фармацевтических ВУЗов и фармацевтических факультетов медицинских ВУЗов.- М., «Медицина», 2002 г.
2. Учебник под ред. Румянцева Г.И. «Гигиена» — Москва, ГЭОТАР МЕДИЦИНА, 2000 г.
3. Габович Р.Д. «Гигиена». Учебник. – Киев, 1984 г.
4. Пивоваров Ю.П. Руководство к лабораторным и практическим занятиям по гигиене и основам экологии человека. – М., 1999 г.
5. Лекционный материал.
1. ГОСТ 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования.
2. ГОСТ 12.1.007-76. Вредные вещества. Классификация и общие требования.
3. Закон об охране атмосферного воздуха (1999г.).
4. Закон о санитарно-эпидемиологическом благополучии населения (1999г.).
Методическая разработка обсуждена на кафедральном совещании от «___»____________20____г., протокол №______.
Источник
Определение углекислого газа методом Гессе.
Принцип метода: после отбора пробы воздуха в бутыль известной ёмкости вносится определённое количество раствора едкого барита. Последний быстро поглощает углекислый газ из воздуха, содержащегося в бутыли, образуя нерастворимую соль — углекислый барий. При этом титр едкого барита становится меньше истинного. По разнице истинного титра едкого барита и титра после связывания СО2 вычисляется количество углекислого газа в исследуемом воздухе.
Отбор пробы воздуха. Воздух для исследования забирается в бутыль (ёмкостью 0,5 — 0,7 л), предварительно заполненную до краёв водой. В исследуемом помещении вода из бутыли выливается и бутыль закрывается резиновой пробкой. При выливании необходимо исключить возможность загрязнения отбираемой пробы выдыхаемым воздухом исследователя. Для этого в момент отбора пробы достаточно отвернуть лицо в сторону.
Порядок исследования. В бутыль с пробой воздуха из бюретки отмеривают 25 мл едкого барита и вносят 3 капли фенолфталеина (при внесении реактивов необходимо вынимать не всю пробку, а только стеклянную палочку). После добавления реактивов содержимое бутыли встряхивают 10 минут. По истечении срока несвязанный с углекислым газом едкий барит оттитровывают точным раствором щавелевой кислоты до обесцвечивания.
Определение истинного титра едкого барита. Вследствие нестойкости едкого барита необходимо определять его истинный титр при каждом анализе воздуха. Определение ведётся во флаконе ёмкостью 100 мл с воздухом, не содержащим углекислый газ. С этой целью воздух этого флакона с помощью мехов продувают через натронную известь, поглощающую углекислый газ. Для полной замены воздуха во флаконе достаточно 8-10 качаний мехов.
После продувания во флакон отмеривается 25 мл едкого барита и 3 капли фенолфталеина. Титрование ведётся раствором щавелевой кислоты до обесцвечивания. Это даёт истинный титр едкого барита. Он будет всегда больше, чем результат титрования бутыли с пробой исследуемого воздуха.
Расчёт содержания углекислого газа.
а) истинный титр барита равен 26,1 мл щавелевой кислоты;
б) титр барита после поглощения углекислоты из воздуха в объёме бутыли
600 мл равен 23 мл щавелевой кислоты;
в) разница в титре 26,1 – 23,0=3,1 мл щавелевой кислоты.
Следовательно, при титровании бутыли с пробой воздуха титр оказался меньше истинного на 3,1 мл щавелевой кислоты.
I мл раствора щавелевой кислоты соответствует в реакции 0,1 мл углекислоты. Отсюда следует, что в 600 мл воздуха содержится углекислоты:
Содержание углекислоты принято выражать в о /оо, т.е. в 1000 мл (литр) воздуха. Следовательно:
в 600 мл воздуха ——— 0,31 мл углекислоты
в 1000 мл воздуха ——— Х мл углекислоты
0,31 мл х 1000 мл
Гигиеническая норма содержания углекислого газа допускается до 1,0 0 /оо.
По результатам исследований оформляется гигиеническое заключение.
При проведении санитарного и экологического контроля атмосферного воздуха и воздуха рабочей зоны для определения химических и механических примесей в настоящее время используются разнообразные приборы. Приводим примеры некоторых из них:
· пробоотборные устройства (аспираторы) ПУ-2Э/ПУ-4Э предназначены для автоматического отбора проб газов и аэрозолей в атмосферном воздухе, промышленных выбросах, воздухе рабочей зоны;
· электроаспиратор Мигунова с поглотительными приборами, адсорбентами, фильтрами предназначен для отбора проб газов и пыли в атмосферном воздухе, промышленных выбросах, воздухе рабочей зоны;
· портативные газоанализаторы ЭЛАН предназначены для измерения оксида углерода в атмосферном воздухе и воздухе рабочей зоны, кислорода и токсичных компонентов (Н2S, SО2, NО) в воздухе рабочей зоны;
· АЭРОКОН – измеритель массовой концентрации аэрозольных частиц различного происхождения и химического состава в атмосферном воздухе и воздухе рабочей зоны;
· измерители пыли ТМ-DАТА предназначены для измерения массовой концентрации тонкодисперсной пыли в атмосфере и рабочих помещениях;
· радиоизотопный измеритель концентрации пыли ИКАР-ФБ-01;
· газожидкостные хроматографы и высокоэффективные жидкостные хроматографы и др.
Значение воды.
1.вода (гидросфера) является составной частью окр. Среды
2.оказывает влияние и на атмосферу и на литосферу
3.гигиеническое значение – для поддержания чистоты тела, одежды, жилища
4.физиол. знач. – все ткани содержат некоторое кол-во воды. Стекловидное тело глаза-99,9%
6.водные виды спорта
8.для с/х культур
1.холера-чисто водный вид инфекции
4.хим. в. Растворяясь могут попасть в воду
Нормы водопотребления.
1. Среднесуточное (за год) водопотребление на хозяйственно-питьевые нужды населения
| Степень благоустройства районов жилой застройки | Удельное хозяйственно-питьевое водопотребление в населенных пунктах на одного жителя среднесуточное (за год), л/сут. |
| Застройка зданиями, оборудованными внутренним водопроводом и канализацией: | |
| без ванн | 125 — 160 |
| с ванными и местными водонагревателями | 160 — 230 |
| с централизованным горячим водоснабжением | 230 — 350 |
1. Для районов застройки зданиями с водопользованием из водоразборных колонок удельное среднесуточное (за год) водопотребление на одного жителя следует принимать 30-50 л/сут.
2. Удельное водопотребление включает расходы воды на хозяйственно-питьевые и бытовые нужды в общественных зданиях (по классификации, принятой в СНиП 2.08.02-89*), за исключением расходов воды для домов отдыха, санаторно-туристских комплексов и детских оздоровительных лагерей, которые должны приниматься согласно СНиП 2.04.01-85 и технологическим данным.
3. Выбор удельного водопотребления в пределах, указанных в таблице, должен производиться в зависимости от климатических условий, мощности источника водоснабжения и качества воды, степени благоустройства, этажности застройки и местных условий.
4. Количество воды на нужды промышленности, обеспечивающей население продуктами, и неучтенные расходы при соответствующем обосновании допускается принимать дополнительно в размере 10-20 % суммарного расхода воды на хозяйственно-питьевые нужды населенного пункта.
5. Для районов (микрорайонов), застроенных зданиями с централизованным горячим водоснабжением, следует принимать непосредственный отбор горячей воды из тепловой сети в среднем за сутки 40 % общего расхода воды на хозяйственно-питьевые нужды и в час максимального водозабора – 55 % этого расхода. При смешанной застройке следует исходить из численности населения, проживающего в указанных зданиях.
6. Удельное водопотребление в населенных пунктах с числом жителей свыше 1 000 000 человек допускается увеличивать при обосновании в каждом отдельном случае и согласовании с органами государственного надзора.
Дата добавления: 2019-07-15 ; просмотров: 445 ; Мы поможем в написании вашей работы!
Источник
Определение содержания углекислого газа
Определение содержания углекислого газа
В атмосферном воздухе
Атмосфера – газовая оболочка Земли, простирающаяся более чем на 1500 км от ее поверхности. Суммарная масса воздуха, т.е. смеси газов, составляющих атмосферу, 5,1. 5,3 . 10 15 т. Молекулярная масса чистого сухого воздуха – 28,966.
Для атмосферы характерен постоянный обмен веществом, энергией с гидросферой, литосферой, живыми организмами, а также с космическим пространством. Атмосферу в порядке удаления от поверхности Земли делят на тропосферу (до высоты 11 км), стратосферу (до высоты 50 км), мезосферу (50-85 км), ионосферу (от 85 до 500 км), экзосферу (свыше 500 км). Состав атмосферы – результат длительных эволюционных процессов в недрах Земли и на ее поверхности, где решающим фактором была деятельность зеленых растений, животных и микроорганизмов. Данные о составе атмосферы приведены в табл. 1.
Приближенный состав атмосферы
| Элемент и газ | Содержание в нижних слоях атмосферы, % | |
| По объему | По массе | |
| Азот Кислород Аргон Неон Гелий Криптон Водород Углекислый газ (в среднем) Водяной пар: в полярных широтах у экватора Озон : в тропосфере в стратосфере Метан Оксид азота (IV) Оксид углерода » в атмосфере городов | 78,064 20,946 0,934 0,0018 0,000524 0,000114 0,00005 0,034 0,2 2,6 1 . 10 –6 10 -3 . 10 –4 1,6 . 10 –4 10 –6 Следы 0,8 . 10 –5 | 75,5 23,14 1,28 0,0012 0,00007 0,0003 5 . 10 -6 0,0466 0,9 . 10 –4 0,3 . 10 –6 7,8·10 –6 |
От стратосферы к ионосфере плотность газов уменьшается, в стратосфере находится около 20% массы всех газов, в остальных слоях – всего около 0,5 %. Самый важный компонент стратосферы и ионосферы – озон (O3), образующийся в результате фотохимических реакций. Максимальная концентрация озона зафиксирована на высоте 25–30 км. Озоновый слой поглощает губительное для жизни УФ-излучение Солнца. В стратосфере и более высоких слоях под воздействием солнечной радиации молекулы газов диссоциируют на атомы (на высоте более 80 км диссоциируют Н2 и СО2, выше 150 км – О2, выше 300 км – N2). На высоте 100 … 400 км в ионосфере происходит также ионизация газов. На высоте 320 км концентрация заряженных частиц (О2 + , О2 – , N2 + ) составляет
1/300 от концентрации нейтральных частиц. В верхних слоях атмосферы появляются свободные радикалы – ОН – , НО2 – и др.
До высоты 100 км атмосфера представляет собой хорошо перемешанную смесь газов. Вследствие уменьшения плотности газов температура меняется от 0°С в стратопаузе (на высоте
50 – 55 км) дo –90 . –100°С в мезопаузе (
80 – 85 км). Выше мезопаузы до высоты 500 км температура монотонно повышается до 1000 . 1500°С, выше термопаузы находится экзосфера, для нее характерна относительно постоянная высокая температура. Самые высокие слои состоят из Н2 и Не, которые медленно рассеиваются в мировое пространство.
Цель работы. Методом химического анализа определить содержание углекислого газа в атмосфере
Оборудование и материалы: колба коническая объемом на 50 мл, шприцы, лист белой бумаги, поглотительный раствор [к 500 мл дистиллированной воды добавляют 0,04 мл 25 %-ного раствора аммиака и 1–2 капли 1 %-ного раствора фенолфталеина (1 г фенолфталеина растворяют в 80 мл этанола и доводят до 100 мл водой)].
Порядок выполнения работы:
1. Определение содержания углекислого газа в атмосфере
На первом этапе необходимо провести исследование воздуха открытой атмосферы (вне помещений). Для этого набрать шприцем 10 мл поглотительного раствора; перемещая поршень, заполнить воздухом свободное пространство. Не отпуская поршня, энергично встряхивать шприц до поглощения углекислого газа из воздуха в объёме шприца поглотительным раствором. С помощью поршня удалить воздух из шприца, стараясь сохранить в нем исходное количество поглотительного раствора. Эту процедуру повторить несколько раз до полного обесцвечивания раствора. Объём воздуха, пошедший на обесцвечивание раствора, можно рассчитать, зная количество ходов поршня шприца при заборе воздуха и объём шприца, занимаемый воздухом. После проведенного исследования освободить шприц от использованного раствора и ополоснуть дистиллированной водой. Вновь, наполнив шприц 10 мл поглотительного раствора, повторить эксперимент с воздухом зоны, где требуется определить концентрацию углекислого газа.
Расчет содержания СО2 (в процентах) проводят по следующей формуле:

где V – объем воздуха открытой атмосферы, пошедший на обесцвечивание поглотительного раствора, м 3 ; V1 – объем воздуха исследуемой зоны, пошедший на обесцвечивание поглотительного раствора, м 3 ; 0,04 – содержание углекислого газа в воздухе, %.
2. Определение вентиляционного объема воздуха
Расчет необходимого вентиляционного объема воздуха (м 3 /ч), т.е. объема свежего воздуха, который надо подавать в помещение на одного человека, чтобы содержание СО2 не превысило допустимого уровня (0,1 %), произвести по следующему соотношению:

где К – количество литров СО2, выдыхаемое одним человеком за один астрономический час при спокойной сидячей работе (для взрослого, в среднем – 22,6 л/ч); р – предельно допустимое содержание СО2 в воздухе учебного помещения (0,1 %, или 1 л/м 3 ); Х – концентрация СО2 в исследуемой зоне (проценты или л/м 3 ).
Зная вентиляционный объем воздуха, рассчитать коэффициент вентиляции(W), который показывает, сколько раз в течение 1 часа воздух помещения должен смениться, чтобы содержание СО2 не превысило допустимого уровня:

Воздушный куб рассчитать по формуле

где Vв/к – воздушный куб, м 3 , приходящийся на одного человека (физиологическая норма на человека в час – 15–20 м 3 , гигиеническая норма – 4,5–5 м 3 на одного человека); V – объем исследуемой зоны (учебного помещения), м 3 ; п – количество человек, находящихся в зоне.
Требования к отчету
В отчете приводят название, цель и сущность работы, результаты расчетов содержания углекислого газа, объема вентиляционного воздуха, коэффициента вентиляции. Обосновывают полученные данные.
Лабораторная работа № 2
Определение концентрации аммиака в воздухе
В местах поступления в атмосферу загрязнителей антропогенного характера концентрация их может быть весьма значительной. В воздушной среде, преимущественно в нижних приземных слоях тропосферы, образуются очаги сильно загрязненного воздуха, оказывающие в локальных масштабах большое влияние на природную среду.
Основными источниками очаговых загрязнений атмосферы являются газопылевые выбросы предприятий химической, металлургической и машиностроительной промышленности, тепловых электростанций и транспортных машин. Эти загрязнения наиболее характерны для городов, промышленных районов и автомобильных магистралей.
При взаимодействии загрязнителей и кислорода воздуха под действием ультрафиолетового излучения образуется токсичный туман, называемый «фотохимическим смогом», особенно опасный для здоровья людей в период температурных инверсий.
Инверсия – явление увеличения температуры воздуха с высотой вместо обычного для тропосферы ее убывания на 0,6 о С на каждые 100 м. Чаще всего инверсии наблюдаются в самом нижнем слое воздуха по ночам. Они связаны с сильным охлаждением воздуха от земной поверхности. В этом случае более холодный слой воздуха оказывается «прижатым к земле». Инверсия затрудняет вертикальный воздухообмен. Если повышение температуры наблюдается непосредственно у земной поверхности, то такую инверсию называют приземной, а в случае повышения температуры на некоторой высоте от земной поверхности – приподнятой. Если явление инверсии происходит над источником выброса, то это, как правило, затрудняет подъем отходящих газов и способствует накоплению загрязняющих веществ в приземном слое атмосферы.
В определенных условиях (аварии, связанные с выбросом значительных количеств аммиака на предприятиях; усугубляющие ситуацию температурные инверсии; неисправности в системе вентиляции на рабочих местах) такое газообразное соединение, как аммиак (NH3), может являться загрязнителем атмосферы.
Аммиак – токсичный газ с удушливым запахом. Он вызывает острое раздражение слизистых оболочек, слезоточение, расстройство кровообращения, кроме того, этот газ взрывоопасен. Содержание аммиака в воздухе рабочей зоны не должно превышать 20 мг/м 3 .
Цель работы: освоить методику определения аммиака и выявить его присутствие в воздухе рабочей зоны.
Оборудование и материалы: Емкость объемом 50 мл, шприцы c иглой, лист белой бумаги, поглотительный раствор [к 50 мл дистиллированной воды добавляют 6 мл 0,01 н. раствора серной кислоты и 1–2 капли 0,06 %-ного раствора метилового оранжевого или метилового красного (60 мг индикатора растворяют в 50 мл дистиллированной воды при температуре 40–50 о С и доводят до 100 мл водой)].
Порядок выполнения работы
Набрать в шприц воздух и под давлением ввести через иглу в ёмкость с поглотительным раствором. Воздух пропускать до изменения окраски раствора. Определить объем воздуха, израсходованного на изменение окраски раствора, зная число потребовавшихся при этом ходов поршня и заполняемый воздухом объем шприца.
Расчет провести по формуле:

где 
Требования к отчету
В отчете приводят название, цель и сущность работы, результаты расчетов содержания аммиака в воздухе. Обосновывают полученные данные.
Вопросы для самоподготовки
1. Строение атмосферы.
2. Состав различных слоев атмосферы.
3. Понятие о фотохимических реакциях.
4. Озон. Озоновый слой планеты.
5. Фотохимический смог. Условия возникновения, основные химические соединения смога.
6. Фреоны в атмосфере. Пути поступления фреонов в атмосферу.
7. Кислотные осадки, их состав. Причины возникновения кислотных дождей.
8. Парниковый эффект. Предполагаемые последствия потепления климата на планете.
9. Температурная инверсия. Условия возникновения.
10. Основные загрязняющие вещества атмосферы.
Лабораторная работа №3
И жесткости воды
Сухой остаток характеризует общее содержание растворенных в воде минеральных и частично органических веществ, температура кипения которых превышает 110 0 С, нелетучих с водяным паром и не разлагающихся при указанной температуре.
Сухой остаток в водоемах – источниках водоснабжения не должен превышать 1000 мг/л, лишь в отдельных случаях по согласованию с органами санитарно-эпидемиологической службы допускается его содержание до 1500 мг/л.
По общей минерализации различают следующие типы вод: ультрапресные – 2+ , Мg 2+ и тяжелых металлов обусловливают жесткость воды. Поскольку в природных водах значительно преобладают ионы Са 2+ и Мg 2+ , то общую жесткость природных вод характеризуют суммой концентраций этих катионов в воде, выраженной в мг-экв/л. Ионы Са 2+ и Мg 2+ связаны в воде с анионами НСО3 – , SO4 2– , Cl – , CO3 2– и др. Жесткость воды, обусловленную наличием гидрокарбонатов и карбонатов магния и кальция, называют карбонатной жесткостью.
Общая жесткость природных вод зависит от типа контактирующих с ними пород и почв, климатических условий, а также сезона года. Наиболее мягкими являются воды атмосферных осадков (0,07. 0,1 мг-экв/л). Очень малую жесткость имеют воды Карелии, так как они омывают трудно растворимые гранитные породы. Грунтовые воды Донбасса или Белгородской области, например, имеют высокую жесткость (18. 20 мг-экв/л), поскольку формируются под воздействием меловых и доломитовых пород.
Величина общей жесткости в источниках централизованного водоснабжения допускается до 7 мг-экв/л, в отдельных случаях по согласованию с органами санитарно-эпидемиологической службы – до 10 мг-экв/л.
По величине общей жесткости воды делятся на следующие группы, мг-экв/л: очень мягкие – 1,5; мягкие – 1,5 . 3,0; средней жесткости –3,0 . 5,4; жесткие – 5,4 . 10,7; очень жесткие – >10,7.
Для большинства живых организмов более благоприятны воды умеренной жесткости, так как с водой в организм поступает необходимое количество кальция. В этом отношении мягкие воды менее желательны.
Цель работы: ознакомиться с содержанием основных групп соединений в природных водах и методами их определения.
Оборудование: муфельная печь, сушильный шкаф, водяная баня, аналитические весы, фарфоровые или кварцевые чашки на 50 мл, бюретки.
Реактивы: 0,05 н. раствор трилона Б; 0,1 н. раствор серной кислоты; аммиачная буферная смесь (рН = 10); раствор индикатора темно-синего хрома; раствор индикатора метилового оранжевого.
Порядок выполнения работы
1. Определение сухого остатка
Метод основан на гравиметрическом определении растворенных веществ. В прокаленную, охлажденную и взвешенную фарфоровую или кварцевую чашку поместить 10 . 50 мл профильтрованной анализируемой пробы воды. Воду выпарить на водяной бане. Затем перенести чашку с остатком в сушильный шкаф и высушить до постоянной массы при 103. 105°С. Содержание сухого остатка (мг/л) x рассчитать по формуле
где а – масса чашки с сухим остатком, мг; b – масса пустой чашки, мг; V – объем анализируемой пробы воды, мл.
2. Определение прокаленного остатка
Чашку с сухим остатком поместить в предварительно разогретую до 600°С муфельную печь и прокаливать в течение 15 . 20 мин. Затем дать чашке немного остыть на воздухе; для дальнейшего охлаждения поместить в эксикатор. После полного охлаждения(до комнатной температуры) чашку с осадком взвесить. Прокаливание повторять до достижения постоянной массы. Произвести расчет по аналогии с расчетом сухого остатка.
3. Определение общей жесткости воды
Метод основан на образовании прочного комплексного соединения при рН = 10 ионов кальция и магния с этилендиаминтетраацетатом натрия (трилон Б, Na2ЭДТА). Минимально определяемая концентрация – 0,05 мг-экв/л (при титровании 100 мл пробы). В коническую колбу для титрования поместить 100 мл анализируемой пробы, добавить 3–5 мл аммиачного буферного раствора и 7 . 8 капель индикатора – темно-синего хрома, который окрашивает воду в розово-красный цвет. Затем из бюретки прибавить по каплям раствор трилона Б, все время интенсивно перемешивая содержимое колбы вращательными движениями, до изменения окраски в эквивалентной точке (переход цвета раствора из розово-красного в сине-сиреневый.)
Особенно интенсивно следует помешивать воду к концу определения, так как переход окраски наступает не мгновенно, а постепенно. Последние капли раствора нужно добавлять медленно, с некоторыми промежутками, не прекращая помешивания воды в колбе.
Общая жесткость испытуемой пробы, мг-экв/л, численно равна объему в мл израсходованного 0,1 н. раствора трилона Б, пошедшего на титрование 100 мл воды.
4. Определение карбонатной жесткости воды
В колбу для титрования налить 100 мл испытуемой воды и добавить из капельницы две капли раствора индикатора метилоранж, от чего вода окрашивается в соломенно-желтый цвет.
Затем осторожно, по каплям, добавить в воду 0,1 н. раствор серной кислоты, одновременно перемешивая содержимое колбы вращательными движениями. Прибавление кислоты прекратить с последней каплей, от которой соломенно-желтый цвет воды переходит в оранжевый. Карбонатная жесткость пресной воды в мг-экв/л численно равна объему в мл, израсходованной 0,1 н. кислоты, пошедшей на титрование 100 мл воды.
Пример. Взято 100 мл воды для определения в ней карбонатной жесткости, израсходовано 1,7 мл серной кислоты. Карбонатная жесткость воды равна 1,7 мг-экв/л.
5. Определение некарбонатной жесткости воды
Величину некарбонатной жесткости определяют как разность между значениями общей и карбонатной жесткости.
Требования к отчету
В отчете приводят название, цель и сущность работы, результаты расчета сухого и прокаленного остатка, определенные и расчитанные величины различных видов жесткости. По результатам анализа делают вывод о том, к какой группе относится исследуемая вода по характеру минерализации и общей жесткости и предположение о характере подстилающих пород и поступающих в водоем стоков.
Лабораторная работа № 4
Порядок выполнения работы
1. Определение хлоридов
Метод основан на титрометрическом осаждении хлоридов в нейтральной или слабощелочной среде нитратом серебра в присутствии хромата калия в качестве индикатора. В пробу воды объемом 100 мл добавить
10 капель раствора хромовокислого калия, хорошо перемешать и оттитровать раствором азотнокислого серебра. Раствор титранта добавлять до тех пор, пока в воде не появится устойчивый бурый оттенок.
Содержание ионов хлора в пробе воды составит x,мг/л

где V1 – объем раствора нитрата серебра, пошедшего на титрование, мл; N– нормальность раствора нитрата серебра; Э – миллиграмм-эквивалент хлора; V2 – объем исследуемой воды, мл.
2. Определение фосфатов
Сущность заключается в том, что сульфомолибдатный раствор, введенный в испытуемую пробу воды в присутствии погруженной в нее оловянной палочки (восстановитель), реагирует с фосфатом, в результате чего вода окрашивается в синий цвет, интенсивность которого тем больше, чем выше концентрация фосфатов в воде.
В мерную пробирку налить 2 мл отфильтрованной пробы воды, довести объем жидкости сульфомолибдатным раствором до 10 мл. Затем в раствор опустить очищенную наждачной бумагой и ополоснутую дистиллированной водой оловянную палочку. Через 5 мин (за это время раствор в пробирке вместе с оловянной палочкой должен быть 2 . 3 раза перемешен легким встряхиванием) оловянную палочку вместе с пробкой вынуть из пробирки и сравнить окраску испытуемого раствора с окраской стандартной цветной шкалы. Для этого пенал, в котором находится штативчик с фосфатной шкалой, снять с задней стенки лабораторного ящика, вынуть штативчик и вставить в него (через верхнее отверстие) мерную пробирку так, чтобы она оказалась в специальном гнезде на фоне молочного стекла рядом с ячейками цветной шкалы.
Позади штативчика должен находиться источник света, расположенный так, чтобы окраска исследуемого раствора сравнивалась с окраской стандартной шкалы в рассеянном проходящем свете.
Фосфатное число воды соответствует цифре, стоящей против ячейки шкалы, окраска которой совпадает с окраской раствора в пробирке или наиболее близка к ней.
Фосфатная шкала отградуирована в соответствии с содержанием фосфат-ионов (РО4 3– , мг/л) в воде. Хранить шкалу следует в футляре (она должна быть на свету только во время колориметрирования).
Требования к отчету
В отчете приводят описание хода выполнения работы, результаты расчета содержания анионов, предположение о характере подстилающих пород водоёма и поступающих в него стоков.
Лабораторная работа № 5
Порядок выполнения работы
В пробу воды (в количестве 5 мл) ввести 2,5 мл 0,25 н. раствора бихромата калия и при перемешивании концентрированную серную кислоту в количестве 15 мл. При этом температура раствора поднимается выше 100°С. Через 2 мин к остывшей до комнатной температуры смеси прилить 100 мл дистиллированной воды и оттитровать избыток бихромата. Для этого ввести 10–15 капель раствора N – фенилантраниловой кислоты и с помощью бюретки добавлять в смесь раствор соли Мора, взаимодействующий с непрореагировавшим количеством бихромата калия.
Провести холостой опыт. Для этого с использованием 5 мл дистиллированной воды проводят те же операции, что и с анализируемой пробой природной воды.
Величину ХПК, мг О/л определяют по формуле

где a – объем раствора соли Мора, пошедшего на титрование холостой пробы, мл; b – объем раствора соли Мора, пошедшего на титрование анализируемой пробы, мл; N – нормальность соли Мора; V – объем анализируемой пробы, мл; 8 – эквивалент кислорода.
Требования к отчету
В отчете приводят название и цель работы, результаты расчета химического потребления кислорода бихроматным методом; делают вывод о содержании органических загрязняющих веществ в анализируемой воде.
Лабораторная работа № 6
Требования к отчету
В отчете приводят данные по определению кислорода в пробе воды водоема, дают ориентировочную оценку степени загрязненности водоема, делают вывод о пригодности данной воды к обитанию гидробионтов.
Лабораторная работа № 7
Требования к отчету
В отчете приводят данные по изменению содержания загрязняющих веществ в воде в процессе очистки. Делают вывод об эффективности использования указанных методов для очистки вод, содержащих взвешенные загрязнители и красители.
Лабораторная работа № 8
Требования к отчету
Результаты работы представляют в виде табл.3.
Порядок выполнения работы
8…10 г почвы, отделенной от растительных остатков и просеянной через сито 0,25 мм, поместить в коническую колбу на 100 мл. Из бюретки прилить точно 10 мл хромовой смеси (K2Cr2O7 в кислоте). Осторожно круговыми движениями взболтать содержимое.
Накрыв колбу воронкой, кипятить содержимое колбы ровно 5 мин. Отсчет времени начинают с момента появления пузырьков газа. Кипение должно быть медленным.
При нагревании идет реакция
По окончании кипения колбу снять с плитки, охладить до комнатной температуры. Перенести содержимое в колбу на 500 мл, смыть дистиллятом остатки с воронки и маленькой колбы и тоже перенести вместе с дистиллятом в колбу. Довести содержимое большой колбы до 250 мл. Добавить 2 мл 85 %-ного раствора фосфорной кислоты и восемь капель дифениламина в качестве индикатора (вместо дифениламина можно использовать 5 … 8 капель 2 %-ного раствора фенилантраниловой кислоты).
Содержимое колбы оттитровать 0,2 н. раствором соли Мора до перехода темно-бурой окраски через фиолетовую и синюю в грязно-зеленую. При появлении синего цвета титровать нужно осторожно.
Параллельно необходимо провести холостое титрование. Для этого взять 0,2 г прокаленного песка, поместить в коническую колбу на 100 мл, прилить 10 мл 0,4 н. раствора хромовой смеси, закрыть воронкой, прокипятить 5 мин, охладить и, добавив фосфорную кислоту и индикатор (как указано выше), оттитровать.
Вычислить процентое содержание гумуса в почвенном образце по формуле

где a – объем раствора соли Мора, затраченный на холостое титрование 10 мл хромовой смеси, мл; b – объем раствора соли Мора, затраченный на титрование содержимого колбы после окисления гумуса бихроматом калия, мл; N – концентрация соли Мора; 100 – коэффициент пересчета на 100 гпочвы; 0,0010362 – коэффициент пересчета на гумус (показывает, что 1 мл 0,2 н. раствора соли Мора соответствует такому количеству хромовой кислоты, которое окисляет 0,0010362 г гумуса, или 0,0006 г углерода).
Требования к отчету
В отчёте следует представить описание хода выполнения работы, результаты титрования, расчеты содержания гумусовых веществ в почве.
Лабораторная работа № 10
Требования к отчету
В отчете приводят данные, полученные при наблюдении распределения составляющих почву частиц в виде рисунка и расчета процентного содержания наблюдаемых фракций почвы.
Лабораторная работа № 11
Порядок выполнения работы
Комнатное растение поместить на сутки в темноту. За это время в растении почти полностью исчезает крахмал, который расходуется на дыхание, переходя под действием ферментов в сахар и оттекая из листа. Через сутки вынести растение на свет, срезать с него лист. На лист прикрепить полоску темной бумаги, согнутую пополам так, чтобы она закрывала часть листа с двух сторон. Лист поместить в стакан с водой. Накрыть лист стеклянным колпаком и в течение 2…3 ч освещать светом настольной лампы, ориентируя ее так, чтобы лучи падали на лист перпендикулярно его поверхности.
Одновременно выполнить анализ другого листа с того же растения. Лист поместить в чашку с 90 %-ным этанолом и кипятить в течение 5…10 мин, затем перенести лист в чашку с водой и выдерживать на водяной бане до полного обесцвечивания. Вынуть лист, расправить в чашке Петри и нанести на него раствор йода в йодиде калия. Отметить отсутствие или слабую реакцию на крахмал.
Выдержанный нa свету лист после снятия бумаги подвергнуть той же процедуре и, нанеся на него раствор йода, отметить положительную реакцию на крахмал в местах, освещаемых лампой, и отсутствие реакции на крахмал в той части листа, которая была прикрыта бумажкой.
Требования к отчету
В отчете приводят название и краткое описание работы, основные реакции фотосинтеза органических соединений в исследуемых тканях, объясняют наблюдаемые в работе явления.
Лабораторная работа № 12
Изучение процесса фотосинтеза.
Порядок выполнения работы
Самый простой способ показать, что при фотосинтезе выделяется кислород, – взять водное растение, поставить его на яркий свет и собрать выделяемый кислород, как показано на рис. 2.
Известно, что кислород поддерживает процесс горения. Для доказательства выделения кислорода к пробирке подносят тлеющую лучину, которая должна вспыхнуть ярким пламенем.
Рис. 2. Установка для изучения выделения кислорода при фотосинтезе
Требования к отчету
В отчете приводят результаты наблюдений горения лучины при выделении кислорода водорослью в процессе фотосинтеза.
Вопросы для самоподготовки
1. Что понимают под фотосинтетической деятельностью растений? Приведите основную реакцию фотосинтеза.
2. Продуктивность экологической системы. Виды продуктивности.
3. Первичные продукты фотосинтеза, их дальнейшие превращения.
4. Фотосинтез и миграции кислорода и углерода.
5. Основные лимитирующие факторы деятельности фотопродуцентов.
6. Токсичные вещества как лимитирующий фактор.
7. Роль фотосинтеза в жизнедеятельности биосферы.
Лабораторная работа № 13
В растительных объектах
Азот широко распространен во всех геосферах и в составе различных соединений мигрирует в биосфере. В газообразной форме молекулярный азот (N2) довольно инертен, его содержание в атмосфере составляет 78%. Азот используется биотой после усвоения азотфиксирующими бактериями почв и клубеньковыми бактериями, обитающими на корнях бобовых культур, а также сине-зелеными водорослями гидросферы. При этом азот превращается в аммиак по схеме:

Образованный аммиак в виде аммонийного иона (NH4 + ) встраивается в органические молекулы аминокислот, белка и других соединений. После гибели организмов азотсодержащие органические соединения подвергаются разложению. При этом в воду и почвенные растворы переходит азот в виде иона аммония NH4 + .Далее аммиак с помощью микроорганизмов окисляется в начале до нитрит (NO2 – )-, а затем до нитрат (NO3 – )-ионов. Такой процесс носит название процесса нитрификации:
В форме нитратов азот ассимилируется из почвы корнями растений и идет на образование аминокислот и белков.
В бескислородных (анаэробных) условиях процесс можно представить в виде следующей схемы:
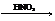 |
Денитрифицирующие бактерии осуществляют процесс, обратный нитрификации, – денитрификацию. Денитрификация происходит только в анаэробных условиях, когда бактерии используют нитрат как окислитель, заменяющий кислород в реакциях окисления органических веществ. Сам нитрат при этом восстанавливается до молекулярного азота. Если израсходованы нитрат-ионы, то для окислительных процессов используется кислород сульфат-ионов:
Образовавшийся аммиак возвращается в цикл. Свободный азот N2 или азот в виде N2O, полученный в результате деятельности микроорганизмов, возвращается в окружающую среду, что поддерживает в природе существующий баланс между включаемым в биосферу и высвобождающимся в атмосферу азотом.
В последнее время применение удобрений, увеличение объемов производств, сопровождающихся образованием азотсодержащих отходов, и другие причины привели к тому, что в почвах, воде, и как следствие – в живых организмах накапливается избыточное количество нитратов. Легкорастворимые нитраты при выпадении большого количества осадков вымываются в глубокие горизонты и могут проникать в грунтовые воды. Накопленные в почве нитраты интенсивно всасываются растениями, что приводит к избыточному содержанию нитратов и в растительных тканях.
Избыток содержания нитратов в воде и пищевых продуктах вредит здоровью людей, так как появление в организме нитрита, восстановленного из нитрата, служит причиной образования метгемоглобина, в котором кислород прочно связан с гемоглобином, что снижает способность эритроцитов переносить кислород. Повышенное содержание нитратов в водных объектах вызывает бурный рост фитопланктона, приводящий к эвтрофикации водоемов.
Цель работы: углубить представления о миграции азота в биосфере, определить содержание нитратного азота в растениях.
Приборы и реактивы: нитратомер ЭКО-01, электроды хлорсеребряный и нитратселективный, гомогенизатор, 0,1 М раствор КNO3, 1%-ный раствор алюмокалиевых квасцов.
Порядок выполнения работы
Перед проведением замеров необходимо подготовить к работе электроды и откалибровать нитратомер.
Пробу растительного материала в количестве 0,25…0,5 кг следует сначала отмыть и просушить фильтровальной бумагой, а затем измельчить ножом на кусочки до 1 см. 10 г пробы взвесить с точностью до первого десятичного знака и поместить в стакан гомогенизатора. Прилить в стакан 50 мл 1 %-ного раствора алюмокалиевых квасцов и гомогенизировать смесь в течение 1–2 мин.
Погрузить в гомогенизированную массу электроды и определить значение ЭДС по шкале прибора. Пользуясь табл. 4, определить содержание нитратов в исследуемых растительных тканях, мг/кг.
Полученные значения сравнить с санитарно-гигиеническими нормами содержания нитратов в растительных продуктах (табл. 5) и сделать вывод о содержании нитратов в растениях и почвах в месте произрастания растений.
Требования к отчету
В отчете нужно представить описание хода работы; данные о калибровке нитратомера и результаты анализа растительных объектов; вывод о соответствии содержания нитратов в растительной ткани допустимым уровням.
Вопросы для самоподготовки
1. Биогенные элементы.
2. Круговорот углерода и кислорода в биосфере.
3. Способы фиксации атмосферного азота.
4. Круговорот азота в природе.
5. Процессы нитрификации и денитрификации в рамках круговорота азота.
6. Аэробные и анаэробные условия функционирования микроорганизмов.
7. В чем опасность увеличения содержания нитратов в растительных пищевых объектах? в поверхностных водоемах?
Лабораторная работа № 14
Требования к отчету
В отчете следует привести цель работы, кратко описать ход работы, охарактеризовать измеряемые объекты, привести расчеты мощности экспозиционной дозы в измеряемых точках, сделать заключение об уровне радиоактивности исследуемых объектов.
Вопросы для самоподготовки
1. Понятие об ионизирующем излучении. Природные и антропогенные источники излучения.
2. Виды ионизирующего излучения, их характеристика.
3. Радиоактивность. Стабильные и радиоактивные изотопы. Распространенность в природе.
4. Основные типы ядерных реакций.
5. Единицы измерения радиоактивности.
6. Мощность экспозиционной дозы излучения, единицыизмерения.
7. Особенности воздействия ионизирующего излучения на биологические объекты.
8. Малые дозы облучения, применяемые в медицине, их влияние на человека.
1. Лозановская И.Н. Экология и охрана биосферы при химическом загрязнении / Лозановская И.Н., Орлов Д.С., Садовникова Л.К.– М.: Высшая школа, 1998.– 278 с.
2. Химия и общество: Пер. с англ./ Под ред. Гольдфреда М.Г.– М.: Мир, 1995.– 560 с.
3. Фелленберг Г. Загрязнение природной среды. Введение в экологическую химию: Пер. с нем.– М.: Мир, 1997.– 232с.
4. Ливчак И.Ф. Охрана окружающей среды / Ливчак И.Ф., Воронов Ю.В. Учеб. пособие.– М.: Стройиздат, 1988.– 191 с.
5. Брылов С.А. Охрана окружающей среды / Под ред. Брылова С.А. и Шродки К.– М.: Высшая школа, 1985.– 272 с.
6. Небел Б. Наука об окружающей среде – М: Мир, 1993.– 123 с.
7. Потапов А.Д. Экология.- М.: Высшая школа, 2000.- 446 с.
8. Акимова Т.А. Экология / АкимоваТ.А., Хаскин В.В.– М.: ЮНИТИ, 1999.– 455 с.
9. Промышленно-транспортная экология / Под ред. В.Н. Луканина.– М.: Высшая школа, 2001.– 273 с.
| Введение …………………………………………………………………. Лабораторная работа № 1 Определение содержания углекислого газа в атмосферном воздухе ………………………………………………… Лабораторная работа № 2 Определение концентрации аммиака в воздухе ……………………………………………………………………….. Лабораторная работа №3 Определение сухого и прокаленного остатков и жесткости воды …………………………………………………… Лабораторная работа № 4 Оп |
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Источник














