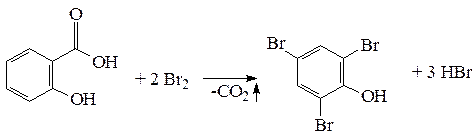- Количественное определение. 1. Бензойную и салициловую кислоты определяют алкалиметрическим методом, вариант нейтрализации в спиртовой среде
- Тема: Броматометрическое титрование
- «УЧЕБНОЕ ПОСОБИЕ: МЕТОДЫ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ (БРОМАТОМЕТРИЯ, ЙОДХЛОРМЕТРИЯ) В АНАЛИЗЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ОРЕНБУРГ, 2015 УДК 543:615.2 ББК . »
- УЧЕБНОЕ ПОСОБИЕ:
- МЕТОДЫ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
- (БРОМАТОМЕТРИЯ, ЙОДХЛОРМЕТРИЯ)
- В АНАЛИЗЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
- СПИСОК ЛИТЕРАТУРЫ
Количественное определение. 1. Бензойную и салициловую кислоты определяют алкалиметрическим методом, вариант нейтрализации в спиртовой среде
1. Бензойную и салициловую кислоты определяют алкалиметрическим методом, вариант нейтрализации в спиртовой среде. Индикатор – фенолфталеин. fэкв=1.
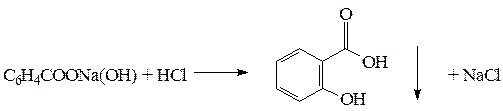
2. Бензоат натрия и салицилат натрия определяют методом ацидиметрии, вариант вытеснения более сильной минеральной кислотой. Титрование проводят в присутствии эфира, который извлекает бензойную и салициловую кислоты, тем самым предотвращая обратный ход реакции.
C6H5COONa +HCl 
Используют смешанный индикатор – смесь равных количеств метилового оранжевого и метиленового синего (1:1). Титруют до сиреневого окрашивания водного слоя.
3. Броматометрия. Салициловую кислоту и ее соли, как производные фенола, определяют методом броматометрии (вариант обратного титрования).
Избыток Br2 + 2 KI → I2 + 2 KBr
4. Йодхлорметрический метод (обратное титрование). При взаимодействии фенолов с йодмонохлоридом образуются йодпроизводные фенолов. Избыток йодмонохлорида определяют йодометрическим методом: прибавляют калия йодид и выделившийся йод титруют раствором натрия тиосульфата (индикатор — крахмал). Йодмонохлорид, в отличие от брома, не вытесняет карбоксильную группу, находящуюся в о- и n-положениях по отношению к фенольному гидроксилу.
Источник
Тема: Броматометрическое титрование
Цель изучения данной темы:
Уметь использовать броматометрический метод обратного титрования (бромид – броматный метод) для определения фенолов и их производных и прямой броматометрический метод для определения восстановителей, решать расчетные задачи, связанные с методом броматометрии.
Броматометрия – один из важнейших методов количественного анализа лекарственных веществ. Прямая броматометрия чаще всего используется для анализа препаратов As(III), например, осарзола, As2O3, а также соединений Sb(III).
Обратное (бромид – броматное титрование) используется при анализе лекарственных веществ – производных фенола: резорцина, п – аминосалициловой кислоты, салициловой кислоты и др. Кроме того, обратное броматометрическое титрование применяют для анализа непредельных соединений (бромирование по двойной связи), какими являются некоторые алкалоиды алифатического ряда.
Исходный уровень знаний:
Для усвоения материала данной темы необходимо знать:
Химическое равновесие в окислительно-восстановительных системах. Условия применимости окислительно-восстановительных реакций для количественного анализа.
Химические свойства KBrO3 и Br2 (неорганическая химия). Расчет молярной массы эквивалента.
Реакции замещения водорода на бром в бензольном кольце на примере фенола, резорцина, салициловой кислоты (органическая химия).
Индикация окончания титрования в редокс – методах. Необратимые индикаторы.
Харитонов Ю.Я. Аналитическая химия. Аналитика Т.2. М.: Высшая школа. 2005 – с. 186 – 193.
Пономарев В.Д. Аналитическая химия. М.: Высшая школа, 1982, ч.1, с. 85 – 104; ч.2, с. 127 – 128.
Пономарев В.Д., Иванова Л.И., Самокиш И.И. и др. Практикум по аналитической химии М.: Высшая школа, 1983, с. 193 – 195.
Беликов В.Г. Фармацевтическая химия. М.: Высшая школа, 1985, с.133 – 134.
Конспект лекций по неорганической, органической и аналитической химии.
Сборник расчетных задач по количественному анализу с примерами решений, Ярославль, ЯГМА, 1999 г.
Метод прямой броматометрии основан на использовании окислительных свойств KBrO3 в кислой среде (HCI):
BrO3 – + 6 H + + 6 ē Br – + 3 H2O; 
В качестве титранта применяют 0,05 н. или 0,1 н растворы KBrO3, которые готовят по точной навеске. Молярная масса эквивалента бромата равна 1/6 молярной массы KBrO3. Растворы KBrO3 не требуют стандартизации, устойчивы при хранении. Титруют восстановители (например, As2O3) в среде HCl при добавлении небольших количеств KBr:
По окончании титрования в растворе появляется избыток KBrO3, который реагирует с бромид-ионами, имеющимися в растворе:
BrO3 – + 5 Br – + 6 Н + 3 Br2 + 3 H2O
Выделяющийся бром действует на индикаторы – метиловый оранжевый или метиловый красный, изменяя окраску из оранжевой в бесцветную и из красной в бледно-желтую, соответственно. Действие индикаторов необратимо, поэтому титрование проводится медленно. Обязательно проведение холостого опыта.
Метод обратной броматометрии (бромид-броматный метод, бромометрия) основан на использовании реакции бромирования фенола (или его производных) до 2,4,6-трибромфенола свободным бромом, выделяющимся при взаимодействии бромата с бромидом в кислой среде. При этом протекают следующие реакции:
BrO3 – + 5 Br – + 6 Н + 3 Br2 + 3 H2O
По окончании реакции бромирования фенола (
10 мин) не вступивший в реакцию бром определяется иодометрически путем прибавления иодида калия и оттитровывания выделившегося йода тиосульфатом натрия:
В качестве индикатора используют крахмал (добавляют в конце титрования) или проводят безиндикаторное титрование в присутствии хлороформа (титруют до обесвечивания хлороформных шариков).
Лабораторная работа №12 (УИРС). Определение содержания салициловой кислоты (резорцина) в препарате.
Аналитические демпферные весы с разновесами.
Аптечные весы с разновесами.
Мерные колбы 100 мл, 200 мл, 250 мл.
Мерные пипетки 10 мл.
Конические колбы для титрования.
Химические воронки Ø 40-50 мм.
Промывалки и капельницы с водой очищенной.
Реактивы: KBrO3 (кристалл.), KI (кристалл.), KBr (кристалл.), 0,05 н. титрованный раствор Na2S2O3, хлороформ в капельницах, раствор HCl (1:2).
(кристаллические KBr и KI могут быть заменены на соответствующие растворы по указанию преподавателя).
Основные этапы работы
Приготовление 0,05 н. стандартного раствора KBrO3.
Подготовка пробы к титрованию.
Обработка результатов титрования.
Раствор KBrO3 готовят в мерной колбе вместимостью 100 мл. Предварительно рассчитывают точную навеску соли, необходимую для приготовления 100 мл 0,05 н. KBrO3:
Расчетное (или близкое к нему) количество KBrO3 взвешивают на аптечных весах, затем уточняют на аналитических весах и аккуратно переносят в мерную колбу. Колбу заполняют водой очищенной на 50 % объема, тщательно перемешивают. Объем раствора доводят до метки водой и вновь перемешивают. Вычисляют нормальную концентрацию и титр приготовленного раствора.
Точную навеску препарата (0,1 г), взятую на аналитических весах, количественно переносят в мерную колбу вместимостью 200 мл и добавляют около 30 мл воды очищенной. При определении салициловой кислоты в колбу вносят по каплям 2 н. NaOH до полного растворения осадка. Раствор тщательно перемешивают, доводят до метки водой и вновь перемешивают.
В 3 конические колбы для титрования отбирают мерной пипеткой по 10 мл приготовленного раствора, затем туда же последовательно добавляют:
а) другой мерной пипеткой 10 мл 0,05 н. KBrO3;
б) 0,3 г кристаллического KBr (навеска берется на аптечных весах);
Полученную смесь тщательно перемешивают и оставляют на 10 мин в вытяжном шкафу.
Бромирование салициловой кислоты и резорцина протекает по схеме:
В выстоявшийся раствор добавляют 0,5 г KI (на аптечных весах).
Выдерживают 10 мин.
Мерной пробиркой добавляют 1-2 мл хлороформа и энергично перемешивают.
Титруют при интенсивном перемешивании 0,05 н. раствором Na2S2O3 до обесцвечивания хлороформных шариков. Проводят 3 титрования, рассчитывают средний объем.
Массовую долю салициловой кислоты (резорцина) рассчитывают по формуле:
Раствор должен быть прозрачным, не содержать посторонних включений, бесцветным.
Расчетная концентрация не должна отличаться от заданной более чем на 0,0050.
Если в приготовлен
ном растворе остались кристаллы вещества, раствор необходимо переделать.
Раствор в колбах должен пожелтеть вследствие выделения брома. При определении салициловой кислоты выпадает белый осадок бромпроизвод-ного.
Раствор буреет вследствие выделения йода.
Хлороформ окрашивается в фиолетовый цвет. Осадок бромпроизводного салициловой кислоты должен раствориться.
Результаты параллельных титрований не должны различаться между собой более чем на 0,05 мл.
где М(1/6 сал.к-ты) – молярная масса эквивалента салициловой кислоты (резорцина) — 23 г/моль (18 г/моль);
Vk – объем мерной колбы, мл;
V(сал.) – объем раствора препарата (салициловой кислоты или резорцина), взятый на титрование, мл;
g – навеска препарата, г.
В соответствии с вышеприведенной схемой, оформляют отчет по работе. Полученные результаты сдают преподавателю.
Вопросы для контроля усвоения темы:
Напишите уравнения реакций, лежащих в основе прямого броматометрического определения сурьмы (III), As2O3.
Напишите уравнения реакций, лежащих в основе определения п – аминосалициловой кислоты методом броматометрии.
Напишите формулу, по которой можно рассчитать массовую долю резорцина в препарате и объясните ее.
Как рассчитать молярную массу эквивалента органического соединения при определении его бромид – броматным методом?
Почему молярная масса эквивалента KBrO3 при проведении обратного броматометрического титрования определяется как М(1/6KBrO3)?
Какой индикатор используется при определении резорцина (салициловой кислоты)?
Какие стандартные растворы применяются в прямой броматометрии и в бромид – броматном методе? Как они готовятся?
Для чего при добавлении бромид — броматной смеси колбы с растворами выдерживают 10 мин?
Можно ли готовить бромид – броматную смесь заранее?
Почему нельзя использовать прямое титрование растворами Br2?
Где применяется метод броматометрии?
Перечень практических навыков:
Брать навеску вещества на аптечных весах и на аналитических весах.
Растворять навеску в мерной колбе.
Отмеривать раствор пипеткой.
Отмеривать раствор бюреткой в процессе титрования.
Проводить бромометрическое определение.
Задания по теме «Броматометрия», выносимые для проверки практичсеких навыков.
Определить массовую долю салициловой кислоты (резорцина) в 1% растворе методом бромид – броматного титрования.
определение провести способом аликвотных проб и отдельных навесок.
Определить массовую долю салициловой кислоты (резорцина) в препарате методом бромид – броматного титрования. Определение провести способом отдельных навесок и аликвотных проб.
Тут вы можете оставить комментарий к выбранному абзацу или сообщить об ошибке.
Источник
«УЧЕБНОЕ ПОСОБИЕ: МЕТОДЫ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ (БРОМАТОМЕТРИЯ, ЙОДХЛОРМЕТРИЯ) В АНАЛИЗЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ ОРЕНБУРГ, 2015 УДК 543:615.2 ББК . »
Государственное бюджетное образовательное учреждение
высшего профессионального образования
«Оренбургский государственный медицинский университет»
Министерства здравоохранения Российской Федерации
ГБОУ ВПО ОрГМУ Минздрава России
Кафедра химии и фармацевтической химии
УЧЕБНОЕ ПОСОБИЕ:
МЕТОДЫ ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ
(БРОМАТОМЕТРИЯ, ЙОДХЛОРМЕТРИЯ)
В АНАЛИЗЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
ОРЕНБУРГ, 2015 УДК 543:615.2 ББК 35.66 М 69 Авторы: И.В. Михайлова, Н.А. Кузьмичева, Д.С. Карманова.
Под общей редакцией заведующего кафедрой химии и фармацевтической химии, профессора, д.м.н., С.И. Красикова Учебное пособие: методы окислительно-восстановительного титрования (броматометрия, йодхлорметрия) в анализе лекарственных средств – Оренбург, 2015.– 40 с.
Настоящее пособие включает теоретическую часть, в которой дается определение методов броматометрического и йодхлорметрического титрования, а также титранты, индикаторы методов. Приведены условия проведения титрования, описаны достоинства и недостатки методов. Приведены методики количественного определения лекарственных средств методами броматометрического и йодхлорметрического титрования. Задачи для самостоятельного решения позволяют освоить способы расчетов, используемых провизороманалитиком в практической деятельности.
Данное учебное пособие составлено в соответствии с государственным образовательным стандартом высшего профессионального образования по специальности 060301.65 – «Фармация» (квалификация – провизор), учебным планом и программой курса.
Предназначено для студентов 3, 4 и 5 курсов фармацевтического факультета (очного, очнозаочного и заочного отделений).
Рецензенты:
1.Зав.кафедрой биохимии и молекулярной биологии ФГБОУ ВПО «Оренбургский государственный университет», д.м.н. Барышева Е.С.
2. Доцент кафедры управления и экономики фармации, фармакогнозии, фармацевтической технологии ГБОУ ВПО «ОрГМУ Министерства здравоохранения России», к.ф.н. А.А.Шмыгарева.
Учебное пособие рассмотрено и рекомендовано к печати РИС ОрГМУ.
© Кафедра химии и фармацевтической химии, 2015
Содержание:
Введение 4 Теоретические основы метода броматометрии 5 Варианты броматометрии 12 Теоретические основы метода
Данное учебное пособие включает теоретическую часть, в которой дается определение методов броматометрического и йодхлорметрического титрования, а также титранты, индикаторы методов. Приведены условия проведения титрования, описаны достоинства и недостатки методов.
Приведены методики количественного определения лекарственных средств методами броматометрического и йодхлорметрического титрования. Задачи для самостоятельного решения позволяют освоить способы расчетов, используемых провизором-аналитиком в практической деятельности.
Компетенции обучающегося, формируемые в результате освоения дисциплины:
1. ПК–34 способностью и готовностью готовить реактивы для анализа лекарственных средств в соответствии с требованиями Государственной фармакопеи;
2. ПК–35 способностью и готовностью проводить анализ лекарственных средств с помощью химических, биологических и физико-химических методов в соответствии с требованиями Государственной фармакопеи;
3. ПК–37 способностью и готовностью проводить определение физикохимических характеристик отдельных химических форм, в том числе таблеток, мазей, растворов для инъекций;
4. ПК–47 Способность и готовность к проведению информационнопросветительской работы по пропаганде здорового образа жизни и безопасности жизнедеятельности Броматометрия Броматометрия, или броматометрическое титрование, — метод определения восстановителей путем титрования стандартным раствором бромата калия КВrO3.
В основе метода лежит полуреакиия BrO 3 ; +6е + 6H + = ВR + 3H 2 O;
Стандартный ОВ потенциал редокс-пары BrO3,H+Br при комнатной температуре равен 1,44В, т.е. имеет довольно высокие значение.
Поэтому бромат калия в кислой среде является сильным окислителем и способен окислять многие восстановители.
В соответствии с вышеприведенной полуреакцией фактор эквивалентности бромат-иона в ОВ процессах такого типа равен 1z = 1n = 1/6.
Молярная масса эквивалента бромата калия в подобных ОВ реакциях равна М (16 КВгО3) = М (КВгО3)/6 = 27,833 г/моль.
Молярная концентрация с (КВгО3) и молярная концентрация эквивалента с(1/6КВrOз) связаны соотношением:
В качестве титранта метода применяют водный раствор КВrО3, чаще всего с молярной концентрацией эквивалента 0,1 моль/л. Титрант можно готовить по точной навеске кристаллического бромата калия марки «х.ч», высушенного до постоянной массы при -150 °С.
Приготовление 0,1 Н. раствора бромата калия.
Растворяют 2,7833 г высушенного бромата калия в воде и разбавляют до 1 л в мерной колбе. Раствор бромата калия устойчив при хранении неограниченно долгое время.
Проверка нормальности раствора бромата по раствору тиосульфата натрия. Проверку нормальности проводят в случае необходимости.
Отбирают пипеткой 25,0 мл 0,1 моль/л раствора бромата калия в колбу для титрования. Добавляют 5 мл 4 Н. раствора НС1 или 5 мл разбавленной (1:5) H2S04 и 10 мл 20%-ного раствора иодида калия. Перемешивают, дают раствору постоять 10 мин и разбавляют водой до 200 мл. Выделившийся иод оттитровывают 0,1 моль/л раствором тиосульфата натрия, прибавляя вблизи конечной точки 2—3 мл раствора крахмала.
Титрант хранят в сосудах из темного стекла с притертыми пробками и темном месте.
Раствор титранта — бромата калия — бесцветен. Образующиеся в ОВ процессе бромид-ионы также бесцветны.
При броматометрнческом титровании после достижения ТЭ первая же избыточная капля титранта взаимодействует с бромид-ионами с образованием брома:
ВrО 3 + 5Вr +6Н + = 3Вr 2 + 3Н 2 О Образующийся бром окрашивает раствор в бледно-желтый цвет. Эта окраска, однако, недостаточно интенсивна для визуальной фиксации КТТ. Поэтому броматометрическое титрование ведут в присутствии индикаторов, например метилового оранжевого, метилового красного, нейтрального красного, которые в кислой среде окрашивают титруемый раствор в красный цвет. После достижения ТЭ такие азоиндикаторы необратимо бромируются бромом, образующимся после ТЭ согласно вышеприведенной реакции, вследствие чего раствор обесцвечивается;
Титрование ведут медленно во избежание локального образования брома в растворе до достижения ТЭ.
Обратимые индикаторы, такие, как -нафтолфлавон, пэтоксихризоидин соляно-кислый, хинолиновый желтый реагируют с бромом обратимо. Они также используются для определения КТТ.
При описанном способе броматометрически титруют вещества, которые являются более эффективными восстановителями, чем бромидионы. Прибавляемый титрант вначале окисляет эти вещества. Только после того, как они полностью прореагируют с броматом калия, последний начинает окислять бромид-ионы. Образуется бром, вступающий в реакцию с индикатором, бромируя его, вследствие чего раствор и обесцвечивается.
Часть титранта расходуется на реакцию с индикатором, поэтому в броматометрии обычно проводят холостое титрование раствора, содержащего такое же количество индикатора, что и анализируемый раствор, но в отсутствие определяемого вещества. Количество титранта, израсходованное на холостое титрование, вычитают из общего количества титранта, затраченного на титрование анализируемого раствора.
Условия проведения броматометрического титрования.
В броматометрии учитывают следующие обстоятельства:
Влияние кислотности раствора.
Реальный ОВ потенциал редокс-пары BrO3,H+Br сильно зависит от концентрации водородных ионов:
Е= Е 0 + (0,059/6) lg([BrO3],[H+][Br]) и увеличивается с понижением рН раствора. Поэтому броматометрическое титрование рекомендуется проводить в сильнокислой среде.
При индикаторной фиксации КТТ первая же избыточная капля прибавленного титранта — раствора бромата калия — должна приводить к возникновению брома, взаимодействующего с индикатором. Если же на образование брома после ТЭ потребуется большее количество титранта, то ошибка анализа возрастает. Поэтому титрование необходимо вести в таких условиях, когда лишь минимальное количество избыточного бромата калия после ТЭ приводит к протеканию реакции и образованию брома.
ВrО 3 + 5Вr +6Н + = ЗВr 2 + ЗН 2 О (1) Константа равновесия К реакции высока и при комнатной температуре равна К = [Br2]3 /[ВrО3][Вr]5[Н+]6
1036 Как видно из этого соотношения и уравнения (1), на положение равновесия (1) сильно влияет концентрация ионов водорода и лишь при рН 1 бромид-ионы количественно окисляются до брома.
С учетом изложенного броматометрическое титрование проводят в растворах хлороводородной кислоты с концентрацией не ниже 1 моль/л.
ОВ реакции с участием бромат-ионов часто протекают медленно.
Для увеличения скорости реакций растворы нагревают до -70 °С.
В ряде случаев реакции броматометрического окисления ускоряются в присутствии солей ртути (II).
Броматометрический метод применяется для количественного определения лекарственных средств, которые являются восстановителями, например изониазида, а также фенолов (фенола, тимола, резорцина, кислоты салициловой, синэстрола и др.) и первичных ароматических аминов (например, стрептоцида). Определение фенолов и ароматических аминов основано на реакции электрофильного замещения — бромирования.
Броматометрическое титрование используют для определения олова(II), мышьяка(Ш), сурьмы(Ш), железа(II), пероксида водорода, нитритов, тиоцианатов, гидразина, фенилгидразина, гидроксиламина, семикарбазида, тиокарбамида, щавелевой кислоты, в количественном анализе фармацевтических препаратов, таких, как As2O3, мышьяксодержащие новарсенол, миарсенол, аминарсон, осарсол, после их минерализации и перевода в соединения мышькка(Ш).
Бромид-броматный метод Для определения многих органических соединений (фенола, анилина и др.) пользуются смесью бромата с бромидом (КВrОз и КВr), которые в кислой среде выделяют свободный бром:
КВrО3 + 5КВr + 6НС1 = 6КС1 + 3Вr2 + 3Н2О Бром в момент выделения бромирует органическое соединение.
Для связывания избытка брома вводят раствор иодида калия в кислой среде:
KI + НС1 = КС1 + HI Br2 + 2HI = 2НВr + 12 Иод, выделившийся в количестве, эквивалентном избытку брома, титруют раствором тиосульфата натрия, добавляя вблизи конечной точки титрования 2—3 мл раствора крахмала.
Приготовление 0,1 моль/л раствора бромид-бромата и установление его нормальности. Растворяют в небольшом объеме воды 2,7833 г бромата калия и добавляют раствору 10г бромида калия. После растворения солей раствор переводят в мерную колбу вместимостью 1л и разбавляют водой до метки.
Нормальность раствора устанавливают иодометрически. Отбирают пипеткой 25,0 мл раствора бромид-бромата в колбу для титрования и прибавляют 25 мл концентрированной НСl. Добавляют 10 мл 10%-ного раствора Иодида калия и через 3 ми оттитровывают выделившийся иод 0,1 моль/л раствором тиосульфата натрия, добавляя вблизи конечной точки раствор крахмала.
Бромато-бромидный метод определения органических препаратов Большой интерес представляет применение бромато-бромидного раствора к реакциям замещения бромом водорода в предельных органических соединениях. В отличие от реакций присоединения галогенов здесь при замещении образуется также эквивалентное количество галогеноводорода.
Для аналитических целей особенно большое значение имеют реакции бромирования ароматических окси- и аминосоединений:
С6Н5ОН + ЗВr2 = С6Н2Вr3ОН + 3НВr При некоторых условиях бром может также заместить и водород гидроксильной группы фенола:
С6Н2Вr3ОН + 4Вr2 = С6Н2Вr3ОВr + 4НВr При добавлении к этому соединению нодида калия снова получается трибромфенол и выделяется эквивалентное количество йода:
2 С6Н2Вr3ОВг + 2HJ = 2 С6Н2Вr3ОН + 2HBr + J2 Как известно, производные бензола, которые имеют в бензольном ядре гидроксильные или аминогруппы (первичные, алкилированные или ацетилированные), обладают способностью особенно легко замещать водород на бром.
При бромировании фенолов и ароматических аминов необходимо учитывать следующие важнейшие правила:
1. Бром замещает водороды в орто- и пара-положении по отношению к группам NH2 и ОН.
2. Если в бензольном ядре в орто- или пара-положениях к группам NH2 или ОН имеются такие заместители водорода, как СН3, NO2, C1, Вт, J, — N=N—R, — N=N—C1, то они препятствуют вхождению брома в занятые ими положения и образуются дибромозамещенные продукты. Если эти заместители находятся в пара-положении, то при наличии достаточного избытка брома они не препятствуют образованию трибромзамещенных соединений.
3. Если в бензольном ядре в орто- или пара-положении к группам NH2 или ОН имеются такие заместители водорода, как группы СООН или SO2OH, то при взаимодействии с избытком брома образуются трибромпроизводные и выделяется СО2 или SO2. Замещение групп СООН или SO2OH бромом происходит и тогда, когда в метаположении к ним находятся другие группы, например СН3 или NO2-. He замещаются группы СООН или SO2OH бромом в том случае, если эти группы находятся в мета-положении к группам NH2 или ОН. Так, например, при взаимодействии салициловой (ортооксибензойной) кислоты с избытком брома выделяется СО2 и образуется трибромфенол:
м-Оксибепзоиная кислота также принимает 3 атома брома, но сохраняет карбоксильную группу:
Подобным же образом ведут себя анилинсульфоновые и аминосульфоновые кислоты.
При бромировании о-аминобензолсульфокислоты сначала образуется дибромпроизводное, а при дальнейшем добавлении брома образуется триброманилин:
При бромировании м-аминобензолсульфокислоты сульфогруппа не теряется:
Наконец, м-аминобензолсульфокислота (сульфаниловая) при взаимодействии с двумя эквивалентами брома образует дибромпроизводное, которое при добавлении избытка брома превращается в триброманилин:
Толуидинсульфокислоты бромируются таким же образом.
4. Если в бензольном ядре имеются две группы ОН или NH2 или одновременно и та и другая, то м-соединения дают трибромпроизводные, а о- и п-соединения не бромируются, например, при взаимодействии пирокатехина, гидрохинона, п-аминофенола с бромом образуются продукты окисления этих соединений.
Для количественного определения органического соединения методом бромирования возможны два следующих общих способа.
а) К сильно подкисленному раствору исследуемого вещества добавляют бромид калия и титруют раствором бромата калия до появления избытка свободного брома, определяемого по желтой окраске или при помощи азоиндикатора, или с йодкрахмальной бумагой.
б) К раствору исследуемого вещества прибавляют бромид и избыток титрованного раствора бромата, затем жидкость подкисляют, дают постоять и через определенный промежуток времени, указанный в конкретной методике, добавляют йодид калия и выделяющийся йод оттитровывают Na2S2O3.
Описанный метод анализа неприменим для многоатомных фенолов, которые при действии брома не только замещают водород на бром, но и окисляются последним.
При количественном определении сложных эфиров салициловой кислоты (метилсалицилат, фенилсалицилат, кислоты ацетилсалициловой) методом бромирования следует их предварительно омылять нагреванием с раствором едкой щелочи, а анилиды (ацетанилид) — предварительно гидролизовать соляной кислотой.
Титранты метода броматометрии: растворы калия бромата и натрия тиосульфата.
Вспомогательные растворы: калия бромида и калия иодида.
Индикаторы:
1) Раствор крахмала
2) Метиловый оранжевый
3) Без индикатора.
Основан на свойстве лекарственных веществ — фенолов и ароматических аминов вступать в реакцию электофильного замещения атомов водорода ароматического кольца на атомы брома.
А. Прямое титрование Тимол (ФС), сульфаниламид (стрептоцид), прокаина гидрохлорид (новокаин), бензокаин (анестезин).
1. Стрептоцид белый (Streptocidum album) (неоф. метод) M. в. 172,21 C6 H 8 O 2 N 2 S
Определение основано на реакции:
f экв.= 1/4 Грамм-эквивалент препарата =43,05 г.
Около 0,1 г препарата (точная навеска) помещают в мерную колбу вместимостью 200 мл и растворяют в смеси, состоящей из 40 мл воды и 20 мл разведенной кислоты хлороводородной. Раствор доводят водой до метки и перемешивают. 50 мл полученного раствора переносят пипеткой в коническую колбу вместимостью 200 мл, прибавляют 5 мл раствора калия бромида, 5 мл концентрированной кислоты серной, 1 каплю раствора индикатора метилового красного и медленно при сильном взбалтывании титруют 0,1 моль/л раствором калия бромата до обесцвечивания, титруя в конце медленно, капля за каплей.
1 мл калия бромата соответствует 0,004305 г стрептоцида, которого в препарате должно быть не менее 99,0 %.
2. Тимол (Thymolum) (ФС) КВrО3 + 5КВr + 3Н2SO4 = 3Вr2 + 3K2SO4 + 3Н2О
f экв.= 1/4 Методика.
К навеске тимола прибавляют бромид калия, серную кислоту и титруют раствором бромата калия. Выделяющийся при взаимодействии бромата и бромида калия бром реагирует с тимолом. В качестве индикатора при прямом бромировании применяют обычно азокрасители (метиловый оранжевый, метиловый красный), которые разрушаются бромом, вследствие чего красное окрашивание раствора исчезает.
1 мл 0,1 моль/л раствора бромата калия соответствует 0,003755 г тимола.
Б. Обратное титрование.
Избыток брома определяют иодометрическим методом.
Фенолопроизводные (фенол, резорцин (ФС)), натрия салицилат, фенилсалицилат (после гидролиза), салициловая кислота (с декарбоксилированием), производные урацила, гексэстрол (синэстрол) (масляный 2% раствор для инъекций — ФС)
1. Резорцин (Rеsorcinum) (ФС) м-Диоксибензол С6Н6О2 М.в. 110,11
Определение резорцина основано на следующих реакциях:
КВrО3 + 5КВr + 3Н2SO4 = 3Вr2 + 3K2SO4 + 3Н2О
f экв.= 1/6 Отсюда грамм-эквивалент резорцина равен М/6 =18,35 г.
Методика. Около 0,2 г препарата (точная навеска) помещают в мерную колбу вместимостью 100 мл, растворяют в 20 мл воды и доводят объем раствора водой до метки. 20 мл этого раствора переносят в склянку для бромирования вместимостью 250 мл, прибавляют 40 мл 0,1 моль/л раствора калия бромата, 10 мл раствора калия бромида, 10 мл 50 % раствора кислоты серной, перемешивают и оставляют на 15 мин. Затем к смеси прибавляют 20 мл раствора калия йодида, смесь сильно взбалтывают и оставляют на 10 мин в темном месте. После этого добавляют 2—3 мл хлороформа и титруют выделившийся йод 0,1 моль/л раствором натрия тиосульфата. Параллельно проводят контрольный опыт.
1мл 0,1 моль/л раствора калия бромата соответствует 0,001835 г С6Н6О2 (резорцина), которого в препарате должно быть не менее 99,0 %.
2. Натрия салицилат (Nalrii salicylas) (неоф. метод) С13Н5О3Na М.в.= 160,11 Определение основано на бромировании кислоты салициловой, при этом происходит декарбоксилирование и образуется трибромфенол:
f экв.= 1/6 Методика. Около 0,075 г натрия салицилата (.точная навеска) растворяют в 50 мл воды, прибавляют 25 мл 0,2 моль/л раствора калия бромата, 1 г калия бромида, 10 мл 2 моль/л раствора кислоты хлороводородной и оставляют на 15 мин. Добавляют 1 г калия йодида и оставляют в темном месте на 10 мин. Титруют 0,2 моль/л раствором натрия тиосульфата при встряхивании.
1 мл 0,2 моль/л раствора калия бромата соответствует 0,005336 г натрия салицилата, которого должно быть не менее 9,9,5 %..
3. Фенилсалицилат (неоф. метод) Броматометрическое определение феннлсалицилата требует предварительного омыления препарата путем кипячения с 10 % раствором едкого натра в течение 10 —15 мин:
Объем щелочного раствора доводят водой до 100 мл и далее определяют по методике.
Образовавшиеся натрия салицилат и фенолят бромируются в кислой среде:
f экв.= 1/12 Методика. В склянку с притертой пробкой помещают 10—15 мл приблизительно 0,1 моль/л раствора исследуемого препарата, прибавляют двойное количество (20—30 мл) 0,1 моль/л раствора бромата калия, 0,5— 1,0 г бромида калия, подкисляют 10мл 50% раствора Н2SO4, перемешивают и оставляют на 10мин.
После этого к смеси прибавляют 10—15 мл 10 % раствора йодида калия, взбалтывают, оставляют на 5 мин и выделившийся йод титруют 0,1 моль/л раствором тиосульфата натрия (индикатор — крахмал). Иногда вместо крахмала применяют в качестве индикатора хлороформ — в этом случае титруют при сильном взбалтывании раствора до обесцвечивания хлороформного слоя. Применение хлороформа имеет то преимущество, что в нем растворяются бромопроизводные фенолов, однако необходимость титрования при сильном взбалтывании создает определенные трудности.
1мл 0,1 моль/л раствора калия бромата соответствует 0,001785г.
4. Тегафур (фторафур) (неоф. метод)
2. Окисления Метод основан на применении в качестве титранта калия бромата, который в кислой среде является сильным окислителем:
BrO 3 + 6Н + + 6е = Вr + 3Н2О (Е° = 1,52 В).
Обычно в анализируемый раствор перед титрованием добавляют калия бромид,который при взаимодействии с броматом в кислой среде выделяет бром.
Образующийся бром используется как окислитель:
В качестве индикаторов при прямом броматометрическом определении чаще применяют кислотно-основные индикаторы (метиловый оранжевый, метиловый красный, конго красный), которые в конечной точке титрования необратимо окисляются избытком окислителя (обесцвечиваются).
При обратном титровании избыток брома определяют йодометрически.
Броматометрический метод применяется для количественного определения лекарственных средств, которые являются восстановителями, например изониазида, производных мышьяка, а так же для экспресс анализа йодсодержащих лекарственных веществ.
А. Прямое титрование
1) Определение производных мышьяка Бромат калия является сильным окислителем; значение нормального окислительного потенциала пары ВrО3/Вr сравнительно высокое (Е0=1,426).
Электронно-ионную реакцию восстановления ионов бромата можно представить схемой:
ВrО3 + 6Н+ + 6е = Вr + 3Н2О В достаточно кислом растворе равновесие между бромат-ионами и бромид-ионами невозможно, так как они взаимодействуют между собой, при этом выделяется элементарный бром:
ВrО3 + 6Н+ + 5Вr = 3Вr2 + 3Н2О
Таким образом, окислителем по существу является бром:
Вr2 + 2е = 2Вr Из приведенных схем реакций видно, что грамм-эквивалент КВгО3, употребляемого в качестве титрованного раствора, равен 1/6 его грамммолекулы.
При прямом титровании раствором КВrО3 точку эквивалентности определяют по появлению бледно-желтой окраски раствора (свободный бром). Чтобы легче обнаружить появление свободного брома, можно применить в качестве индикаторов органические красители (метиловый оранжевый или метиловый красный), которые окисляются свободным бромом и раствор обесцвечивается. Окисление же метилового оранжевого и метилового красного является процессом необратимым, и это следует учитывать при титровании.
1. Мышьяковистый ангидрид (Acidum arsenicosum anhydricum) M. в. 197,82 As2O3
Определение основано на следующих реакциях:
2 КВrО3 + 3As2O3 = 3As205 + 2KBr 2 ВrО3 + 6As3+ + 6Н+ = 6 As5+ + 2Вr + 3Н2О Образующийся бромид окисляется броматом с выделением брома, который также окисляет мышьяковистый ангидрид в мышьяковый:
КВrО3 + 5KBr + 6HCI = 3Вr2 + 6КС1 + 3 Н2О As2O3 + 3Вг2 + 2H2O = As2O5 + 4HBr Первая избыточная капля раствора калия бромата после окончания реакции окисления мышьяковистого ангидрида образует свободный бром, который обесцвечивает индикатор.
Из приведенных выше реакций видно, что 3 моля мышьяковистого ангидрида эквивалентны 2 молям бромата калия, т. е. 12 эквивалентам, поэтому грамм-эквивалент As2O3 равен (3-197,18): 12=49,464 г.
Б. Обратное титрование.
Вещества, которые непосредственно не титруются броматом, определяют методом обратного титрования, добавляя избыток раствора калия бромата и оттитровывая непрореагировавший остаток йодометрическим методом.
1. Изониазид. (неоф. метод).
C6H7N3O По МФII определение основано на окислении препарата бромом, полученным из бромата калия и бромида калия в солянокислой среде:
Избыток калия бромата определяют йодометрически.
f экв.= 1/4 Методика. Около 0,05 г препарата (точная навеска) растворяют в 50 мл воды в колбе с притертой пробкой и прибавляют 25 мл 0,1 моль/л раствора калия бромата, 2,5 г калия бромида и 10 мл кислоты хлороводородной, оставляют на 15 мин. Осторожно прибавляют 1 г калия йодида, растворенного в 5 мл воды, и титруют 0,1 моль/л раствором натрия тиосульфата (индикатор — крахмал).
1 мл 0,1 моль/л раствора калия бромата соответствует 0,003429 г C6H7N3O (изониазида), которого в препарате должно быть не менее 98,5 % и не более 101,0 % в пересчете на вещество, высушенное до постоянной массы при 105 °С.
Недостатки метода броматометрии:
1. Требует создания особых условий. (тяги и т.д.)
2. Метод длительный и трудоемкий.
Титрование ведут медленно во избежание локального образования брома в растворе до достижения ТЭ. При быстром титровании и недостаточном перемешивании в отдельных местах раствора, куда попадают капли бромата, может образоваться избыточное количество свободного брома, в результате чего в этих местах происходит окисление индикатора и ослабление окраски еще до окончания титрования. В таких случаях необходимо прибавить, еще несколько капель индикатора.
3. На процесс бромирования влияют условия определения: избыток брома, длительность реакции, концентрация кислоты, в связи с чем для получения точных результатов необходимо строго соблюдать условия определения, разработанные для каждого препарата.
4. В связи с тем, что калия бромат является довольно сильным окислителем, при определении препаратов в смесях, особенно методом обратного титрования, могут протекать побочные реакции. Для выявления взаимодействия сопутствующих компонентов с титрантом рекомендуется ставить контрольный опыт.
Йодхлорметрия Йодхлорметрия, или йодхлорметрическое титрование — метод определения восстановителей с применением титранта — раствора монохлорида иода(I) IC1.
Стандартный ОВ потенциал редокс-пары 1С1|Cl при комнатной темпрературе равен 0,795 В.
Монохлорид иода может также восстанавливаться по схеме 2IС1 + 2е = I 2 + 2Сl (2) Стандартный ОВ потенциал редокс-пары ICl|I2 при комнатной температуре еще выше и равен 1,19 В.
При титровании восстановителя X с учетом полуреакции (1) выделяются иодид-ионы. После того как все количество восстановителя прореагирует с ICI, прибавляемый избыточный IС1 окисляет иодид-ионы:
ICl + I= I2 + Cl (3) Суммарно (1) и (3) дают полу реакцию (2).
В соответствии с полуреакиисй (1) число электронов, принимаемых одной молекулой ICl, равно n = 2. Поэтому фактор эквивалентности монохлорида иода равен 1/z = 1/n = 2;
Mолярная масса эквивалента M(1/2 ICl) = М(ICl)/2 = 162,358/2 = 81,179 г/моль. Молярная концентрация с(IС1) и молярная концентрация эквивалента с(1/2 IС1) связаны соотношением 2с(IСl) = с(1/2 IСl) Как окислитель монохлорид иода эффективнее иода и более устойчив.
В качестве титранта в хлориодиметрии применяют раствор монохлорида иода ICll с молярной концентрацией эквивалента, равной обычно 0,1 моль/л.
Монохлорид иода представляет собой твердое вещество красного цвета с температурой плавления 27°С. Однако раствор титранта по навеске монохлорида иода не готовят. Монохлорид иода обычно получают непосредственно в сильнокислом растворе на основе реакции между иодидом и иодатом калия в соляно-кислых растворах.
2KI + КIO3 + 6НС1 = 3ICl + ЗКСl + ЗН2О Для получения раствора монохлорида иода смесь 5,53 г иодида калия и 3,55 г иодата калия помещают в стеклянную колбу с притертой пробкой и прибавляют 50 мл дистиллированной воды, 40 мл концентрированной НСl. Смесь перемешивают до полного растворения иода, первоначально образующегося при протекании реакции.
Прибавляют 10 мл хлороформа, смесь переносят в делительную воронку и взбалтывают.
Если органический слой принимает фиолетовую окраску, то это означает, что в смеси имеется некоторое количество иода. В этом случае к смеси прибавляют по каплям 1%-ный раствор КIO3 при энергичном взбалтывании до полного обесцвечивания органического слоя.
Если органический слой бесцветный, то прибавляют по каплям 1%ный раствор КI до появления слабо-розовой окраски этого слоя.
После полного расслоения органической и водной фаз отделяют водную фазу в мерную колбу на 1 л и доводят объем раствора до метки дистиллированной водой.
Полученный раствор монохлорида иода имеет лимонно-желтый цвет.
Стандартизацию раствора монохлорbда иода проводят по стандартному раствору тиосульфата натрия. Для этого 25 мл раствора монохлорида иода, полученного, как описано выше, помещают в колбу для титрования с притертой пробкой, прибавляют 1 г иодида калия и оставляют смесь на 15 минут в темном месте. При этом протекает реакция ICl + KI = I2 +КСl Иод, выделившийся в количестве, эквивалентном количеству прореагировавшего монохлорида иода, титруют стандартным 0,1 моль/л раствором тиосульфата натрия в присутствии крахмала до исчезновения синей окраски раствора.
Стандартизованный раствор монохлорида иода хранят в сосудах из темного стекла с притертыми пробками, в темном месте.
Поскольку раствор монохлорида иода при хранении способен несколько изменять свой титр, то каждый раз перед применением определяют заново его титр по стандартному раствору тиосульфата натрия.
В хлориодиметрии в качестве индикатора используют свежеприготовленный раствор крахмала.
При титровании восстановителей в растворе накапливаются иодидионы в соответствии с полуреакцией ICl + 2e = I + C1 После ТЭ первая же капля избыточного титранта, содержащего монохлорид иода, взаимодействует с иодид-ионами по реакции ICl + I= I2 + Cl с образованием иода, который тотчас же в присутствии крахмала окрашивает раствор в синий цвет; титрование заканчивают.
Определение конца титрования проводят также потенциометрнческп.
Условия хлориодиметрического титрования.
Титрование проводят в кислой, нейтральной или слабощелочной среде.
В сильнощелочных растворах протекает побочная реакция:
IСl + 2OH = IO + Cl + Н2О Образующиеся гипоиодид-ионы IO могут сами взаимодействовать с определяемым веществом-восстановителем.
В щелочной среде протекает и другая побочная реакция:
I2+ 2OH = IO + I + Н2О с участием иода, образующегося при титровании определяемого восстановителя. Поэтому титрование в щелочных средах дает неточные результаты.
Метод используют для определения различных восстановителей, ряда органических лекарственных препаратов — сульфамидных производных, барбитуратов, тиобарбитуратов, новокаина, риванола, других органических соединений.
При прямом титровании раствором монохлорида иода можно определять ртуть(I), олово(II), мышьяк(III), сурьму(III), железо(II), иодиды, сульфиты, тиоиианаты, аскорбиновую кислоту, гидразин и его производные, гидрохинон, метионин, тиокарбамид и его производные и т.д.
Как уже отмечалось выше, в хлориодиметрии определение конца титрования часто проводят потенциометрическим методом.
Железо(II) при прямом титровании можно определять на основе реакции:
2Fe2+ + ICl = 2Fe3+ + I + Cl в кислой среде при рН = 0,5—1,0. Для достижения высокой полноты протекания реакции титрование ведут в присутствии небольшого избытка комплексона ЭДТА, который образует с продуктом реакции — железом(Ш) — устойчивый комплексонат FeY и тем самым сдвигает равновесие вправо. Суммарно уравнение реакции можно представить в виде 2Fe2+ + ICl + 2Н2Y2 = 2FeY+ I + Сl + 4Н+ Здесь Н2Y2—сокращенное обозначение аниона этилендиамин тетрауксусной кислоты. В данном случае ТЭ можно фиксировать потенциометрически.
Ферроцианиды титруют до феррицианидов на основе реакции 2[Fe(CN)6]4- + 2ICl = 2[Fe(CN)6]3- + I2 + 2Сl в слабощелочной среде (предпочтительно в присутствии NaHCO 3).
Тиоцианаты (роданиды) титруют в нейтральной, слабокислой или слабощелочной среде. Реакции можно описать следующими уравнениями.
В слабощелочной среде:
NCS + 4ICl + 8ОН = SO42 + ICN + 3I + 4Сl + 4Н2О
В нейтральной или слабокислой среде:
NCS + 7ICl + 4H2O = SO42 + ICN + 3I2 + 7Cl + 8H+ Титрование гидрохинона С6Н4(ОН)2 до хинона C6H4O2 также проводят либо в слабокислой, либо в слабощелочной среде согласно следующим реакциям.
В слабокислой среде:
В слабощелочной среде:
Аскорбиновую кислоту (витамин С) можно определять прямым титрованием раствором ICд на основе реакции:
аскорбиновая кислота, Методами обратного и заместительного титрования определяют железо(II), ртуть(I), сульфиты, фенол, резорцин, салицилаты и др.
Так, при определении железа(II) к анализируемому раствору, содержащему железо(П), прибавляют в избытке раствор ICl.
При этом протекает реакция:
2 Fe2+ + 2ICl = 2Fe3+ + I2 +2ClВыделившийся иод оттитровывают.
При определении Hg 2Cl2 навеску препарата, содержащего хлорид ртути(I), встряхивают 2—3 минуты с известным количеством раствора IС1, взятого в избытке, в соляно-кислой среде. При этом Hg2CI2 растворяется. После его растворения прибавляют избыток 10%-ного раствора КI и оттитровывают выделившийся иод стандартным раствором тиосульфата натрия.
При анализе органических лекарственных препаратов, способных иодироваться, к анализируемому раствору, содержащему определяемое вещество, прибавляют избыток стандартизованного раствора ICl и оставляют смесь на некоторое время для протекания реакции. Затем к смеси прибавляют избыток иодида калия и выделившийся иод оттитровывают стандартным раствором тиосульфата натрия в присутствии индикатора крахмала.
Так поступают, например, при определении лактата этакридина.
Вариант обратного титрования
1. Этакридин (Aethacridinum) 2-Этокси-5,9-диаминоакридина лактат С15Н15ОN3 С3Н6О3 М.в. 343,39 Йодхлорометрическим методом определение осуществляется по следующей реакции:
f экв.= 1/4 Так как на йодирование 1 моля этакридина расходуется 2 моля хлористого йода, а каждый моль хлористого йода эквивалентен 2 грамматомам йода, то грамм-эквивалент этакридина равен М/4 = 85,85 г.
Вариант обратного титрования.
f экв.= 1/6 Методика. 10 мл приблизительно 0,1 моль/л раствора исследуемого препарата переносят в склянку с притертой пробкой, прибавляют 100 мл дистиллированной воды и 20мл 0,1 моль/л раствора йодмонохлорида, перемешивают и оставляют на 5 мин.
Затем прибавляют 10 – 15 мл 10% раствора йодида калия, который реагирует с избытком иодмонохлорида:
ICl + KI = I2 + KCl Выделившийся йод титруют 0,1 моль/л раствором тиосульфата натрия (индикатор — крахмал).
1мл 0,1 моль/л раствора йодмонохлорида соответствует 0,001568г.
4. Салициловая кислота (неоф. метод)
Вариант обратного титрования.
f экв.= 1/4 Методика. 10 мл приблизительно 0,1 моль/л раствора исследуемого препарата переносят в склянку с притертой пробкой, прибавляют 100 мл дистиллированной воды и 20мл 0,1 моль/л раствора йодмонохлорида, перемешивают и оставляют на 5 мин.
Затем прибавляют 10 – 15 мл 10% раствора йодида калия, который реагирует с избытком иодмонохлорида:
ICl + KI = I2 + KCl Выделившийся йод титруют 0,1 моль/л раствором тиосульфата натрия (индикатор — крахмал).
1мл 0,1 моль/л раствора йодмонохлорида соответствует 0,003453г.
Недостатки метода хлориодиметрии.
1. Требует создания особых условий. ( тяги и т.д.)
2. Раствор монохлорида иода неустойчив при хранении, и способен несколько изменять свой титр. Следовательно, каждый раз перед применением, необходимо определять заново его титр по стандартному раствору тиосульфата натрия.
3. Титрование необходимо проводить в кислой, нейтральной или слабощелочной среде. В сильнощелочных растворах протекает побочная реакция:
IС1 + 2OH = IO + Cl + Н2О Образующиеся гипоиодид-ионы IO могут сами взаимодействовать с определяемым веществом-восстановителем.
В щелочной среде протекает и другая побочная реакция:
I2+ 2OH = IO + I + Н2О с участием иода, образующегося при титровании определяемого восстановителя. Поэтому титрование в щелочных средах дает неточные результаты.
4. Ошибки йодхлорметрического определения так же могут быть связаны с высокой окислительной способностью титранта. Они возрастают при использовании метода обратного титрования (особенно при повышенной температуре). Поскольку многие сопутствующие восстановители могут мешать определению, отрабатывая методику анализа смеси, необходимо ставить контрольные опыты. Например, при определении малых количеств цитраля даже индикатор крахмал следует строго дозировать пипеткой и в контрольный, и в исследуемый растворы, добавляя его в конце титрования (продукты разложения крахмала также взаимодействуют с йодмонохлоридом)
5. Метод длительный и трудоемкий.
Задачи для самостоятельного решения.
1. Приведите уравнения реакций количественного определения тимола (Мг 150,22) методом броматометрии, молярную массу эквивалента, титр по определяемому веществу. Укажите индикатор, переход окраски в точке конца титрования и процесс, происходящий с индикатором.
а. Рассчитайте навеску тимола, чтобы на титрование пошло 20 мл 0,1 моль/л раствора калия бромата (К=0,98).
б. Рассчитайте объем 0,1 моль/л раствора калия бромата (К=1,02), который пойдет на титрование аликвоты объемом 10,0 мл из раствора, полученного после растворения и доведения до метки в мерной колбе вместимостью 100,0 мл навески тимола массой 0,5042 г.
в. Оцените качество тнмола по показателю «Количественное содержание» (должно быть не менее 99,0%), если навеску анализируемого образца массой 0,50075 г растворили и довели водой до метки в мерной кобле вместимостью 100 мл.
На титрование аликвоты объемом 10,0 мл пошло 13,1 мл 0,1 моль/л раствора калия бромата (К=1,02). Укажите значение допустимого верхнего предела количественного содержания тимола согласно ФС.
2. Приведите уравнения реакций количественного определения резорцина (Мг 110,11) методом обратной броматометрии, молярную массу эквивалента, титр по определяемому веществу. Укажите индикатор, переход окраски в точке конца титрования.
а. Оцените качество резорцина по показателю «Количественное содержание», если точную навеску массой 0,30395 г растворили и довели водой до метки в мерной колбе вместимостью 100 мл. К 20,0 мл полученного раствора добавили 40,0 мл 0,1 моль/л раствора калия бромата (К=1,00), на титрование избытка которого пошло 6,7 мл 0,1 моль/л раствора натрия тиосульфата (К= 1,01). На титрование контрольного опыта пошло 39,5 мл 0,1 моль/л раствора натрия тиосульфата.
б. Рассчитайте объем 0,1 моль/л раствора натрия тиосульфата (К=1,0), который пойдет на титрование избытка 0,1 моль/л раствора калия бромата (К=1,0), добавленного в количестве 40,0 мл к аликвоте объемом 20,0 мл. Аликвота взята из раствора, полученного после растворения и доведения водой до метки в мерной колбе вместимостью 100,0 мл навески резорцина массой 0,29845 г.
3. Приведите уравнения реакций количественного определения фенола (Мг 94,11) методом обратной броматометрии. Укажите индикатор, переход его окраски в точке конца титрования.
Оцените качество фенола чистого жидкого по показателю «Количественное содержание» (должно быть 89,0 — 92,0%), если навеску препарата массой 0,49812 г растворили и довели водой до метки в мерной колбе вместимостью 250 мл.
К аликвоте объемом 25,0 мл добавили 50,0 мл 0,1 моль/л раствора калия бромата (К=1,02), на титрование избытка которого пошло 23,0 мл 0,1 моль/л раствора натрия тиосульфата (К=1,01). На титрование контрольного опыта пошло 52,0 мл 0,1 моль/л раствора натрия тиосульфата (К=0,98).
4. Приведите уравнения реакций количественного определения кислоты салициловой (Мг 138,1) методом обратной броматометрии. Укажите индикатор, переход его окраски в точке конца титрования.
а. Рассчитайте молярную массу эквивалента, титр по определяемому веществу, содержание кислоты салициловой, если к навеске массой 0,0576 г добавлено 50,0 мл 0,1 моль/л раствора калия бромата (К=0,98). На титрование избытка указанного титранта в основном опыте пошло 23,75 мл 0,1 моль/л раствора натрия тиосульфата (К=1,02), в контрольном опыте — 48,0 мл.
б. Рассчитайте объем 0,1 моль/л раствора натрия тиосульфата (К = 0,99), который пойдет на титрование избытка 0,1 моль/л (УЧ 1/6 КВтОз) раствора калия бромата (К=1,01), добавленного в количестве 40,0 мл к аликвоте объемом 20,0 мл. Аликвота взята после растворения и доведения водой до метки в мерной колбе вместимостью 100,0 мл иавески кислоты салициловой массой 0,2134 г.
5. Приведите уравнения реакций количественного определения фторафура (Мг 200,17) методом обратной броматометрии. Укажите индикатор, переход окраски в точке конца титрования.
а. Рассчитайте молярную массу эквивалента, титр по определяемому веществу, навеску фторафура, чтобы на титрование пошло 20 мл 0,1 моль/л раствора калия бромата (К=1.02). Какой объем указанного титранта следует добавить к рассчитанной навеске для варианта обратной броматометрии?
б. Рассчитайте содержание фторафура (%), если на титрование избытка 0,1 моль/л раствора калия бромата (К=1,0), добавленного к навеске массой 0,1512 г в количестве 25,0 мл, затрачено 9,8 мл 0,1 моль/л раствора натрия тиосульфата (К=1,02).
в. Рассчитайте объем 0,1 моль/л раствора натрия тиосульфата (К=0,99), который пойдет на титрование избытка 0,1 моль/л раствора калия бромата (К=1,01), добавленного к навеске фторафура массой 0,1495 г в количестве 20,0 мл.
СПИСОК ЛИТЕРАТУРЫ
1.. Государственная фармакопея СССР./ М-во здравоохранения СССР – 11-е изд. – М.: Медицина, вып. 1-1987-С.222-224.
2. Государственная фармакопея СССР./ М-во здравоохранения СССР – 11-е изд. – М.: Медицина, вып. 2-1990-С.234-235.
3. Брель А.К. Лабораторный практикум по аналитической химии для фармацевтического факультета. Ч. 1, 2. /А.К.Брель, Л.И. Косыченко, ВМА, каф. Общ. и биоорган. химии. — Волгоград, 2003 г. 155 с.
4. Харитонов Ю.Я. Аналитическая химия. Аналитика: учебн. для вузов:
в 2 кн. Кн. 1: Общие теоретические основы. Качественный анализ / Ю.Я. Харитонов. – 2-е изд., испр. — М.: Высш. шк., 2003. – 615 с.: ил.
5. Харитонов Ю.Я. Аналитическая химия. Аналитика: учебн. для вузов:
в 2 кн. Кн. 2: Количественный анализ. Физико-химические (инструментальные) методы анализа / Ю.Я. Харитонов. –2-е изд., испр. – М.: Высш. шк., 2003. – 559 с.: ил.














2017 www.net.knigi-x.ru — «Бесплатная электронная библиотека — электронные матриалы»
Материалы этого сайта размещены для ознакомления, все права принадлежат их авторам.
Если Вы не согласны с тем, что Ваш материал размещён на этом сайте, пожалуйста, напишите нам, мы в течении 1-2 рабочих дней удалим его.
Источник