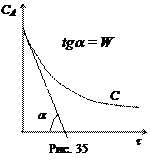Методы определения порядка реакции



Для установления порядка реакции необходимо получить экспериментальные данные, описывающие изменение концентрации реагирующих веществ с течением времени, т.е. снять кинетическую кривую 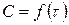
1. Метод подстановки состоит в эмпирическом подборе кинетического уравнения такого порядка, которое наилучшим образом описывает результаты эксперимента. Существует два варианта реализации метода подстановки.
1.1. Аналитический способ заключается в расчете по опытным значениям концентраций в различные моменты времени константы скорости по уравнениям для реакций различных порядков. Уравнение удовлетворительно описывает процесс, если рассчитанные по нему значения констант колеблются около какой-либо средней величины и отклонения от среднего лежат в пределах погрешности определения.
1.2. Графический способ основан на том, что зависимость концентрации от времени для реакций различных порядков в соответствующей системе координат может быть выражена прямой линией.
Так, для реакций 0-го порядка зависимость концентрации реагирующего вещества от времени имеет линейный вид (215) (рис. 34а):
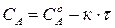
Для реакций 1-го порядка из уравнения (216) получаем прямую в системе координат 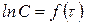

Для реакции 2-го порядка при 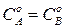
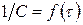
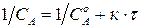
Для реакции 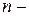
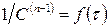
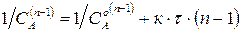
Выбирают случай, когда зависимость прямолинейная. По тангенсу угла наклона определяют значение константы скорости.
Метод подстановок точен и часто применяется на практике (не только для определения порядка реакции). Недостатком метода является его трудоемкость.
2. Метод Вант-Гоффа основан на определении абсолютной скорости реакции в начальный момент времени при двух различных исходных концентрациях реагирующего вещества (рис. 35). Тогда:
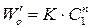
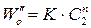
где 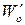
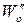
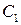
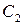
Логарифмируя уравнения, почленно вычитая их друг из друга и решая относительно 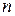

Метод Вант-Гоффа прост, точен и достаточно часто применяется на практике. Он позволяет находить не только целые, но и дробные порядки реакции.
3. Графический метод. Запишем кинетическое уравнение в виде:
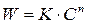
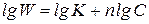
Полученное уравнение является линейным, поэтому порядок реакции 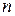
Недостаток метода заключается в необходимости графического определения абсолютной скорости реакции 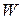
4. Метод изоляции или избытка концентраций (Оствальда) основан на исследовании зависимости скорости реакции от начальной концентрации какого-либо одного реагента. Для этого в опытах меняют начальную концентрацию одного реагента, а другие исходные вещества берут в большом избытке – тогда концентрации этих веществ можно принять постоянными. Порядок по первому реагенту определяют одним из вышеуказанных методов. Затем проводят аналогичные опыты с переменной начальной концентрацией другого исходного вещества в избытке остальных. Общий порядок реакции равен сумме порядков по отдельным компонентам.
Кроме того, известны методы определения порядка реакции по времени полупревращения вещества, метод Оствальда-Нойеса и др.
Источник
Методы определения порядка реакции



На практике исследование скорости химических реакций начинают с определения порядков этой реакции по каждому из реагирующих веществ и (или) порядка реакции в целом. Для реакции с участием нескольких веществ определить 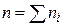
Метод изоляции или метод избытка.
Если в исследуемой реакции участвуют несколько реагирующих веществ, то общий порядок реакции 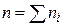

Если вещества В и С взяты в большом избытке, то при протекании реакции их концентрации практически не изменяются, т.е.
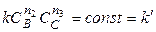
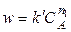
Тогда, определив порядки реакции по каждому из реагирующих веществ, можно найти общий порядок реакции:
Метод подстановки.
Этот метод заключается в том, что опытные результаты — текущие концентрации веществ в моменты времени t — последовательно подставляются в интегральные кинетические уравнения реакций нулевого (7), первого (9), второго (12 или 14) порядков и определяется, какое из уравнений дает практически постоянную величину константы скорости. Именно это уравнение и определяет порядок исследуемой реакции.
Графический вариант метода подстановки.
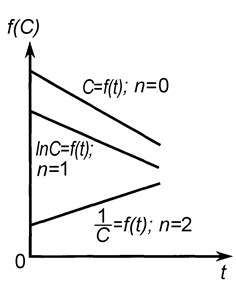
| Рис. 9. Линейные зависимости различных функций концентрации реагирующих веществ от времени. | Рис. 10. Определение порядка реакции по зависимости времени полупревращения от начальной концентрации |
Графический метод состоит в построении зависимостей различных функций концентрации от времени и определения, для какой из них наблюдается прямолинейная зависимость.
Линейные зависимости для реакций различных порядков получаются в следующих координатах (рис. 9): нулевого порядка С = f(t), первого порядка lnС = f(t), второго порядка 1/С = f(t).
Для реакций более высоких порядков выбираются координаты 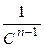
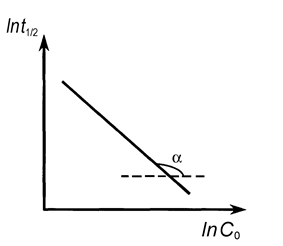
Метод определения порядка реакции по времени полупревращения.
Порядок реакции определяется на основе опытной зависимости времен полупревращения (t1/2) от начальных концентраций веществ (C0).
Как уже отмечалось, для n = 0 время полупревращения прямо пропорционально величине С0, для n = 1 — не зависит от С0, а n = 2 — обратно пропорционально С0. Для реакции любого другого порядка справедливо соотношение (20)
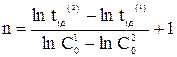
где t1/2 (1) и t1/2 (2) — время полупревращения при начальных концентрациях С01 и С02, соответственно.
Возможен графический вариант метода: по оси ординат откладываются значения ln(t1/2), а по оси абсцисс — значения lnC0 (рис. 10), тогда n = —tga + 1.
Дифференциальный метод Вант-Гоффа.
Этот метод применяют, когда в реакции участвует одно вещество, или при участии нескольких веществ, когда все вещества, кроме данного (А), взяты в большом избытке. Тогда скорость реакции равна

Прологарифмируем уравнение (21):
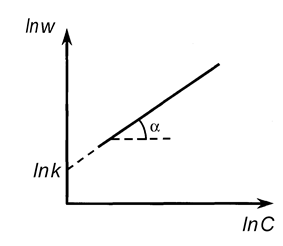
lnw = lnk + n lnС
Очевидно, что в координатах lnw- lnC мы получим линейную зависимость, причем n = tga.
Построив зависимость lnw от lnC (рис. 11), можно определить порядок реакции, равный в данном случае тангенсу угла наклона прямой (n = tga).
Рис. 11. Определение порядка реакции дифференциальным методом Вант-Гоффа.
Источник
Физическая химия
Химическая кинетика
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
1. Скорость химической реакции
Дадим определение основному понятию химической кинетики – скорости химической реакции:
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.2 Графическое определение Vист.
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
концентрации водорода, кислорода и воды изменяются в различной степени:
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD + . → еЕ + .
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
Источник