- Определение концентрации растворов щелочи различными способами
- Определение концентрации растворов щелочи различными способами
- Концентрация растворов. Способы выражения концентрации растворов.
- Способы выражения концентрации растворов.
- Аналитическая химия
- Работа 2. Определение щелочи в растворе неизвестной концентрации
- Работа 2. Определение щелочи в растворе неизвестной концентрации
- Оглавление
- 2.1 Определение методом пипетирования
- 2.2 Определение методом отдельных навесок
Определение концентрации растворов щелочи различными способами
Для установления концентрации растворов едкого натра и едкого кали в качестве исходных веществ применяют кристаллогидрат щавелевой кислоты H2C2O4•2H2O, янтарную кислоту H2C4H4O4, сульфаминовую кислоту HSO3NH2 или титрованные растворы соляной и серной кислот (последние обычно используют для проверки концентрации растворов едких щелочей).
Концентрацию растворов гидроокиси бария или кальция и щелочной смеси устанавливают по титрованному раствору соляной кислоты. Для определения концентрации 0,1 н. растворов едкого натра или едкого кали удобно пользоваться растворами щавелевой или соляной кислот, приготовленными из фиксаналов. Для приготовления раствора щавелевой кислоты применяют дистиллированную воду, не содержащую углекислого газа.
Титрование раствора щелочи раствором щавелевой кислоты ведут в присутствии 2—3 капель 0,1%-ного раствора фенолфталеина до обесцвечивания розовой окраски раствора.
Титрование раствора щелочи соляной кислотой ведут вначале в присутствии фенолфталеина, а после исчезновения розовой окраски добавляют 1—2 капли раствора метилового оранжевого и титруют до перехода желтой окраски раствора в оранжево-розовую.
Концентрацию раствора щелочи вычисляют по формулам:
по метиловому оранжевому:
где V1 — объем раствора кислоты, израсходованный на титрование с фенолфталеином;
V2 — суммарный объем раствора кислоты, израсходованный на титрование с фенолфталеином и метиловым оранжевым.
Разница в концентрации, установленной по фенолфталеину и метиловому оранжевому, указывает на загрязнение щелочи карбонатами. Эта разница не должна превышать 0,4%.
При установлении или при проверке концентрации раствора щелочи по раствору кислоты нормальные концентрации этих растворов должны быть близкими. В противном случае один из растворов (более концентрированный) перед титрованием разбавляют в мерной колбе.
При использовании титрованного раствора щелочи результаты анализа рассчитывают по концентрации щелочи, полученной при установлении титра ее с тем индикатором, который применяют при анализе.
Для определения концентрации раствора едкой щелочи по янтарной кислоте обычно пользуются методом титрования навесок янтарной кислоты. Эквивалент янтарной кислоты равен 59,05.
Пример 1. На титрование 15,00 мл раствора едкого натра израсходовано 16,20 мл 0,1000 н. раствора щавелевой кислоты (средний сходящийся результат титрования). Определить нормальную концентрацию раствора щелочи.
Нормальная концентрация раствора едкого натра:
0,1 • 16,2 / 15 = 1070 н.
Пример 2. На титрование 25,00 мл раствора едкого натра с фенолфталеином было израсходовано 24,80 мл 0,1000 н. раствора соляной кислоты, затем был добавлен раствор метилового оранжевого, после чего титрование продолжено.
При этом суммарный объем израсходованной соляной кислоты равен 24,88 мл. Определить нормальную концентрацию раствора щелочи и ее пригодность для анализа.
Нормальная концентрация едкого натра по фенолфталеину:
0,1 • 24,8 / 25 = 0,09920 н.
Нормальная концентрация едкого натра по метиловому оранжевому:
0,1 • 24,88 / 25 = 0,09952 н.
Разность концентраций в %:
(24,88 — 24,8) • 100 / 24,88 = 0,32 %,
т. е. меньше предельно допустимого. Раствор щелочи пригоден как рабочий раствор для анализа.
Пример 3. Определить массу отдельной навески янтарной кислоты для установления концентрации 0,1 н. раствора щелочи, если для титрования применяют бюретку емкостью 25 мл.
Предполагаем израсходовать на титрование 20 мл раствора щелочи.
Масса навески янтарной кислоты:
59,05 • 0,1 • 20 / 1000 = 0,12 г.
Пример 4. Навеска янтарной кислоты 1,064 г оттитрована 35,50 мл раствора едкого натра. Определить нормальную концентрацию раствора.
1000 • 1,064 / 59,05 • 35,5 = 0,5070 н.
Растворы щелочей хранят в склянках, закрытых резиновыми (кроме растворов аммиака) или полиэтиленовыми пробками. Для раствора аммиака обычно применяют стеклянные пробки. Если склянка для хранения сообщается с бюреткой, то в пробку вставляют хлоркальциевую трубку, заполненную натровой (натронной) известью для поглощения углекислоты воздуха.
При длительном хранении растворов щелочей внутреннюю поверхность склянок парафинируют.
Источник
Определение концентрации растворов щелочи различными способами
Цель: определение возможности замены мерной пипетки на мерный цилиндр в студенческом лабораторном практикуме по химии для упрощения лабораторной работы по определению концентрации щелочи титрованием.
В работе использовался метод кислотно-основного титрования, основанный на применении реакции нейтрализации
2NaOH + H2SO4 = Na2SO4 + 2H2O.
К раствору определяемого вещества – гидроксида натрия – постепенно прибавляли раствор серной кислоты известной концентрации до тех пор, пока его количество не становилось эквивалентным количеству гидроксида натрия, вступившего в реакцию, т.е. до нейтрализации щёлочи. Момент нейтрализации устанавливали по изменению окраски индикатора, прибавляемого в титруемый раствор.
Молярную концентрацию эквивалента щелочи определяли из закона эквивалентов по уравнению
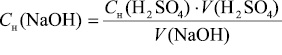
где Сн(NaOH) и Сн(H2SO4) – молярные концентрации эквивалента NaОН и H2SO4 в реагирующих растворах, моль/л; V(NaOH) и V(H2SO4) – объёмы реагирующих растворов щёлочи и кислоты, мл.
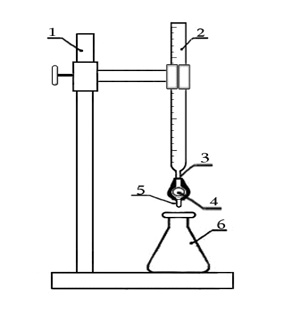
Для титрования использовалась установка, изображенная на рисунке.
Установка для титрований: 1 – штатив; 2 – бюретка; 3 – резиновая трубка; 4 – олива; 5 – носик бюретки; 6 – колба
Провели 10 параллельных опытов. Результаты титрований занесены в табл. 1.
Результаты титрования раствора гидроксида натрия
Объём пробы раствора щёлочи V(NaOH), мл
Объём раствора кислоты V(H2SO4), мл
Молярная концентрация эквивалента щёлочи
Среднее значение молярной концентрации эквивалента NaOH в анализируемом растворе, моль/л
Источник
Концентрация растворов. Способы выражения концентрации растворов.
Концентрация раствора может выражаться как в безразмерных единицах (долях, процентах), так и в размерных величинах (массовых долях, молярности, титрах, мольных долях).
Концентрация – это количественный состав растворенного вещества (в конкретных единицах) в единице объема или массы. Обозначили растворенное вещество — Х, а растворитель — S. Чаще всего использую понятие молярности (молярная концентрация) и мольной доли.
Способы выражения концентрации растворов.
1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:

ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:

C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m:

С (x) – моляльность, моль/кг;
n – количество растворенного вещества, моль;
4. Титр – содержание вещества в граммах в 1 мл раствора:

T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе:

N – мольная доля растворённого вещества;
n – количество растворённого вещества, моль;
nр-ля – количество вещества растворителя, моль.
Сумма мольных долей должна равняться 1:
Иногда при решении задач необходимо переходить от одних единиц выражения к другим:
ω(X) — массовая доля растворенного вещества, в %;
М(Х) – молярная масса растворенного вещества;
ρ= m/(1000V) – плотность раствора. 6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора.
Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту.
Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.

СН – нормальная концентрация, моль-экв/л;
z – число эквивалентности;
Растворимость вещества S — максимальная масса вещества, которая может раствориться в 100 г растворителя:
Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя:
Источник
Аналитическая химия
Работа 2. Определение щелочи в растворе неизвестной концентрации
Работа 2. Определение щелочи в растворе неизвестной концентрации
Оглавление
2.1 Определение методом пипетирования
Научиться использовать теоретические основы метода кислотно-основного титрования для определения концентрации вещества в растворе.
Определить количество гидроксида натрия в растворе.
Раствор гидроксида натрия, раствор НСl с известной концентрацией, дистиллированная вода, индикатор метиловый оранжевый.
Стандартизированный раствор хлороводородной кислоты служит для определения содержания (или) концентрации щелочей в растворах. Определение аналогично установлению молярной концентрации кислоты по тетраборату натрия.
Реакция титрования протекает согласно уравнению:
NaOH + HCl = NaCl + H2O
В мерную колбу вместимостью 250 мл возьмите для анализа немного раствора NаОН. Доведите объем раствора до метки и тщательно перемешайте.
Подготовьте бюретку для титрования щелочи кислотой. Промойте пипетку анализируемым раствором щелочи. Затем по 10 мл исследуемого раствора перенесите пипеткой в три конические колбы для титрования. В каждую колбу добавьте 1-2 капли метилового оранжевого и титруйте раствором кислоты до перехода от одной капли желтой окраски индикатора в бледно-розовую.
Таблица 1. Результаты эксперимента.
1-2 капли метилового оранжевого
Титрование повторяют до трех сходящихся результатов. Молярную концентрацию раствора гидроксида натрия рассчитывают по формуле:
Содержание гидроксида натрия в граммах (m) рассчитывается как
2.2 Определение методом отдельных навесок
Цель работы: изучить теоретические основы титрования слабого электролита сильным электролитом, применение способа отдельных навесок для определения концентрации титрантов.
Умения и навыки: уметь рассчитать рН в точке стехеометричности при титровании слабой кислоты сильным основанием, выбрать индикатор, провести обработку результатов по способу отдельных навесок, освоить и закрепить методические приемы работы.
Определить массу едкого натра, растворенного в мерной колбе, путем проведения титрования отдельных навесок щавелевой кислоты раствором едкого натра. Вычислить абсолютную и относительную погрешность (ошибку) определения.
Оборудование и реактивы:
Бюретка, колбы для титрования, штатив металлический; щавелевая кислота Н2С2О4 *2Н2О кристаллическая, фенолфталеин 0,1% раствор, раствор едкого натра в колбе (выдается).
Теоретическая часть
При титровании происходит реакция согласно уравнению:
В точке стехиометричности (эквивалентности) рН определяется присутствием оксалата натрия.
рОН = 1/2*9,77-1/2 lg 0,1 = 5,38;
Для титрования используют фенолфталеин, интервал перехода которого рН = 8,2-10,0
Задача: рассчитать массу навески щавелевой кислоты Н2С2О4 *2Н2О, необходимой для определения щелочи в растворе, чтобы на титрование ее расходовался раствор едкого натра с концентрацией 0,1 моль/л в объеме примерно 10 мл.
Найти: Формулы и уравнения:
Дано: ν = с*V; ν = m/М;
с (NaOH) = 0,1 моль/л
На аналитических весах берут навеску щавелевой кислоты массой в 3-4 раза большую, чем теоретически рассчитанная.
В три конические колбы для титрования (должны быть пронумерованы) отсыпают примерно по 1/3 или 1/4 взятой навески в каждую колбу, взвешивая после каждого отсыпания массу бюкса с остатками навески, записывая эти данные в таблицу. По разности массы бюкса с навеской и массы бюкса с навеской после отсыпания вычисляют массу навески кислоты в каждой колбе для титрования. Каждую навеску растворяют в воде примерно одинакового объема, произвольно (V≈10мл). В каждую колбу добавляют индикатор фенолфталеин, в объеме 2 капель.
Готовят бюретку для титрования (ополаскивают раствором титранта, удаляют воздух из кончика, устанавливают уровень раствора на 0). Титруют едким натром до появления слабой розовой окраски фенолфталеина, устойчивой в течение 30 сек от одной капли щелочи. Титрование начинают с навески меньшей массы.
Источник