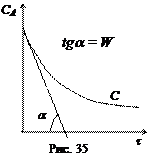Физическая химия
Химическая кинетика
Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных условиях химического процесса, а также его энергетический эффект. Однако термодинамика не может ответить на вопросы о том, как осуществляется данный процесс и с какой скоростью. Эти вопросы – механизм и скорость химической реакции – и являются предметом химической кинетики.
1. Скорость химической реакции
Дадим определение основному понятию химической кинетики – скорости химической реакции:
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Первое определение является наиболее строгим; из него следует, что скорость химической реакции можно также выражать как изменение во времени любого параметра состояния системы, зависящего от числа частиц какого-либо реагирующего вещества, отнесенное к единице объема или поверхности – электропроводности, оптической плотности, диэлектрической проницаемости и т.д. и т.п. Однако наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций (здесь и далее рассматриваются только односторонние реакции) очевидно, что концентрации исходных веществ во времени постоянно уменьшаются (ΔСисх 0). Скорость реакции считается положительной, поэтому математически определение средней скорости реакции в интервале времени Δt записывается следующим образом:
В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая (рисунок 2.1).
Рис. 2.1 Кинетические кривые для исходных веществ (А) и продуктов реакции (В).
Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой (рис. 2.2); истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
Рис. 2.2 Графическое определение Vист.
Необходимо отметить, что в том случае, если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение концентрации какого реагента определялось. Очевидно, что в реакции
концентрации водорода, кислорода и воды изменяются в различной степени:
Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и т.д.
Одной из задач, стоящих перед химической кинетикой, является определение состава реакционной смеси (т.е. концентраций всех реагентов) в любой момент времени, для чего необходимо знать зависимость скорости реакции от концентраций. В общем случае, чем больше концентрации реагирующих веществ, тем больше скорость химической реакции. В основе химической кинетики лежит т. н. основной постулат химической кинетики:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в некоторых степенях.
Т. е. для реакции
аА + bВ + dD + . → еЕ + .
Коэффициент пропорциональности k есть константа скорости химической реакции. Константа скорости численно равна скорости реакции при концентрациях всех реагирующих веществ, равных 1 моль/л.
Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Очевидно, что для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции (в уравнении (II.4) соответственно x, y и z) есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий порядок реакции. Следует подчеркнуть, что порядок реакции определяется только из экспериментальных данных и не связан со стехиометрическими коэффициентами при реагентах в уравнении реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
Источник
Методы расчета константы скорости реакции



Зная порядок реакции, можно рассчитать константу скорости и сделать предположение относительно механизма протекания реакции. Рассмотрим наиболее часто используемые способы определения порядка.
1. Способ подстановки. Экспериментальные результаты поочерёдно подставляют в уравнения константы скорости реакции различных порядков. Если использование одного из этих уравнений даёт постоянную величину константы скорости, реакция имеет соответствующий порядок. Если одинаковые значения не получаются, то реакция имеет дробный порядок или сложный характер.
2. Графический способ. Используя графический метод, уравнение константы скорости реакции приводят к линейному виду и строят график зависимости соответствующей функции концентрации от времени в различных координатах (СA–τ; lnCA–τ; 1/CA–τ; 1/C 2 A–τ). Там, где получилась прямая, таков и порядок реакции. По углу наклона прямой к оси ординат определяют значение константы скорости реакции. По длине отрезка, отсекаемого прямой на оси ординат, – начальные концентрации реагирующих веществ.
Рис. Зависимость функций концентрации исходных веществ от времени для реакций:
а) первого; б) второго; в) третьего порядков.
3. Способ Оствальда-Нойеса. Основан на определении прядка реакции по периоду полупревращения. Для реакции n-го порядка было получено выражение
Логарифмируя это выражение, имеем: lg(τ1/2) = lgA – (n–1)lgC.
Отсюда следует, что зависимость логарифма периода полупревращения от логарифма начальной концентрации вещества представляет собой прямую линию, для которой tg α = (n–1). Отсюда n =1 – tg α.
4.Способ Вант-Гоффа. Необходимо знать две скорости реакции при двух различных концентрациях веществ. v1 = kCA1 n и v2 = kCA2 n . Тогда
| Прологарифмируем: | 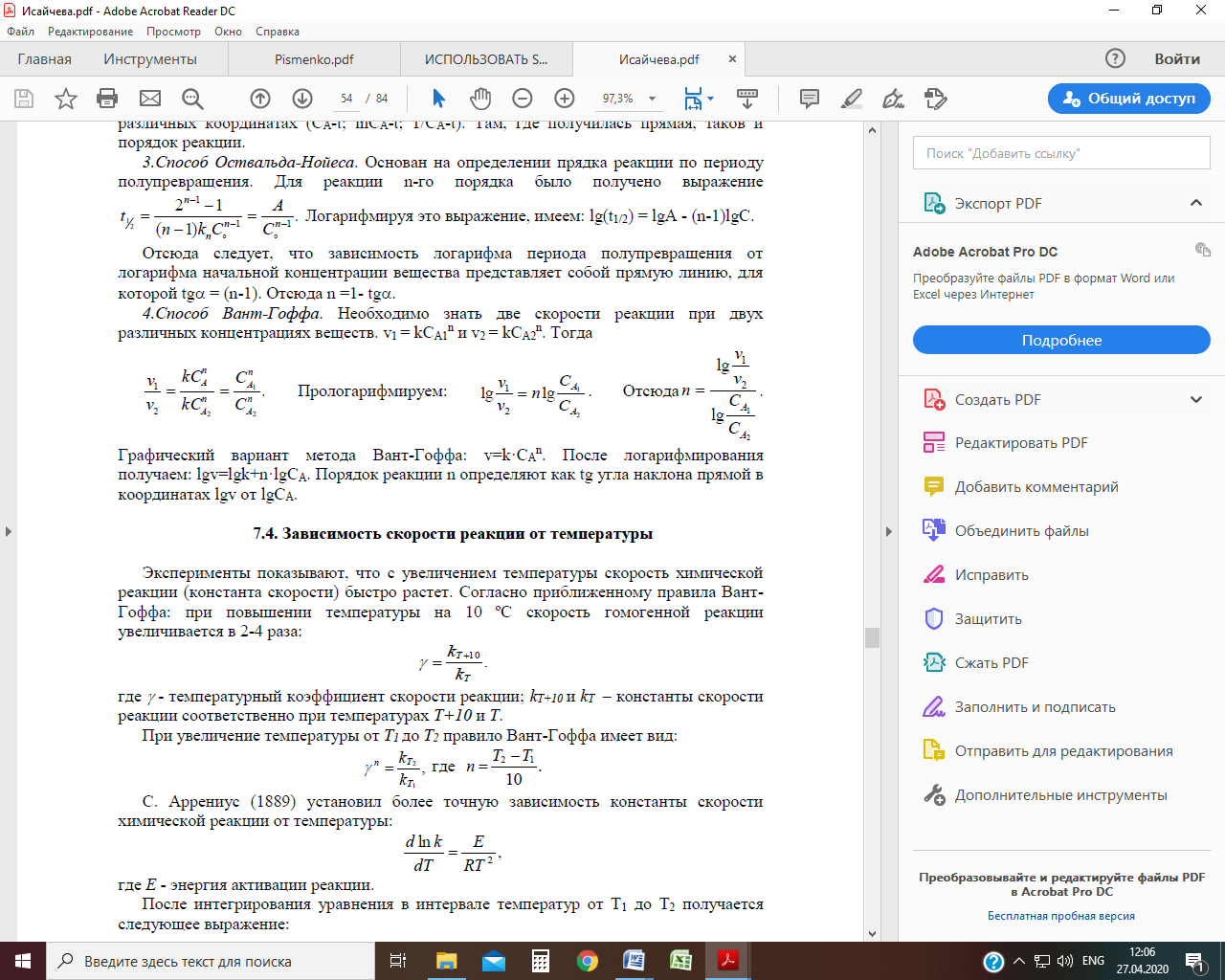 |
| Отсюда |  |
Графический вариант метода Вант-Гоффа: v=k·CA n . После логарифмирования получаем: lgv=lgk+n·lgCA. Порядок реакции n определяют как tg угла наклона прямой в координатах lgv – lgCA.
Источник
Методы определения порядка реакции



Для установления порядка реакции необходимо получить экспериментальные данные, описывающие изменение концентрации реагирующих веществ с течением времени, т.е. снять кинетическую кривую 
1. Метод подстановки состоит в эмпирическом подборе кинетического уравнения такого порядка, которое наилучшим образом описывает результаты эксперимента. Существует два варианта реализации метода подстановки.
1.1. Аналитический способ заключается в расчете по опытным значениям концентраций в различные моменты времени константы скорости по уравнениям для реакций различных порядков. Уравнение удовлетворительно описывает процесс, если рассчитанные по нему значения констант колеблются около какой-либо средней величины и отклонения от среднего лежат в пределах погрешности определения.
1.2. Графический способ основан на том, что зависимость концентрации от времени для реакций различных порядков в соответствующей системе координат может быть выражена прямой линией.
Так, для реакций 0-го порядка зависимость концентрации реагирующего вещества от времени имеет линейный вид (215) (рис. 34а):
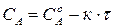
Для реакций 1-го порядка из уравнения (216) получаем прямую в системе координат 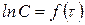

Для реакции 2-го порядка при 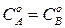
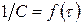
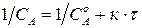
Для реакции 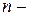
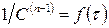
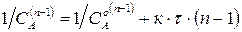
Выбирают случай, когда зависимость прямолинейная. По тангенсу угла наклона определяют значение константы скорости.
Метод подстановок точен и часто применяется на практике (не только для определения порядка реакции). Недостатком метода является его трудоемкость.
2. Метод Вант-Гоффа основан на определении абсолютной скорости реакции в начальный момент времени при двух различных исходных концентрациях реагирующего вещества (рис. 35). Тогда:
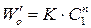
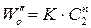
где 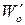
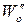
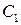
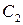
Логарифмируя уравнения, почленно вычитая их друг из друга и решая относительно 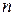

Метод Вант-Гоффа прост, точен и достаточно часто применяется на практике. Он позволяет находить не только целые, но и дробные порядки реакции.
3. Графический метод. Запишем кинетическое уравнение в виде:
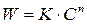
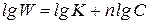
Полученное уравнение является линейным, поэтому порядок реакции 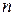
Недостаток метода заключается в необходимости графического определения абсолютной скорости реакции 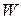
4. Метод изоляции или избытка концентраций (Оствальда) основан на исследовании зависимости скорости реакции от начальной концентрации какого-либо одного реагента. Для этого в опытах меняют начальную концентрацию одного реагента, а другие исходные вещества берут в большом избытке – тогда концентрации этих веществ можно принять постоянными. Порядок по первому реагенту определяют одним из вышеуказанных методов. Затем проводят аналогичные опыты с переменной начальной концентрацией другого исходного вещества в избытке остальных. Общий порядок реакции равен сумме порядков по отдельным компонентам.
Кроме того, известны методы определения порядка реакции по времени полупревращения вещества, метод Оствальда-Нойеса и др.
Источник