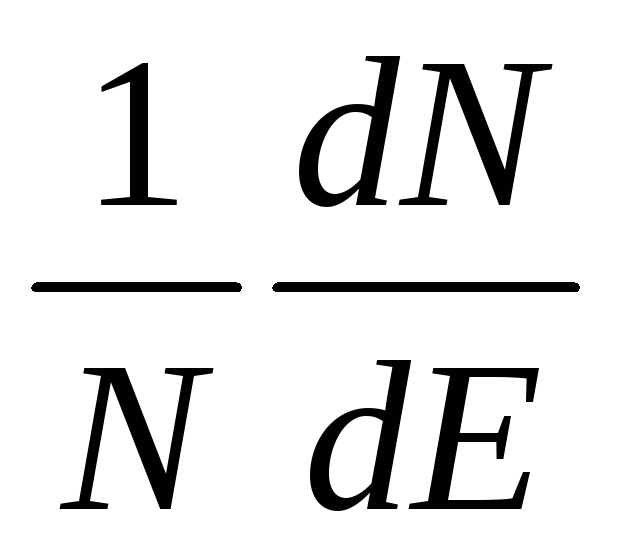- Методы определения энергии активации:
- Лекция 4 теория соударений
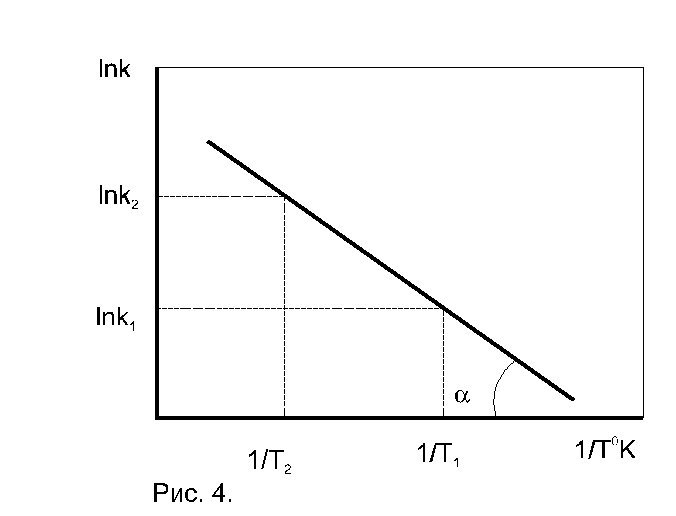
- Определение энергии активации графическим способом
- 1 Область применения
- 2 Нормативные ссылки
- 3 Термины и определения
- 4 Сущность метода
- 5 Аппаратура и материалы*
- 6 Калибровка по массе и температуре
- 7 Образцы для испытания
- 8 Проведение испытания
- 9 Обработка результатов
Методы определения энергии активации:
По экспериментальным значениям константы скорости реакции: Графический метод (рис. 4):
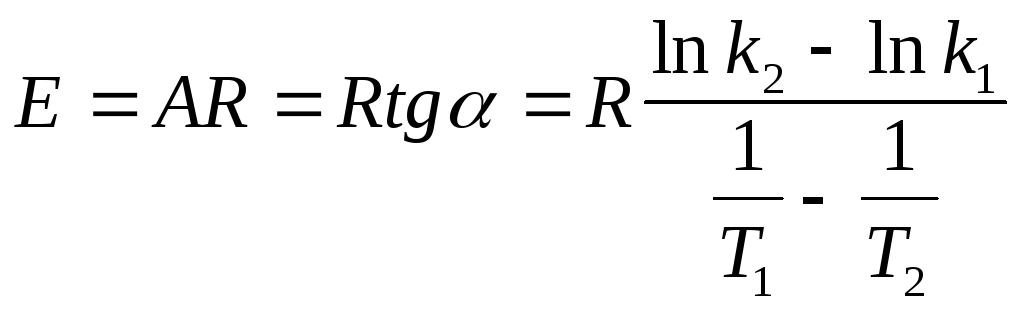
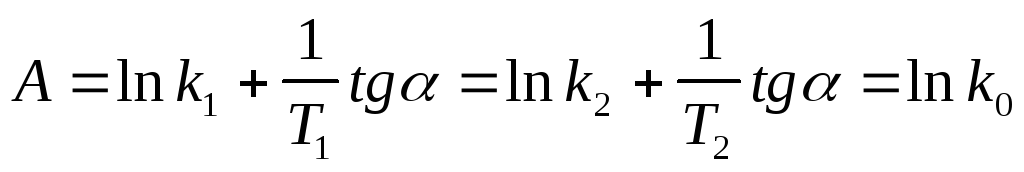
где k0 = k при Т = 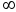
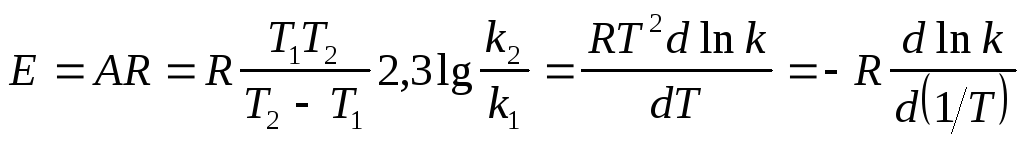
Относительный температурный коэффициент константы скорости реакции:
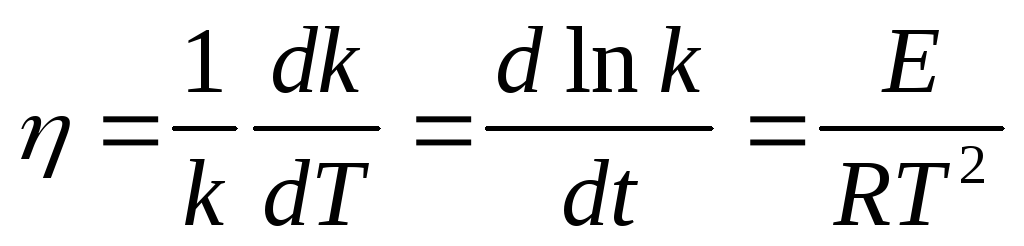
Коэффициент зависит от температуры и поэтому пригоден лишь для сравнительной оценки и ориентировочных расчетов в небольших интервалах температур.
Было сделано много попыток рассчитать теоретически энергию активации. Выдвинуты две основные теории: теория соударений и теория активированного комплекса.
Лекция 4 теория соударений
В 1918г. Льюис предположил, что для протекания реакции А + В = АВ должны столкнуться две молекулы А и В. Поэтому, зная число столкновений, можно, казалось бы, рассчитать скорость химической реакции. Однако если сравнить расчетное число соударяющихся молекул с числом реагирующих молекул, которое определяется экспериментально, то обнаруживаются два противоречия. Во-первых, число соударений примерно в 10 17 раз больше числа реагирующих молекул, т.е. из каждых 10 17 соударений только одно соударение является эффективным в осуществлении реакции. Во-вторых, в то время как при повышении температуры на 10 0 С число бинарных столкновений увеличивается примерно на 2%, скорость химической реакции возрастает на 200-300%.
Эти противоречия были разрешены при допущении, что реакция происходила только в том случае, если соударяющиеся молекулы обладали некоторой избыточной энергией; все остальные соударения неэффективны и не приводят к химической реакции, т.е. скорость реакции равна общему числу соударений, умноженному на долю эффективных соударений. Это допущение опиралось на изучение: 1) распределения скоростей реагирующих молекул и 2) влияния температуры.
Закон распределения скоростей. Все молекулы газа движутся с различными скоростями из-за частых соударений. Между молекулами постепенно происходит взаимообмен количеством движения и, следовательно, их скорости изменяются: одни молекулы увеличивают свою скорость, другие – уменьшают. Математический закон, которому подчиняется распределение скоростей и энергий, был найден Максвеллом и Больцманом в 1860г. Согласно этому закону, доля N/N молекул, обладающих большими скоростями, чем средняя скорость и , или кинетической энергией, превышающей величину ½ mи 2 , составляет:
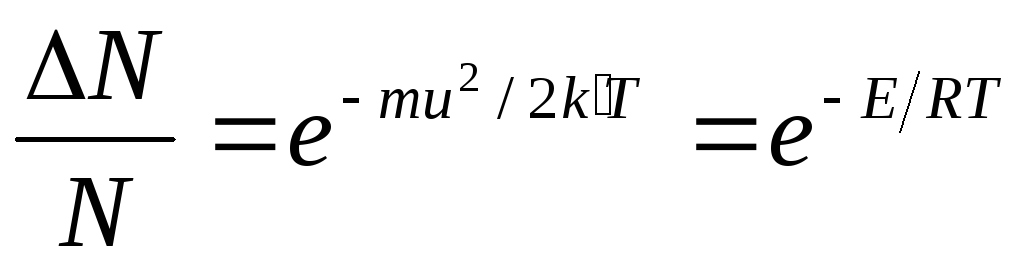
где k’ – константа Больцмана; u — средняя квадратичная скорость, см/с.
В дифференциальной форме это уравнение имеет вид:
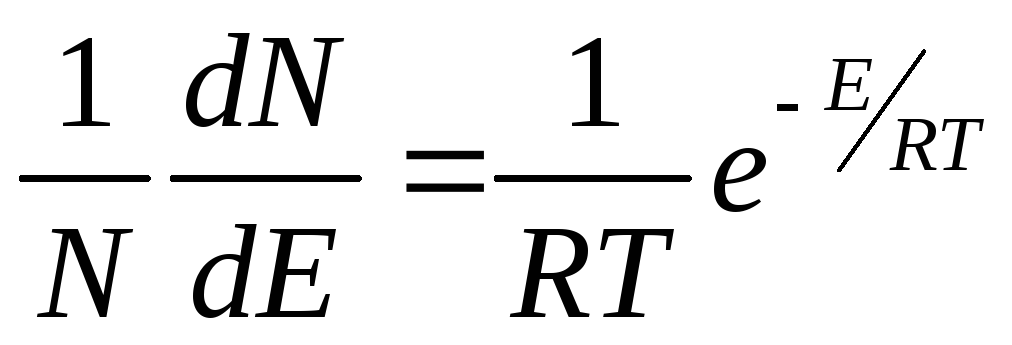
где R — универсальная газовая постоянная, эрг; Т — температура газа, К.
На рисунке 3 представлен график, построенный по уравнению (45). Доля молекул, энергия которых лежит в пределах определенного интервала, изображается площадью столбика, ограниченного кривой и соответствующими ординатами.
Рисунок 3. Распределение энергии по Максвеллу-Больцману.
В результате соударений всегда имеется несколько молекул с энергиями, намного превосходящими среднее значение. Таким образом, возможны столкновения между молекулами, имеющими высокую энергию активации, необходимую для реакции, но число таких соударений будет составлять очень небольшую долю от общего числа столкновений, происходящих в газе. Это объясняет тот факт, что лишь небольшая часть соударений приводит к реакции.
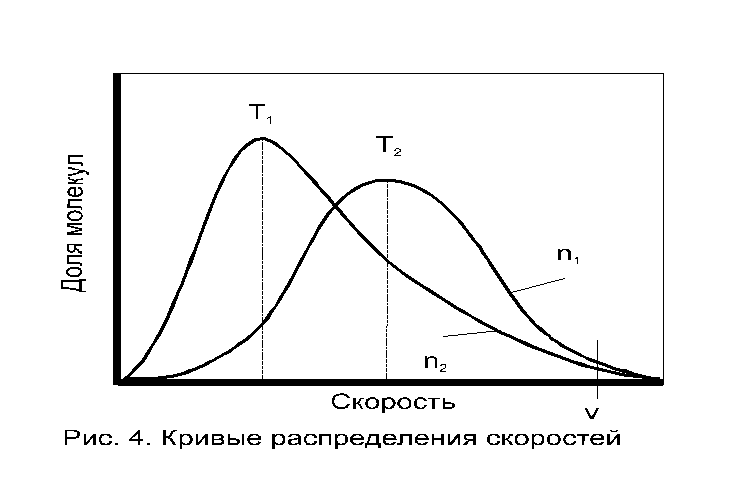
Влияние температуры на распределение скорости (см. Рис. 5.). С ростом температуры наблюдается смещение максимума в сторону более высокой скорости; происходит резкое увеличение числа молекул, имеющих скорости намного выше средней [при скорости имеется число (доля) молекул n1, при температуре Т1, которое увеличивается до n2 при температуре Т2, T2 > T1]. Общее число молекул, имеющих скорости, равные или большие определенного значения определяются площадью под кривой. Но именно небольшая доля молекул n1 и n2 при температурах Т1 и Т2 в конце кривых распределения, обладающих максимальными энергиями и скоростями в сечениях и будет определять эффективную долю столкновений, приводящих к их взаимодействию.
Экспоненциальный фактор в уравнении Максвелла учитывает изменение формы кривой при повышении температуры. Если 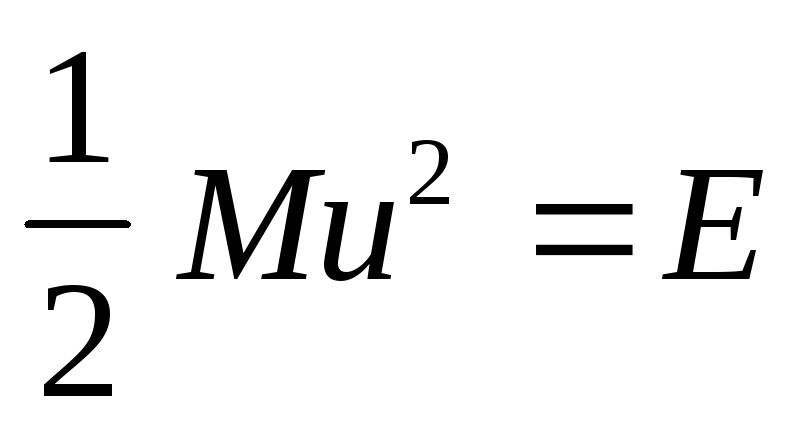
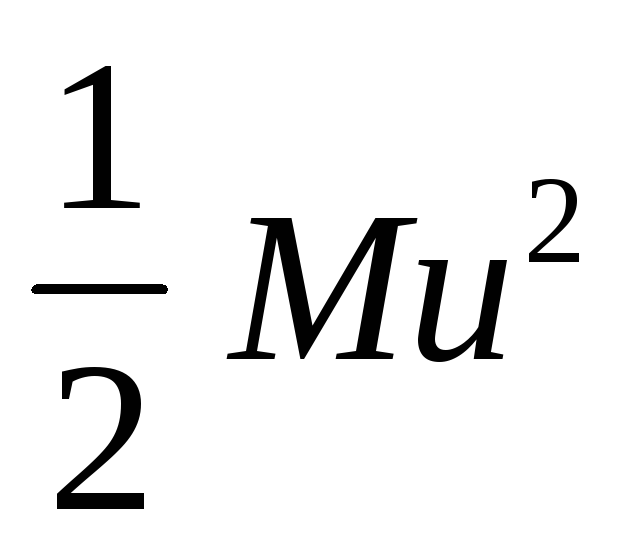
Источник
Определение энергии активации графическим способом
ГОСТ Р 56722-2015
(ИСО 11358-2:2014)
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Определение энергии активации
Plastics. Thermogravimetry of polymers. Part 2. Determination of activation energy
Дата введения 2017-01-01
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт авиационных материалов», Государственным научным центром Российской Федерации совместно с Открытым акционерным обществом «НПО Стеклопластик», Объединением юридических лиц «Союз производителей композитов» и Открытым акционерным обществом «Институт пластических масс имени Г.С.Петрова» на основе аутентичного перевода на русский язык указанного в пункте 4 международного стандарта, который выполнен ФГУП «СТАНДАРТИНФОРМ»
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 230 «Пластмассы, полимерные материалы, методы их испытаний»
4 Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 11358-1:2014* «Пластмассы. Термогравиметрия (ТГ) полимеров. Часть 2. Определение энергии активации» (ISO 11358-2:2014 «Plastics — Thermogravimetry (TG) of polymers — Part 2: Determination of activation energy») путем изменения отдельных слов и фраз, а также невключения отдельных структурных элементов, ссылок и/или дополнительных элементов. Для учета потребностей национальной экономики Российской Федерации из стандарта исключена ссылка на международный стандарт ИСО 472 «Пластмассы. Словарь» (Plastics — Vocabulary).
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. — Примечание изготовителя базы данных.
Дополнительные слова, фразы, показатели, включенные в текст настоящего стандарта для учета потребностей национальной экономики Российской Федерации, выделены курсивом*
* В бумажном оригинале обозначения и номера стандартов и нормативных документов выделены курсивом, за исключением отмеченного в разделе «Предисловие» знаком «**». — Примечание изготовителя базы данных.
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в ГОСТ Р 1.0-2012 (раздел 8). Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
1 Область применения
Настоящий стандарт устанавливает метод определения энергии активации E в формуле Аррениуса для процесса термического (термоокислительного) разложения полимеров с применением термогравиметрии (ТГ). Метод применим только для одностадийного процесса. Для многостадийных процессов метод применим в том случае, если они состоят из четко разделенных одностадийных реакций.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 9293-74 (ИСО 2435-73) Азот газообразный и жидкий. Технические условия
ГОСТ Р 56721-2015 Пластмассы. Термогравиметрия полимеров. Часть 1. Общие принципы (ИСО 11358-1:2014, MOD)
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ Р 56721, а также следующие термины с соответствующими определениями:
3.1 формула Аррениуса: Формула, отражающая зависимость константы скорости реакции от температуры.
Примечание — Константу скорости реакции рассчитывают по формуле
k=Ae
где k — константа скорости реакции, равная (d /dt), с ;
A — предэкспоненциальный множитель, с ;
E — энергия активации, Дж·моль ;
R — газовая постоянная, равная 8,314 Дж·К моль ;
T — абсолютная температура, К.
3.2 энергия активации (E ), Дж моль : Энергия, превышающая энергию основного состояния, которая должна быть добавлена к атомной или молекулярной системе, чтобы мог произойти конкретный процесс.
3.3 степень превращения : Масса продуктов реакции, присутствующих в конкретный момент времени и при конкретной температуре, отнесенная к массе продуктов в конце реакции.
1 Степень превращения определяют по формуле

где M — исходная масса образца, мг;
M — масса образца в конкретный момент времени и при конкретной температуре, мг;
M — масса образца в конце реакции, мг.
2 Для многостадийных реакций степень превращения вычисляют отдельно для каждой стадии.
3 Степень превращения — безразмерная величина, ее значение изменяется от 0 до 1.
4 Сущность метода
Нагревают образцы для испытания при нескольких различных скоростях нагревания и измеряют изменение массы в зависимости от температуры. Определяют температуры, соответствующие заданным степеням превращения для каждой скорости нагревания. Для заданной степени превращения строят график зависимости логарифма скорости нагревания от обратной величины абсолютной температуры и рассчитывают энергию активации по наклону полученной таким образом прямой линии.
5 Аппаратура и материалы*
* В бумажном оригинале слова «и материалы» в наименовании раздела 5 выделены курсивом. — Примечание изготовителя базы данных.
6 Калибровка по массе и температуре
6.1 Калибровка по массе
6.2 Калибровка по температуре
7 Образцы для испытания
Образцы для испытания могут быть в форме порошка, гранул, хлопьев, нитей или пленки. При необходимости образцы для испытания готовят путем резки материала до размера, соответствующего прибору (см. ГОСТ Р 56721). Частицы малого размера, т.е. имеющие высокое соотношение площади поверхности к объему, являются предпочтительными. Для уменьшения размера частиц можно использовать измельчение в мельнице с жидким азотом.
8 Проведение испытания
8.1 Общие положения
Проводят испытание при трех или более скоростях нагрева, используя образцы, отличающиеся по массе не более чем на ±1%. Низшая и высшая скорости нагрева должны отличаться друг от друга не менее чем в 5 раз.
Для повышения точности определения записывают массу пустого тигля, который предварительно нагревают в тех же атмосферных условиях, при тех же скоростях потока газа и нагрева, которые будут использоваться при испытании образца. Если в процессе испытания происходит изменение массы пустого тигля (которое обычно связывают с выталкивающей силой), вычитают кривую, полученную для пустого тигля из кривой, полученной для испытуемого образца, и получают скорректированную ТГ кривую для образца.
Испытание повторяют для всех скоростей нагрева. Скорректированные кривые используют для анализа результатов.
Примечание — Рекомендуется использовать образцы массой менее 10 мг и скорости нагрева менее 10 K·мин . Для образцов массой более 10 мг и скоростей нагрева более 10 K·мин температура образца может не соответствовать требуемому температурному профилю.
8.2 Неокислительные реакции
Для предотвращения окисления образца во время испытания, если необходимо, поддерживают атмосферу инертного газа или азота. Используют только очищенный газ (чистотой не менее 99,95%).
Рекомендуется применять азот по ГОСТ 9293 повышенной чистоты, допускается применение технического азота по ГОСТ 9293 с применением осушителя, рекомендованного изготовителем прибора.
8.3 Окислительные реакции
При испытании полимеров, которые подвергаются окислительным реакциям, используют атмосферу окислительного газа (кислорода или воздуха). Данные о виде и чистоте используемого газа включают в протокол испытания.
9 Обработка результатов
9.1 Графическое представление
Полученные термогравиметрические данные представляют в виде кривой зависимости изменения массы или изменения массы в процентах от температуры. Характерные температуры определяют из ТГ кривой в соответствии с ГОСТ Р 56721.
9.2 Определение энергии активации
Проверяют, что конечная масса, достигнутая в конце каждого измерения, постоянна, что указывает на завершение реакции, и что процентное изменение массы от начала измерения до его конца для каждой скорости нагревания одинаково.
Для данной степени превращения по ТГ кривым определяют абсолютные температуры для каждой скорости нагревания . Повторяют определение для других степеней превращения. Типичные кривые показаны на рисунке 1.
Рисунок 1 — Определение абсолютной температуры для данной степени превращения и скорости нагревания
Приближенное соотношение, приведенное в формуле (3), было получено Озава и позднее — Флинном и Воллом [1] и [2] и используется для определения энергии активации E .
Источник