Практическая работа №6. Получение, собирание и распознавание газов. —
Вариант 1.
Опыт 1. Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в нее 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43) и наденьте на кончик трубки еще одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4. Опишите, как можно распознать водород.
Ответ:
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1-2 гранулы цинка и прилили в нее 1-2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки еще одну пробирку, подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Сняли пробирку с водородом и не переворачивая ее поднесли к горящей спиртовке. Чистый водород взрывается с глухим хлопком.
Опыт 2. Получение, собирание и распознавание аммиака
Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Вопросы и задания
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
3. Опишите не менее двух способов распознавания аммиака.
Ответ:
Собрали прибор для получения аммиака и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объемом по 1 ложечке для окисления веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли ее пробкой и укрепили на лапке штатива. На газоотводную трубку надели сухую пробирку для собирания аммиака. Пробирку со смесью хлорида аммония и гидроксида кальция нагрели.
Вариант 2.
Опыт 1. Получение, собирание и распознавание кислорода
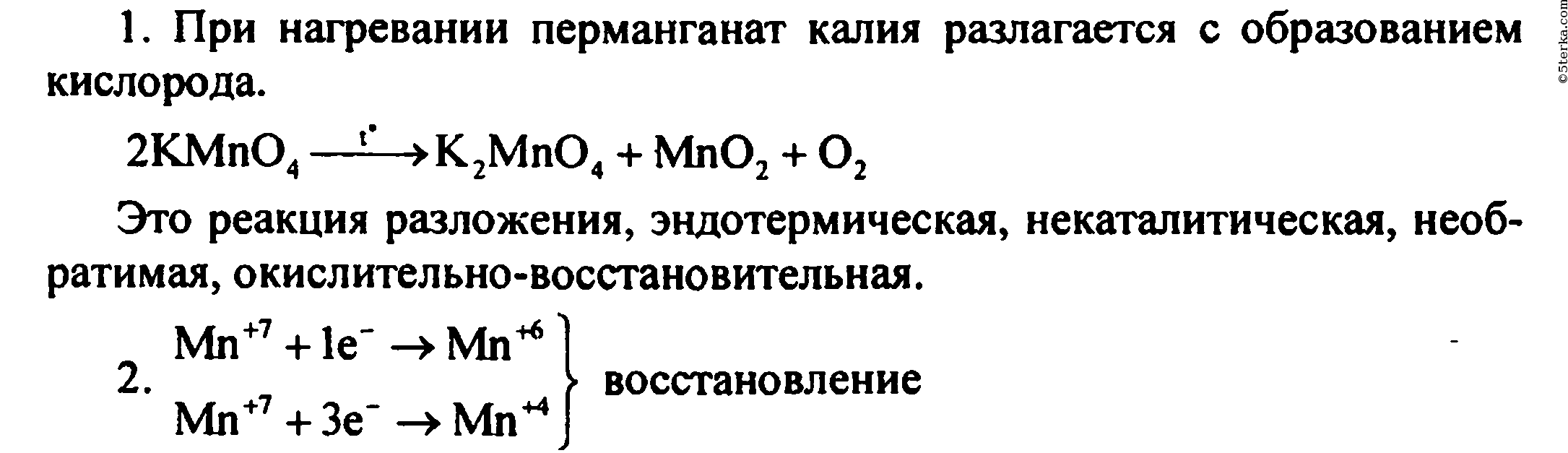
Соберите прибор, как показано на рисунке 114, и проверьте его на герметичность. В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
Вопросы и задания
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали кислород.
Ответ:
Собрали прибор для получения кислорода и проверили его на герметичность. В пробирку насыпали примерно на 1/4 ее объема перманганата калия у отверстия пробирки положили рыхлый комочек ваты.
Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.
Опыт 2. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1—2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2—3 мл известковой воды.
Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Вопросы и задания
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали оксид углерода (IV).
Ответ:
В пробирку поместили несколько кусочков мела и прилили 1 мл разбавленной соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку, в которой находится 2-3 мл известковой воды. Наблюдаем как через известковую воду проходят пузырьки газа.
Эта реакция является качественной на углекислый газ.
Источник
Практическая работа № 6(н). Получение, собирание и распознавание газов
Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в нее 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43) и наденьте на кончик трубки еще одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4. Опишите, как можно распознать водород.
Ответы:
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1-2 гранулы цинка и прилили в нее 1-2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки еще одну пробирку, подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Сняли пробирку с водородом и не переворачивая ее поднесли к горящей спиртовке. Чистый водород взрывается с глухим хлопком.

Получение, собирание и распознавание аммиака

Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Вопросы и задания
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
3. Опишите не менее двух способов распознавания аммиака.
Ответы:
Собрали прибор для получения аммиака и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объемом по 1 ложечке для окисления веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли ее пробкой и укрепили на лапке штатива. На газоотводную трубку надели сухую пробирку для собирания аммиака. Пробирку со смесью хлорида аммония и гидроксида кальция нагрели.

Получение, собирание и распознавание кислорода
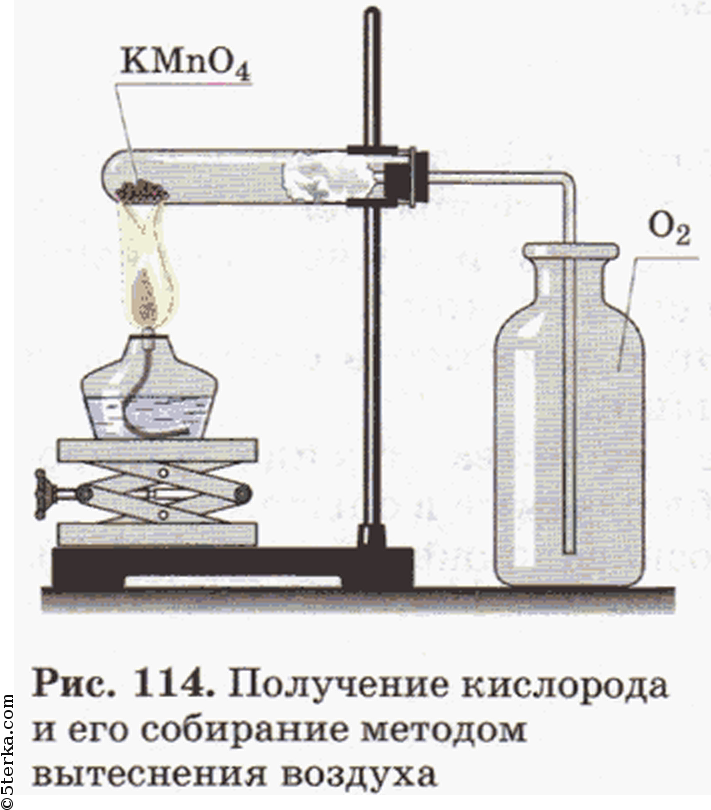
Соберите прибор, как показано на рисунке 114, и проверьте его на герметичность. В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
Вопросы и задания
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали кислород.
Ответы:
Собрали прибор для получения кислорода и проверили его на герметичность. В пробирку насыпали примерно на 1/4 ее объема перманганата калия у отверстия пробирки положили рыхлый комочек ваты.
Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.

Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1—2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2—3 мл известковой воды.
Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Вопросы и задания
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали оксид углерода (IV).
Ответы:
В пробирку поместили несколько кусочков мела и прилили 1 мл разбавленной соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку, в которой находится 2-3 мл известковой воды. Наблюдаем как через известковую воду проходят пузырьки газа.

Эта реакция является качественной на углекислый газ.

задача №6
к главе «Практические работы».
Источник
Опыт 2. Получение, собирание и распознавание водорода.
Повторите основные способы получения, собирания и распознавания газов. Для этого внимательно изучите информацию из практического занятия.
Выполните только опыт №1 (просмотрите в приложении ВК видео).
При оформлении протокола укажите дату занятия, название и цель практического занятия, оборудование и реактивы (только те, которые используются в опыте №1)
В ходе практической работы напишите пошагово отчет о проделанной работе.
Ответьте на вопросы и выполните задания в конце опыта №1.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №5
Получение, собирание и распознавание газов
Цель занятия: повторить способы получения, собирания газов, их физические и химические свойства, совершенствовать приемы работы с лабораторным оборудованием и химическими веществами.
Оборудование и реактивы: штатив с пробирками, лабораторный штатив, пробка с газоотводной трубкой, спиртовка, шпатель, вата, химические стаканы, кристаллизатор (сосуд для охлаждения водой), фарфоровая чашка, ложечка для сжигания веществ, стеклянная палочка, лучина, спички, оксид марганца (IV), перекись водорода, гранулы цинка, соляная кислота, мел, раствор соляной кислоты, известковая вода, твердый хлорид аммония, твердое вещество гидроксида кальция, вода, универсальная лакмусовая бумага, раствор фенолфталеина, раствор лакмуса.
Техника безопасности.
1. Вспомните общие правила техники безопасности в кабинете «Химия».
2. Осторожно использовать стеклянную посуду.
3. Осторожно использовать кислоты и щелочи. Всегда следует наливать кислоту в воду.
4. При получении водорода горящая спиртовка не должна находиться рядом с прибором для получения этого газа.
5. Пробирку с веществом прогревают сначала всю в верхней части пламени, а затем ту часть, где находится вещество. При нагревании жидкости отверстие пробирки следует направлять в сторону от себя и других людей. При нагревании объем вещества не должен превышать 1/3 объема пробирки.
Правила первой помощи.
При ранении стеклом удалить осколки из раны, смазать края раны раствором йода и перевязать бинтом. При необходимости обратиться к врачу.
При ожоге кислотой следует промыть место ожога проточной холодной водой, а затем нейтрализовать остатки кислоты мыльным раствором.
При ожоге щелочью следует промыть место ожога проточной холодной водой, а затем нейтрализовать остатки щелочи 3% раствором борной кислоты.
Ход практической работы.
Опыт 1. Получение, собирание (методом вытеснения воздуха) и распознавание кислорода
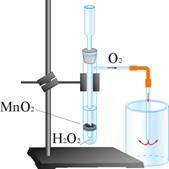 |
| Рис.2. Установка для получения и собирания кислорода из перекиси водорода |
1. Соберите прибор для получения газов и проверьте его на герметичность.
2. В пробирку положите одну ложечку для сжигания веществ оксида марганца (IV).
3. Прилейте в нее 2 мл перекиси водорода.
4. Закройте пробирку пробкой с газоотводной трубкой.
5. Наденьте на кончик трубки еще одну пробирку. В связи с тем, что кислород — газ тяжелее воздуха, для его собирания можно использовать метод вытеснения воздуха.
6. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
7. Наличие кислорода проверьте, внося тлеющую лучинку в пробирку-приемник. Наблюдается яркая вспышка и горение лучинки.
8. Сделайте вывод согласно цели занятия.
Вопросы и задания.
А). Что происходит при взаимодействии перекиси водорода с оксидом марганца (IV)? Составьте молекулярное уравнение реакции.
Б). Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
В). Опишите, как вы распознавали кислород.
Г). При оформлении протокола укажите дату занятия, название и цель практического занятия, оборудование и реактивы.
Д). Баллоны, предназначенные для хранения и транспортировки газов, окрашиваются эмалевой, масляной или алюминиевой краской и отличаются по цвету. Какие цвета используют при маркировке баллонов, заправленных кислородом?
Е). Какие последствия может вызвать аварийная разгерметизация кислородного баллона?
Ж). Предложите меры, которые необходимо предпринять для тушения веществ в атмосфере, обогащенной кислородом.
Опыт 2. Получение, собирание и распознавание водорода.
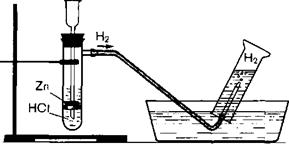 |
| Рис.3. Установка для получения и собирания водорода |
1. Соберите прибор для получения газов и проверьте его на герметичность.
2. В пробирку положите 1—2 гранулы цинка.
3. Прилейте в нее 1—2 мл соляной кислоты.
4. Закройте пробирку пробкой с газоотводной трубкой.
5. Наденьте на кончик трубки еще одну пробирку.
6. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
7. Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания.
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4. Опишите, как можно распознать водород.
Дата добавления: 2020-12-22 ; просмотров: 31 ; Мы поможем в написании вашей работы!
Источник