Оксид железа алюминотермическим способом
16 лет успешной работы в сфере подготовки к ЕГЭ и ОГЭ!
1602 поступивших (100%) в лучшие вузы Москвы
Подготовка к ЕГЭ, ОГЭ и предметным Олимпиадам в Москве
- home
- map
У Вас возникли вопросы?
Мы обязательно Вам перезвоним:
Получение железа алюмотермией
Описание.
Сейчас мы получим железо из оксида при помощи порошка алюминия. Такой способ получения металла из руды называется алюмотермией. Сейчас мы готовим смесь порошкообразного алюминия и оксида железа, так называемый термит. На дне тигля алюминиевая фольга. Слегка утрамбуем термит и подготовим углубление для зажигательной смеси. Поместим зажигательную смесь в ямку. Используем магниевый фитиль, чтобы поджечь термит. Способом алюмотермии можно получить очень чистое, свободное от углерода железо. Вы видите, как раскалился тигель. Температура реакции превышает 3000 градусов Цельсия. Внутри тигля – расплавленное железо и шлаки. К наружной поверхности тигля прилипли песчинки. Даже песок оплавился при высокой температуре. Восстановленное металлическое железо притягивается к магниту.
Источник
Химики сварили наномагнитики для поглощения 6G-излучения
Магнитный момент в частицах эпсилон оксида железа прецессирует с разной скоростью, в зависимости от размера частицы. Поэтому разные частицы поглощают разные длины волн миллиметрового диапазона, который планируется использовать в 6G связи
Gorbachev et al., / Journal of Materials Chemistry C, 2021
Материаловеды из МГУ, МИСИС и МФТИ рекордно ускорили синтез наномагнитов из очень редкого материала — эпсилон оксида железа (ε-Fe2O3). Он устойчив лишь в виде наночастиц и отличается от других оксидов железа сложной искаженной кристаллической решеткой. Последнее радикально меняет его магнитные свойства — например, эпсилон оксид железа поглощает излучение миллиметрового диапазона, который может стать рабочим для устройств 6G, а также его очень сложно размагнитить. Ключом, который сделал возможным промышленное получение материала, стала новая методика, позволяющая получать чистый материал в десятки раз быстрее, чем раньше. Исследование опубликовано в журнале Journal of Materials Chemistry C.
С точки зрения простейшей школьной химии любое вещество можно описать, указав из каких атомов оно состоит — и в каком соотношении они составляют это вещество. Например, легко отличить друг от друга минералы магнетит (Fe3O4) и гематит (Fe2O3). В первом на 6 атомов железа приходится 8 атомов кислорода, во втором на 6 атомов железа 9 атомов кислорода. Но когда речь заходит о физических свойствах материала, например, например, магнитных, то важным оказывается и то, как атомы упакованы в веществе. Например, в гематите Fe2O3 каждый атом железа окружен шестью атомами кислорода, так что минерал слабо притягивается к магнитам. А в маггемите, который тоже имеет формулу Fe2O3, примерно треть атомов железа окружена лишь четырьмя кислородами — и он очень хорошо притягивается к магниту (а магнетит — еще лучше).
Зная, какое расположение атомов улучшает магнитные свойства, можно создать магнитный материал с «идеальными» свойствами — либо очень хорошо магнитящийся, либо тот, который очень сложно размагнитить, а если постараться, то умеющий делать и то и другое. Но, к сожалению, отнюдь не любые расположения атомов (структуры) устойчивы — в большинстве своем они легко разрушаются, превращаясь в более устойчивые, но менее интересные структуры с точки зрения их свойств. Чтобы сделать структуру материала устойчивой, надо подобрать специальные условия: давление и температуру при которых она будет использоваться, или, иногда, размер частиц, сделанных из этого материала. Дело в том, что атомы на поверхности частиц ведут себя совсем иначе, чем атомы в толще вещества, у них другое окружение и другая подвижность. И чем меньше размер частиц, тем сильнее на нее влияют поверхностные атомы. А это может стабилизировать одну из желанных структур материала.
Самые маленькие 10-нанометровые частицы Fe2O3 стремятся обладать структурой маггемита, а крупные 100-нанометровые частицы сделают все возможное, чтобы перейти в структуру гематита. Ровно между ними лежит область существования очень редкого эпсилон оксида железа ε-Fe2O3: в его структуре есть атомы железа с четырьмя различными вариантами окружения атомами кислорода. И этот материал обладает абсолютным рекордом среди оксидов железа по величине коэрцитивной силы — своей способности сопротивляться перемагничиванию. А такие материалы нужны как для магнитной записи информации, так и для некоторых применений, связанных с радиосвязью.
Структура эпсилон оксида железа. Разные по окружению атомы железа покрашены в разный цвет
Горбачев Е. и др. / Успехи химии, 2021
Кроме того, что сам материал существует лишь в виде наночастиц, практически единственным способом получить его целенаправленно является синтез в пористом силикагеле (он используется чтобы впитывать влагу, например). Диоксид кремния стабилизирует структуру эпсилон оксида железа и не дает отдельным наночастицам срастаться, предотвращая образование гематита. Для успешного синтеза материала необходимо внедрить ионы железа в поры диоксида кремния, а потом нагреть до температуры около 1000-1250 градусов Цельсия. Самый простой способ добиться этого — вырастить силикагель прямо в растворе солей железа, что может отнимать до нескольких недель.
Из-за сложного синтеза эпсилон оксид до сих пор не находит промышленного применения, хотя впервые в чистом виде он был получен еще в 2004 году. Решить эту проблему смогла команда исследователей во главе с Львом Трусовым (Lev Trusov) с химического факультета МГУ. Коллективу удалось упростить технологию получения нового оксида железа. Во-первых, химики ускорили синтез кремний-оксидного геля примерно в 240 раз — до двух часов, — за счет повышения температуры. Во-вторых, они показали, что изменяя температуру последующего отжига можно очень точно задавать диаметр наночастиц, а с ним и их свойства, а также добиться получения чистого ε-Fe2O3.
При разных температурах отжига в силикагеле образуются наночастицы эпсилон оксида железа размером от 7 до 38 нанометров. А размер влияет на резонансную частоту, на которой материал поглощает миллиметровое излучение
Gorbachev et al. / Journal of Materials Chemistry C, 2021
Источник
1.3 Алюминотермическое восстановление оксидов металлов. Характеристики алюминотермического процесса.
Одним из важнейших технико-экономических показателей промышленных алюминотермических процессов является извлечение восстанавливаемого металла из концентратов. Физико-химические факторы, от которых зависит степень извлечения металлов из оксидов: скорость плавления шихты, температурные условия плавки, полнота протекания диффузионных процессов.
Вероятная полнота протекания процесса и принципиальная возможность его осуществления определяются, в первую очередь, термодинамическими характеристиками взаимодействия оксидов металлов с алюминием [11].
Общий вид уравнения взаимодействия оксидов с алюминием (1):
Самопроизвольное протекание этой реакции возможно при условии –высокая термодинамическая прочность оксидов алюминия по сравнению с оксидами восстанавливаемых металлов [12]. Прочность оксидов различных металлов можно охарактеризовать величиной изобарного потенциала ∆G 0 , имеющего места при взаимодействии этих металлов с кислородом.
При проведении алюминотермического процесса рассчитывают изобарно-изотермический потенциал. Данный расчет сводится к анализу термодинамических равновесий в системе металл — неорганическое вещество. Как известно, любой химический процесс сопровождается изменением энергии системы. Оно равно максимальной работе, которая производится этой системой или совершается над системой в течение процесса [13].
Необходимые расчеты проводят используя стандартные величины по обобщенному уравнению как первого, так и второго закона термодинамики (уравнение Гиббса-Гельмгольца) (2):
где ∆G – энергия Гиббса;
∆Η – полная энергия системы;
Т∆S – связанная энергия (при Р = const).
Все подсчеты по таблицам стандартных величин проведены учитывая свойства аддитивности ∆G, ∆Н и ∆S [12].
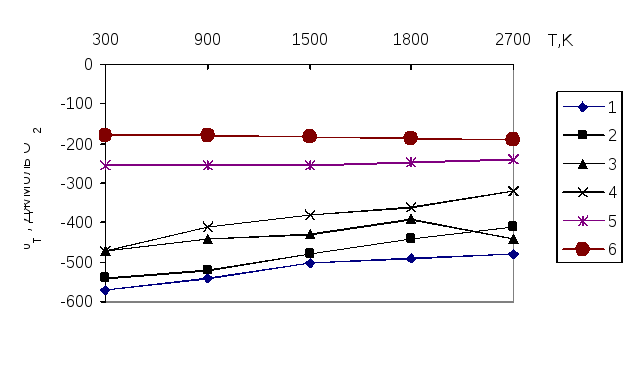
Также имеются расчетные данные температурной зависимости энергии Гиббса для каждой реакции, в ходе которых образуются различные вещества. К примеру, для некоторых оксидов конденсированной и газовой фаз построены диаграммы ∆G 0 – Т [14], позволяющие довольно быстро оценить, какой металл способен восстанавливать другой металл из соответствующего оксидного соединения [15,16,17].
На рисунке 1 можно наблюдать совместное восстановление многокомпонентных систем. При этом наибольший энергетический вклад в систему вносят триоксид железа (1), триоксид вольфрама (2), триоксид марганца (3). Эти оксиды будут восстанавливаться первыми при рассмотрении температурного интервала. Оксиды MnO и SiO2 восстанавливаются наиболее трудно.
В ходе производства ферросплавов при восстановлении для сдвига равновесия реакций вправо необходимо присутствие трудновосстанавливаемых оксидов растворителя – железа по следующим перечисленным причинам [19]:
— в системе создается более приятные энергетические условия (уменьшается общее значение ΔG 0 ), так как оксиды железа восстанавливаются наиболее легче большинства других оксидов;
— железо растворяет восстановленные элементы, при этом понижает их активность, что приводит к смещению равновесия в сторону восстановления в соответствии с констатацией равновесия реакций;
— железо препятствует протеканию вторичных реакций (окислению), а также испарению элементов;
— железо понижает температуру плавления металлической фазы, а также позволяет вести плавку при более низкой температуре.
Рисунок 1 – Температурная зависимость изменения изобарного потенциала реакций, протекающих в ходе алюминотермического восстановления оксидов [18]
Проводя термодинамический анализ реакций одновременного алюминотермического восстановления двух или нескольких оксидов необходимо учитывать величину концентраций веществ в металлической фазе. Для того, чтобы оценить влияние концентрации на восстанавливаемость оксида используют реакцию диссоциации оксидов [18]:
константа равновесия данной реакции равна:
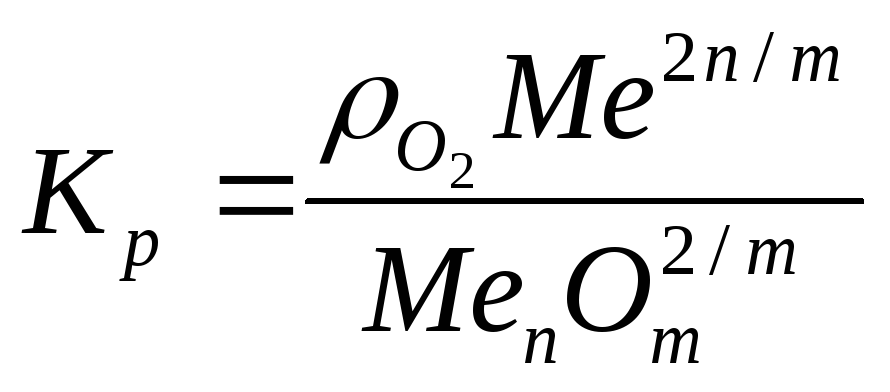
где Kp — константа равновесия;
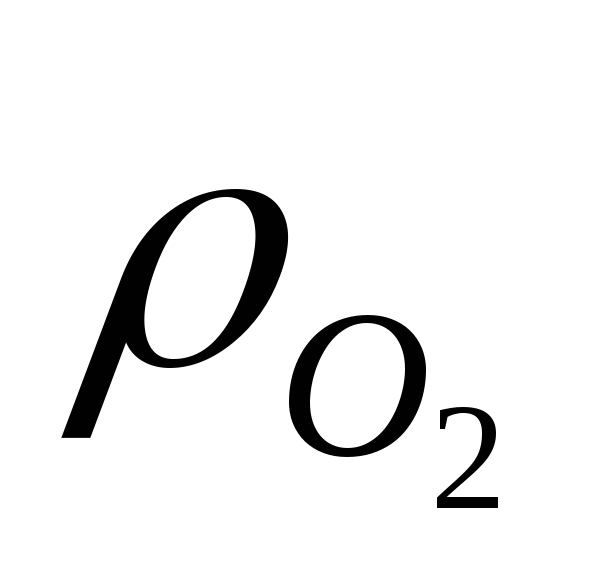
Если решить уравнение относительно давления кислорода 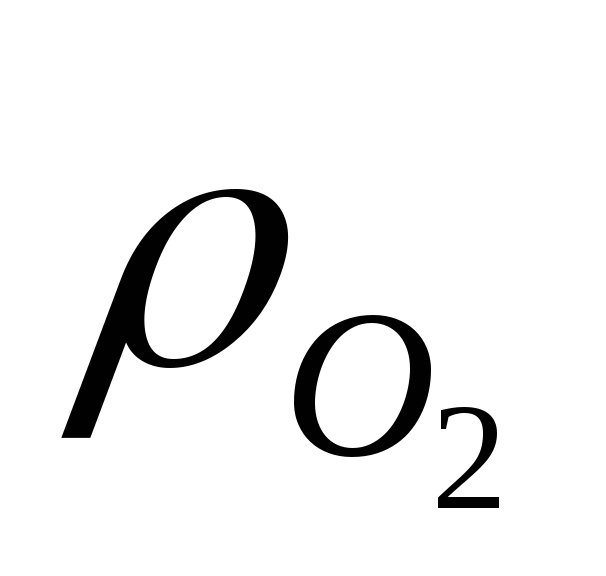
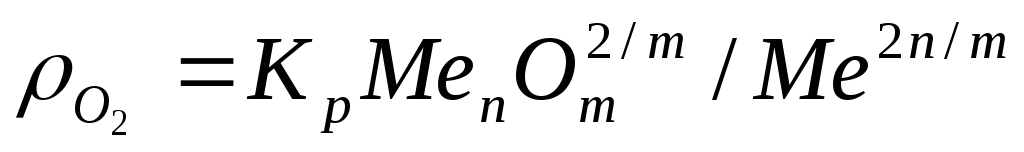
Термодинамически более уместным является восстановление оксидов с максимальным 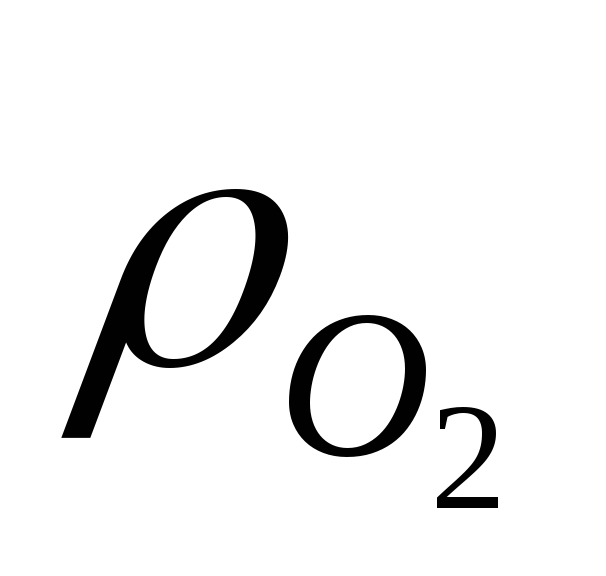
В соответствии с уравнением (5): по мере протекания восстановительных реакций концентрация МеnOm уменьшается, а концентрация металла растет, что приводит к уменьшению 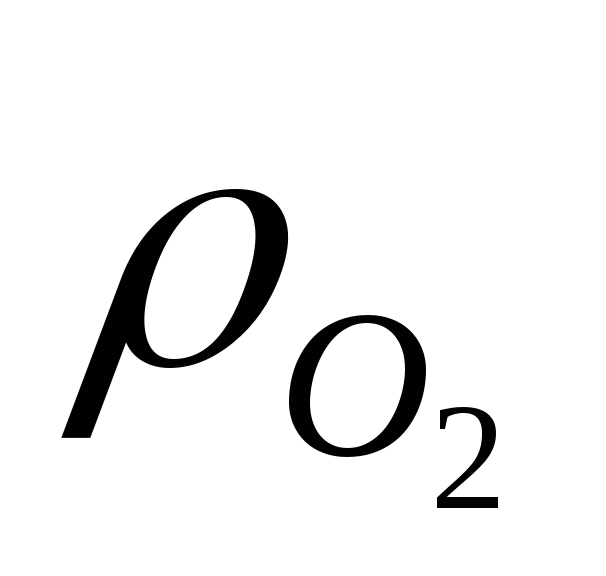
Обе реакции восстановления будут иметь равную термодинамическую вероятность в связи с тем, что уменьшение величины 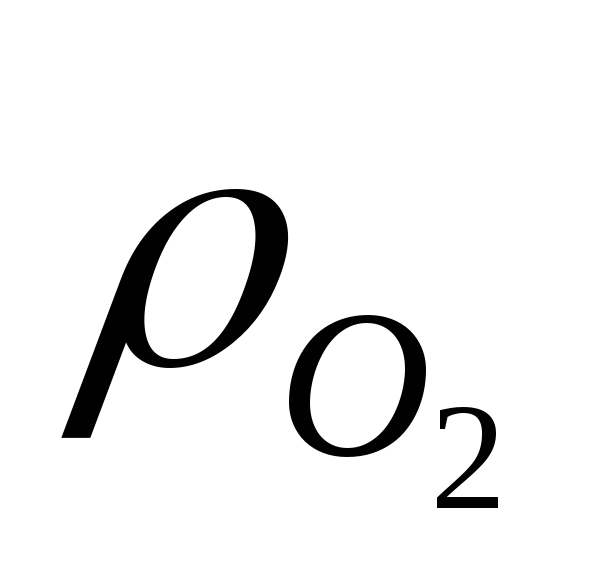
Из этого следует, что восстанавливаемость оксидов зависит как и от их прочности, определяемой величиной изобарного потенциала по уравнению(2), так и от их концентраций в расплаве. В ходе реакции тепла, выделяемого при алюминотермическом восстановлении триоксида вольфрама, достаточно для протекания до конца [20].
В реакции (1) константа равновесия при 2000 К составляет 210 4 , что соответствует равновесному составу с содержанием 1% волластонита в шлаке и 0,4% WO. Процесс протекает с высоким извлечением полезного ведущего элемента, так как реакция сопровождается значительным изменением энергии Гиббса [20].
Удельный тепловой эффект Q, характеризующий алюминотермический процесс, можно определить [16], как отношение теплового эффекта реакции Qр к сумме молекулярных масс всех реагирующих веществ ∑М, кДж/кг:
Для определения удельного теплового эффекта, исходя из результатов многочисленных опытов алюминотермического восстановления оксидов, предложена [17] эмпирическая формула (4):
где Q – тепловой эффект данного алюминотермического процесса, кДж/кг;
∆Η298 К – тепловой эффект образования оксида, кДж/г·моль.
Суммарный удельный тепловой эффект при условии, что шихта состоит из двух восстанавливаемых соединений, определяют по уравнению (8):
где х – составляет содержание первого соединения в шихте, %;
Q1 и Q2 – удельные тепловые эффекты при восстановлении первого и второго оксида соответственно [10].
Температура является вторым важнейшим параметром, характеризующим тепловые условия протекающего алюминотермического процесса. Процесс определения температуры экспериментальным и расчетным путями очень трудоемкий. Трудности возникают из-за отсутствия надежных данных по теплофизическим константам веществ при высоких температурах. При использовании суммарных величин энтальпий продуктов реакции можно рассчитать температуру реакции [21].
По теории Шиндловского А.А. для расчета максимальной температуры металлотермической реакции [22] можно использовать следующее уравнение(9):
где ∑Ср – сумма теплоемкостей всех продуктов данной реакции, Дж/моль∙К;
∑(Lпл + Lкип) – сумма скрытых теплот плавления и испарения всех продуктов данной реакции, Дж/моль.
Ключников Н.Г. [20] предлагает уравнение (10), в ходе которого можно определить температуру реакционной массы алюминотермического процесса восстановления оксидов:
t = 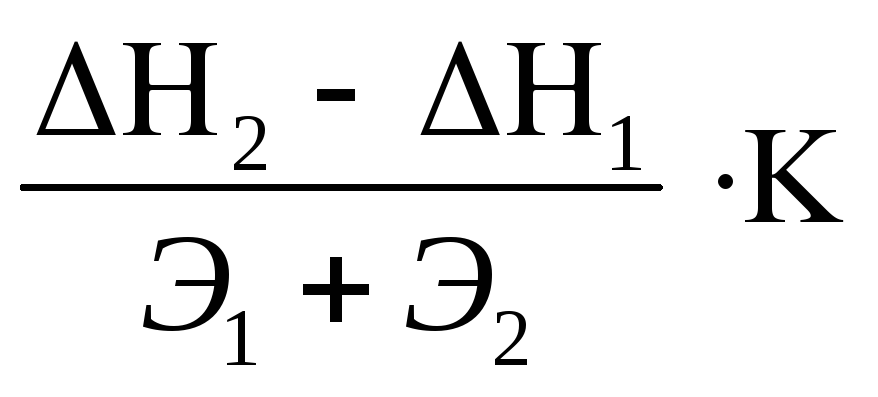
где ∆Н1 – теплота образования восстановления оксида, Дж/г-экв;
∆Н2 – теплота образования оксида металла-восстановителя, Дж/г-экв;
Э1 и Э2 – эквивалентные массы восстанавливаемого оксида и металла-восстановителя соответственно;
К – коэффициент, который для алюминотермических реакций принимается равным 3,15.
Используя тепловой баланс величины плавки, по формуле (11) проводят расчет максимальной температуры алюминотермического процесса восстановления оксидов [20,21]:
где Q – удельный тепловой эффект данной реакции;
Q1 – соответствует сумме изменений энтальпий продуктов реакции до температуры плавления;
Ме, МеО – продукты реакции;
Ср – теплоемкость продуктов реакции.
Выведена эмпирическая зависимость для определения температуры реакции, используя расчеты по этому уравнению для алюминотермического восстановления ряда оксидов (12):
где δΗ′ — количество тепла данной реакции, кДж/г-атом.
Тепла, выделяющегося в ходе протекания основной реакции восстановления оксида, обычно недостаточно для нормального протекания процесса, полного разделения металла и шлака (получение титана, хрома). Поэтому при проведении внепечной выплавки часто используются добавки в шихту оксидов и других многих соединений (термитные добавки), которые при взаимодействии с алюминием дают значительно большую удельную теплоту процесса, чем основной восстанавливаемый оксид [23].
Повышение расхода восстановителя, увеличение количества шлака — все это является существенными недостатками термитных добавок.
По сравнению с применением термитных добавок наиболее эффективным является предварительный нагрев шихтовых материалов.
Температуру процесса необходимо выбрать так, чтобы она обязательно превышала температуру плавления шлака на 300-400 0 С. Значение температуры внепечного процесса необходимо принимать максимально возможное, потому что повышение температуры этого процесса может привести к снижению восстанавливаемости оксидов и повышенному испарению элементов во время плавки, а также это повышение связано с дополнительными затратами [10].
На скорость алюминотермического процесса влияют большое количество факторов. Прежде всего, скорость процесса зависит от теплохимических параметров данной реакционной массы, тепловых условий протекания и механизма алюминотермической реакции.
В конденсированных фазах для оценки скорости процессов используют ниже перечисленные выражения [24]:
а) линейная скорость горения определяется по высоте столба прореагировавшего расплава h:
vh = 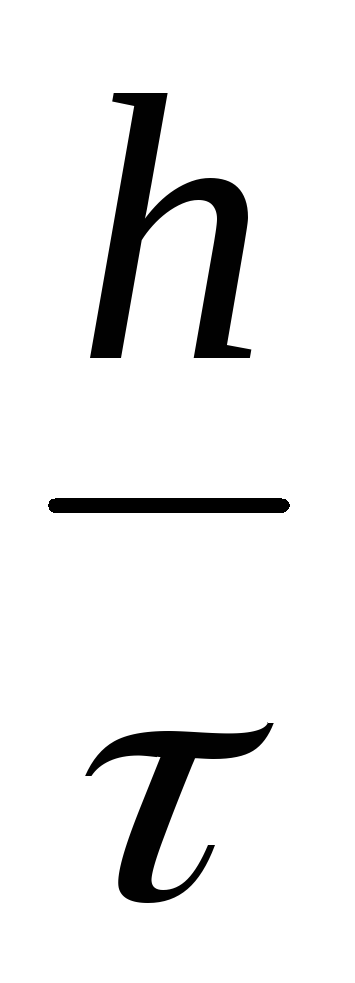
б) объемная скорость горения определяется:
vs = Vn S = 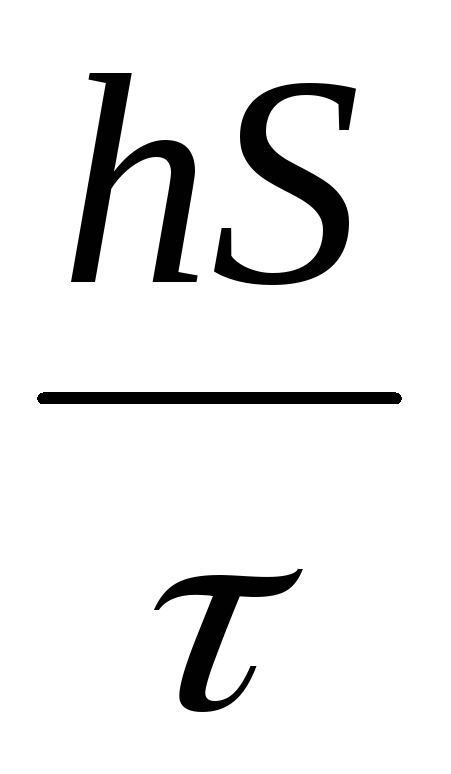
где S – поверхность протекания реакции;
в) массу прореагировавших веществ можно определить из соотношения:
vm = vs d = 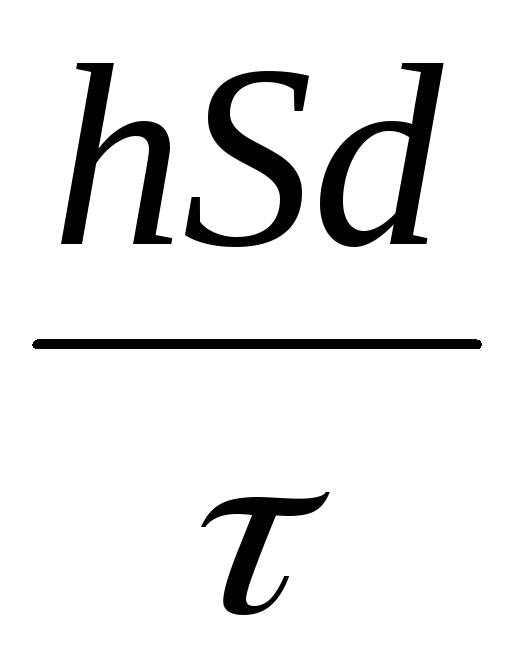
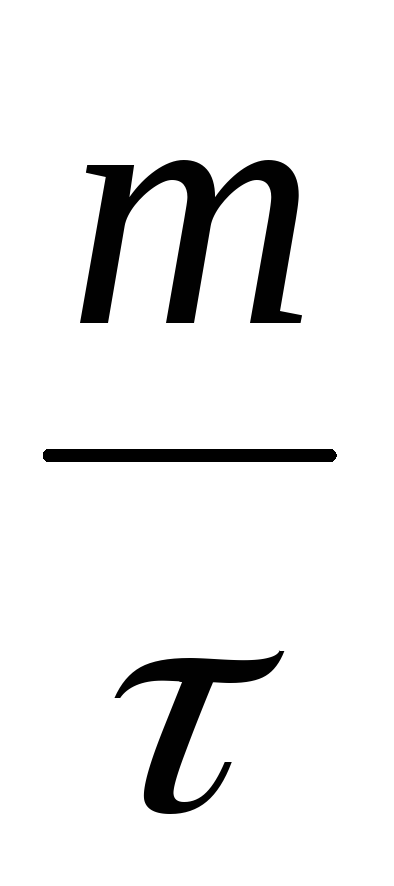
где d – плотность всех шихтовых материалов.
В зависимости от физико-химических свойств шихтовых материалов и продуктов плавки скорость проплавления шихты должна находиться в пределах от 100 до 400 кг/м 2 ∙мин. Это условие необходимо для нормального протекания промышленной внепечной плавки алюминотермических ферросплавов и лигатур.
Возникновение металлической фазы в виде дисперсных капель — специфическая особенность алюминотермического процесса. Благодаря этому свойству слиток алюминотермического сплава формируется в результате осаждения частиц восстанавливаемого металла через толщину расплава. От размера, плотности и вязкости металлической фазы жидкой металлической капли зависит скорость ее движения через расплавленный шлак. Поверхностные свойства металла определяют продолжительность разделения продуктов реакции.
Жидкая металлическая капля опускается под действием силы тяжести в расплавленном шлаке. Эта капля движется в начале пути ускорено до тех пор пока в связи с увеличением сопротивления вязкой среды, пропорциональной скорости падения, рост скорости капли не прекратится, дальнейшее ее движение становится равномерным с постоянной скоростью vр [15]. Радиус образовавшейся капли влияет на движение жидкой капли в расплаве.
Так как шихта состоит из порошкообразных компонентов, то в результате протекания алюминотермической реакции будут образованы мелкие капли металла. Эти капли, опускаясь через расплавленный шлак, застывают на подине горна в виде металлического слитка.
По реакциям (16) и (17) может быть получен ферровольфрам алюминотермическим способом:
выявлено [15]: из каждой единицы объема алюминия, израсходованного на восстановление железа, может быть образовано 0,76 единиц объема железа. Объем получаемого металла и объем израсходованного алюминия близки между собой, что характерно, в основном, для всех алюминотермических реакций.
Авторы [28] предлагают формулу (18) для расчета скорости осаждения металла, которая применяется для большинства алюминотермических процессов, при исследовании падения капель феррохрома в шлаке 25:
r max = 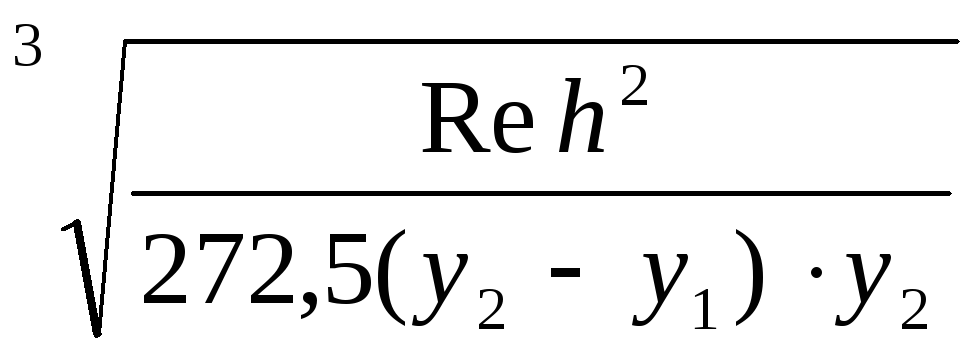
Необходимое условие применимости данного уравнения – ламинарность движения капли, т.к. уравнение Стокса (19):
оно справедливо только в том случае, когда сопротивление среды движению шарика пропорционально скорости падения капли. Критическая скорость — это скорость, выше которой сопротивление среды перестает быть пропорциональным скорости падения шарика и, следовательно, ламинарное движение сменяется турбулентным. И эта скорость выражается следующим уравнением:
rmax = 
Из расчетов по этой формуле получены значение rmax = 1,97 см, которое применимо для выплавки ферровольфрама.
Уравнение (20) можно использовать для расчета скорости осаждения металла через расплавленный шлак в алюминотермических реакций, т.к. значение rmax = 1,97 намного превышает размер образующихся во время реакции восстановления капель.
Анализируя уравнение (20) можно сделать следующие выводы о том, что скорость движения жидкой металлической капли через расплавленный шлак зависит от ее плотности, размера, вязкости металлической и шлаковой фаз. Как известно, важное значение в формировании металлического слитка имеет плотность алюминотермических расплавов.
Технико-экономические показатели производства алюминотермических расплавов определяются формированием слитка в ходе алюминотермического процесса и вязкостью расплава [26].
Вязкость и плотность металла определяют скорость опускания металлической капли. Для того, чтобы снизить вязкость при проведении алюминотермических процессов в шихту вводят различные флюсующие добавки. Наиболее распространенными из них являются известь и плавиковый шпат. Характерной особенностью оксида кальция является то, что он может образовывать со многими оксидами металлов химические соединения с пониженной температурой плавления. Добавка извести обычно приводит к снижению вязкости [27].
Избыток СаО в шихте ведет к понижению активности триоксида вольфрама согласно реакциям (оптимальное количество извести равно 15 % от массы алюминия):
В зависимости от количества выделяющегося тепла Qэкз алюминотермические процессы можно разделить на три группы:
Объем грамм-эквивалента оксида (Vок )
Объем грамм-эквивалента оксида (Vок)
По представленным в таблице 1 данным можно сделать вывод: для большинства оксидов грамм-эквивалентный объем превышает объем грамм-эквивалента алюминия в 1,5 = 1,9 раза. Приняв форму зерен компонентов за сферическую, диаметр частиц алюминия должен находиться в пределах (0,8-0,9)dок (диаметр зерна восстанавливаемого оксида). Учитывая, что степень восстановления оксидов в промышленных внепечных алюминотермических процессах составляет около 70 — 90%, то приведенное отношение становится более близким к единице. В итоге, принимая величину частиц алюминиевого порошка близкой к размеру частиц оксида, при заданном размере частиц оксида соотношение шихтовых материалов будет близко к стехиометрическому.
Повышение показателей процесса и главным образом выхода металла, применяя шихтовые материалы одинаковой крупности, было установлено рядом исследований [2,10].
Изучая влияние измельчения алюминия на скорость плавления шихты его крупность была измерена величиной поверхности 1 г порошка, рассчитанной по условному диаметру зерна металла [29].
Для того, чтобы получить максимальный выход металла крупность восстановителя должна быть близкой к крупности восстанавливаемого оксида, причем выход металла тем больше, чем выше измельчение компонентов шихты. При этом нужно учитывать, что переизмельчение шихты алюминотермической плавки приведет к высокому выносу шихтовых материалов и выбросам расплава во время проведения плавки. При тонком измельчении оксидов и получении мелких фракций порошка алюминия приводит к дополнительным потерям материалов. Вследствие этого, восстанавливаемые оксиды не должны быть измельчены менее чем до 0,1 — 0,3 мм [29].
Обеспечение необходимых условий для нормальной скорости проплавления шихты возможно в том случае, когда будут подобраны равные размеры восстановителя и оксидов. Если скорость процесса медленная, то размер частиц восстановителя следует уменьшить по сравнению с крупностью оксида.
Когда ведется подбор степени измельчения шихтовых материалов необходимо учитывать, что скорость осаждения восстановленного металла определяется величиной зерна восстановителя, и причиной больших потерь в виде корольков, остающихся в шлаке, будет являться применение мелких фракций алюминиевого порошка [29].
Источник