- Производство оксида этилена
- Характеристика этилена, кислорода и окиси этилена как сырья и продукта. Физико-химическое обоснование основных процессов производства. Анализ способов получения этиленоксида через этиленхлоргидрин, гомогенное газофазное и каталитическое окисление этилена.
- Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
- Окись этилена: производство, применение
- Исторические сведения
- Великая четверка по производству окиси этилена
- Перевозка вещества
- Признаки отравления этиленом
- Интоксикация окисью этилена
- Колоссальное отравление
- Первая помощь пострадавшему. Лечение
- Стерилизация при помощи окиси этилена
- Гидратация окиси этилена
- Действие этиленгликоля на организм
- Признаки отравления
Производство оксида этилена
Характеристика этилена, кислорода и окиси этилена как сырья и продукта. Физико-химическое обоснование основных процессов производства. Анализ способов получения этиленоксида через этиленхлоргидрин, гомогенное газофазное и каталитическое окисление этилена.
| Рубрика | Химия |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 26.05.2016 |
| Размер файла | 340,2 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Министерство образования и науки Российской Федерации
Московский Технологический Университет
Кафедра Общей химической технологии
Курсовая работа на тему:
Производство оксида этилена
студентка группы ХЕБО-01-13
Характеристика целевого продукта
Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства
Задача курсовой работы заключается в разработке технологического процесса производства оксида этилена.
Окись этилена является одним из наиболее крупнотоннажных продуктов органического синтеза, получаемых на основе этилена.
Согласно современных данных производство окиси этилена составляет около 5 млн. тонн и масштабы производства ее возрастают. Поэтому перед современной химической промышленностью стоит задача разработать методы и пути интенсификации получения окиси этилена, улучшения качества продукта, уменьшения затрат на ее производство.
Окись этилена впервые получил и описал ее главные свойства в 1859 г. французский химик Адольф Шарль Вюрц. Занимаясь изучением производных этиленгликоля, Вюрц получил окись этилена действием раствора едкого кали на этиленхлоргидрин и определил, что новое соединение кипит при +13,5°С, смешивается во всех отношениях с водой, образует с сульфатом натрия кристаллическое соединение освежающего вкуса, восстанавливает водный раствор нитрата серебра, но не дает кристаллического осадка при действии эфирного раствора аммиака.
Этот метод получения окиси этилена довольно давно был освоен химической промышленностью и долгое время был единственным практически значимым методом получения окиси этилена.
Но работа с хлором, который является довольно токсичным, привела к необходимости поиска других способов получения . И начиная с 30 годов прошлого ХХ века начались исследования процессов каталитического окисления этилена. На сегодня разрабатываются методы некаталитического окисления этилена и этана в окись этилена.
Начало промышленного производства окиси этилена датируется 1914 годом, когда был запущен хлоргидриновый процесс, монопольно просуществовавший до 1937 года. Первый завод по производству окиси этилена был построен во время Первой мировой войны компанией BASF. Хлоргидриновый процесс изначально был не вполне эффективен, даже не беря в расчёт экономические показатели, так как в его результате терялся ценный хлор в виде хлорида кальция.
Начиная с 30-х годов XX века этот процесс начал вытесняться прямым газофазным окислением этилена воздухом, а начиная с 1958 года — кислородом, в присутствии серебряного катализатора, при давлении 1—3 МПа и температуре 200—300 °C.
Более экономичный способ прямого окисления этилена к середине 50-х годов XX века в США обеспечивал примерно половину всей производимой окиси этилена, а после 1975 года полностью вытеснил старый метод.
В Советском Союзе первое промышленное производство окиси этилена, осуществлённое в соответствии с хлоргидриновым процессом, было запущено в 1936 году; одновременно проводились интенсивные поиски более экономичной технологии. Работы над созданием собственного метода получения окиси этилена прямым окислением этилена на серебряном катализаторе велись под руководством профессора П. В. Зимакова в 1938—1942 гг., что легло в основу первого отечественного промышленного производства получения окиси этилена прямым каталитическим окислением этилена, запущенного вскоре после Великой Отечественной войны.
Окись этилена — важнейшее сырьё, используемое в производстве крупнотоннажной химической продукции, являющейся основой для большого числа разнообразных товаров народного потребления во всех промышленно развитых странах.
Основные направления использования окиси этилена:
· этиленгликоли — используются в качестве антифризов, в производстве полиэстера, полиэтилентерефталата, агентов для осушения газов, жидких теплоносителей, растворителей и пр.;
· полиэтиленгликоли — используются в производстве парфюмерии и косметики, фармацевтических препаратов, лубрикантов, растворителей для красок и пластификаторов;
· эфиры этиленгликоля — входят в состав тормозных жидкостей, моющих средств, растворителей лаков и красок;
· этаноламины — применяются в производстве мыла и моющих средств, очистки природного газа и аппретирования тканей;
· этоксилаты — используют в производстве моющих средств, в качестве сурфактантов, эмульгаторов и диспергаторов.
Крупнейшим направлением использования окиси этилена является производство этиленгликолей, однако процент его применения в этом виде сильно варьирует в зависимости от региона: от 44 % в Западной Европе, 63 % Японии и 73 % в Северной Америке до 90 % в остальной части Азии и 99 % в Африке.
Свойства: При нормальных условиях — бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0 °C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам.
Атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три сигма-связи с углеродом и двумя атомами водорода. Р-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости пи-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение: CH2=CH2
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
Получение: В настоящее время в структуре производства этилена 64% приходится на крупнотоннажные установки пиролиза,
17% — на малотоннажные установки газового пиролиза,
11% составляет пиролиз бензина и 8% падает на пиролиз этана.
Основной промышленный метод получения этилена — пиролиз углеводородного сырья в трубчатых печах в присутствии водяного пара. Наиболее широко в качестве сырья используют низкооктановые бензиновые фракции, получаемые при первичной переработке нефти и выкипающие в широком интервале температур (40-170 ?С).
Свойства: химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления ?2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры.
Получение: В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
При получении окиси этилена можно использовать в качестве окислителя технический кислород. В этом случае желательно применять концентрированный этилен (98 %-ный и выше).
Примеси: Количество ацетилена, сернистых соединений и диолефинов не должно превышать 0,001% каждого, так как они отравляют катализатор и образуют взрывоопасные смеси с кислородом.
В реактор подают свежий этилен, технический кислород и рециркуляционный поток, содержащий непрореагировавший этилен, кислород, азот и оксид углерода (IV). Благодаря разбавлению смеси этилена и кислорода азотом и оксидом углерода (IV) удается снизить взрывоопасность этой смеси.
Катализатор: промышленный процесс получения оксида этилена прямым окислением этилена техническим кислородом осуществляют на серебряном катализаторе. В качестве носителя используют оксид алюминия.
Для приготовления такого катализатора чаще всего пропитывают носитель растворами некоторых соединений серебра (например, водным раствором нитрата серебра) с последующим восстановлением до металлического серебра.
Этапы подготовки сырья в технологической схеме: Вследствие большой чувствительности серебряного катализатора к действию контактных ядов, в частности сернистых соединений и ацетилена, исходные газы, применяемые в производстве окиси этилена каталитическим методом, должны быть тщательно очищены.
Если исходный этилен содержит ацетилен, то его удаляют путем промывки газа селективными растворителями (ацетоном, диметилформамидом) или гидрируют до этилена на никелевом катализаторе.
От соединений серы исходный газ очищают обычным методом — промывкой щелочью и водой.
Характеристика целевого продукта
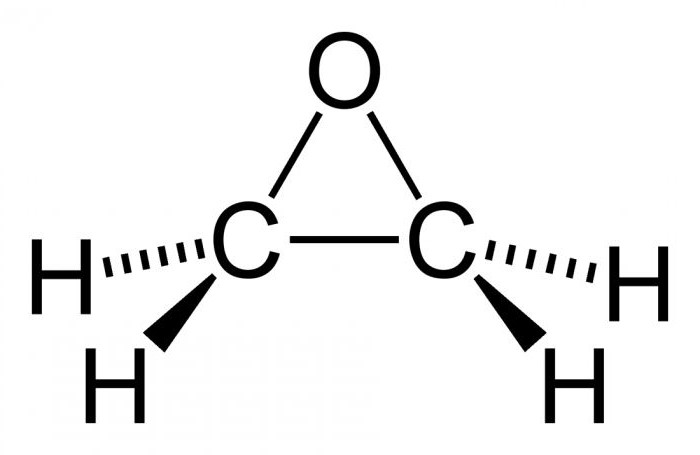
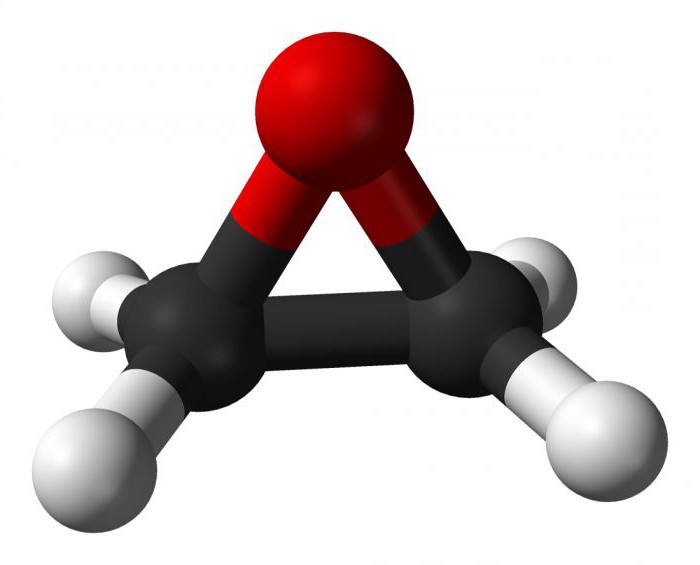
Окись этилена относится к циклическим простым эфирам.
Вследствие напряженности трехчленного эпоксидного цикла оксид этилена и другие похожие соединения обладают высокой реакционной способностью.
При обычной температуре и давлении окись этилена находится в газообразном состоянии. При низких температурах окись этилена представляет собой легколетучую бесцветную жидкость со специфическим эфирным запахом (т. кип. 10,7єС; т. затв. — 113,3°С); с водой образует гидрат с 7 молекулами H2 O (температура плавления 12,8°С). Молекулярный вес ее составляет 44,054 г/моль. С водой окись этилена смешивается во всех отношениях, с воздухом образует взрывчатые смеси. Окись этилена обладает инсектецидными ибактерицидными свойствами.
Чистая окись этилена не является проводником электрического тока, но, растворяя соли (например, хлористый натрий и особенно азотнокислый калий), образует токопроводящие растворы. Некоторые исследователи считают, что водные растворы окиси этилена не проводят электрический ток. По другим данным, водные раствори ее являются слабыми проводниками тока, хотя авторы объясняют электропроводность этих растворов вторичными причинами, в частности образованием небольших количеств гликолевой кислоты. Диэлектрическая проницаемость окиси этилена при составляет 13,9. Дипольный момент равен 1,88 — 1,91 D.
Окись этилена — одно из самых реакционноспособных органических соединений. Благодаря легкости размыкания напряженного трехчленного эпоксидного цикла окись этилена может присоединять вещества, содержащие подвижный атом водорода, образуя -оксиэтилпроизводные, а также может полимеризироваться. При нагревании до 500°С без катализаторов или до 150 — 300°С в присутствии некоторых катализаторов (активная окись алюминия, фосфорная и соляная кислоты, фосфаты) окись этилена необратимо изомеризуется в ацетальдегид с выделением большого количества тепла. Путем гидратации окиси этилена получается этиленгликолъ. Окись этилена способна полимеризироваться под влиянием третичных аминов, хлорного олова и некоторых других катализаторов с образованием твердой белой массы, представляющей собой смесь полимергомологов состава . При полимеризации выделяется очень большое количество тепла, и процесс может протекать со взрывом. Высокомолекулярный полиоксиэтилен растворим в воде, и поэтому его применяют в качестве эмульгатора и загустителя.
Окись этилена вступает также и в много других реакций с другими веществами, практически важные реакции мы рассмотрим ниже в разделе, касающемся применения окиси этилена.
Источник
Окись этилена: производство, применение
Окись этилена – это ахроматический метан с приторным, вызывающим тошноту ароматом, напоминающий уретан. Вещество увесистее кислорода. Твердеет при температуре – 115 о С, а при температуре +12 о С сворачивается в прозрачную подвижную смесь, имеющую жгучий привкус. Вещество с легкостью растворяется в воде, этиловом спирте и других базисных веществах. В синтезе с оксигеном становится взрывоопасным.
Исторические сведения
Окись этилена была открыта в 1859 году французским ученым, химиком-органиком Шарлем Адольфом Вюрцем. Он стал первым из тех, кто исследовал данное соединение и его качественные характеристики, измерив показатель температуры, при котором этилена оксид закипает. Изначально ученый считал, что окись этилена, по своим физико-химическим параметрам и особенностям, имеет сходство с органическим основанием. Это ошибочное мнение продержалось до 1896 года, пока другие исследователи (Бредиг и Усов) не выяснили, что окись этилена не является электролитическим веществом.
Длительное время был известен только один метод извлечения окиси этилена напрямую, из самого этилена. Им пользовались многие ученые. Но в 1931 году соотечественник Шарля, химик Теодор Эмиль Лефорт, создал новый способ окисления этилена напрямую, при помощи серебряного фермента. Этот способ, созданный в конце 20-го века, используют и в настоящее время.
Великая четверка по производству окиси этилена
Первым ученым, который создал окись этилена путем окисления вещества, при помощи кислорода и серебряного ускорителя, стал Эмиль Лефорт. Им же и был запатентован этот метод в 1931 году. Способ получения окиси этилена многократно модифицировался и приобретал различные варианты в промышленном производстве.
Первой компанией, которая реализовала промышленный метод прямого окисления этилена, начиная с 1995 года, является компания UCC (Union Carbide Corporation). Здесь используется процесс, названый «Метеорным», который характеризуется высокой производительностью, низкими капиталовложениями. Компания была основана в 1917 году Ричардом Уэллсом. Завод окиси этилена и гликолей действует и посей день. Данная корпорация выкупила патент, который в современности является ее достоянием, и находит свое применение только на предприятиях, принадлежащих ей же, а также занимающих более 25% мощностей по всему миру.
Второй компанией, использующей подобный метод, но масштабнее распространенный в мире благодаря системе лицензированного типа, является Scientific Design Company, Inc. С 1983 года она насчитывает более 95 проектов, около 27% мировых мощностей и 80% всех лицензионных производств окиси этилена. Основана компания в 1946 году.
Третьей компанией, использующей данный способ, является Shell International Chemicals B.V. Дочернее предприятие компании Royal Dutch Shell, основанной в 1907 году. Способ этого предприятия отличается от других производителей, завышенными требованиями в отношении производства окиси этилена и длительным сроком жизни сиккатива (более 3 лет). Компания охватывает более 45% мировых мощностей в производстве.
Четвертый производитель — японская компания Japan Catalytic Chemical Co. Она использует лицензионный способ, схожий с методом Scientific Design, налаженный для организации единого комплекса, совмещающего производство окиси этилена и этиленгликолей. Японская корпорация основана в 1951 году.
Оксид этилена — самый крупный по объемам производства органический продукт в мировой химической индустрии. Однако он уступает некоторым веществам, таким как этилен, пропилен, этанол, метанол, бензол, винилхлорид, стирол, толуол и т. д. Производство оксида этилена все так и остается на втором месте после полиэтилена по значимости и составляет всего 14%. Данный элемент используют для производства полиэтилен гликоля, полиэтиленоксида, сополимеров с пропиленовой окисью, поверхностных веществ активного типа, нефтяных деэмульгаторов, фумигантов.
Перевозка вещества
Процесс перевозки происходит при помощи контейнеров, баллонов и цистерн. Окись этилена сохраняется в резервуарах объемом до 3 тыс. м 3 при температуре 15-20 градусов по Цельсию, под давлением 7-19 кгс/см 2 . Оксид этилена представляет собой ядовитое вещество, которое обладает раздражающими, одурманивающими и довольно токсическими свойствами. С легкостью, являясь газом, проникает сквозь одежду и обувь, вызывая резкую аллергическую реакцию, а при попадании на слизистую оболочку глаз — ожоги.
Признаки отравления этиленом
Этилен используют повсеместно в производстве разных средств для красоты, здоровья и не только. Чаще всего его добавляют в:
- лаки;
- краски;
- растворители;
- антифризы;
- мыло и моющие средства;
- косметику и парфюмерию;
- антибиотики и многое другое.
Стерилизация окисью этилена часто используется человеком для дезинфекции газового типа. Мы сталкиваемся с этим ядовитым веществом ежедневно. Нередко случаются ЧП, связанные с отравлением окисью этилена. Рассмотрим признаки отравления и способы лечения.
Интоксикация окисью этилена
Симптомами острой интоксикации являются:
- головная боль и головокружение;
- сладкий привкус во рту;
- тошнота и рвота;
- покраснение лица;
- общая слабость;
- нарушение сердечного ритма;
- паралич лицевых мышц;
- слабая реакция зрачков на свет;
- судороги;
- увеличение печени и нарушение ее функций.
Колоссальное отравление
Хроническое отравление являет собой такие симптомы:
- постоянные жалобы клиента на головную боль;
- боли в суставах;
- проблемы с желудочно-кишечным трактом;
- тремор пальцев вытянутых вперед рук;
- потливость и оледенение конечностей;
- снижение чувствительности и.т.д.
При попадании на поверхность кожи вызывает дерматит с язвами, а также сопровождается повышением температуры и высоким уровнем лейкоцитов в крови.
Первая помощь пострадавшему. Лечение
Если пациент имел неосторожность попасть себе в глаза средством на основе этилена, необходимо тщательно и продолжительное время промывать глаза большим количеством чистой воды, затем обратиться к врачу.
При попадании этого реагента на кожу в срочном порядке надо очистить поверхность ватным тампоном, смоченным в спирту. После обильно промыть пораженный участок кожи водой с мылом и обработать ланолином.
В более тяжелых случаях отравления пациенту нужны:
- свежий воздух;
- покой и тепло;
- ингаляции кислородом;
- витамины В1, В6, В12 и кальций;
- обильное щелочное питье;
- капельницы на основе глюкозы с аскорбиновой кислотой;
- кофеин и кордиамин.
Стерилизация при помощи окиси этилена
Оксид этилена очень популярен как средство стерилизации. Первый раз оксид этилена как обеззараживающий газ начали использовать в сороковых годах прошлого века. Благодаря тому, что вещество было в газоподобной форме, оно хорошо проникало в упаковки с медицинскими инструментами и убивало микроорганизмы. Такой метод использовали для большинства средств, которые были чувствительны к высоким температурам, влажности и токсичности. Так как оксид этилена относится к ядовитым газам, стерилизацию проводят в плотно закрытых камерах.
Такой метод дезинфекции считается лучшим из всех известных нам способов. Обработка инструментов данным способом состоит из трех шагов:
- Сначала инструменты продувают воздухом, изменяя температуру и влажность.
- Упаковку наполняют газом окиси этилена и ждут некоторое время, чтоб медицинские инструменты прошли стерилизацию.
- Проводят дегазацию, чтобы убрать из упаковки остатки агрессивного газа.
Гидратация окиси этилена
Окись этилена применение находит, главным образом, в создании разнообразных этиленгликолей. Гидратацию окиси этилена в жидком состоянии проводят либо в присутствии кислот катализаторов при температуре +50-100 градусов, либо под давлением без ускорителя при температуре +200 о С. Чаще всего используют второй способ, применяя давление, так как от некоторых кислот тяжело впоследствии очистить полученное вещество, и приходится применять дополнительные способы по очистке.
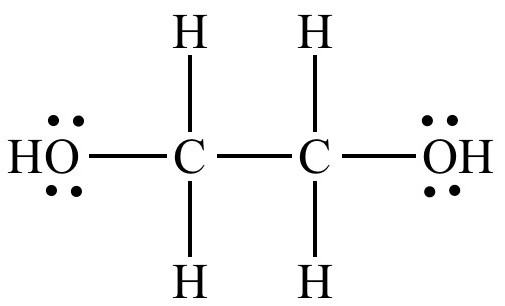
После гидратации получают этиленгликоль — простейший двухатомный спирт. По консистенции напоминает масло. Этиленгликоль без запаха и цвета, имеет сладковатый вкус. Является токсичным веществом, которое используют в моющих средствах. Некоторые уникумы пытаются его использовать как заменитель алкоголя, что приводит к летальному исходу.
Кроме того, что этиленгликоль используют для создания моющих средств, также он входит в состав и других продуктов:
- антистатиков;
- полиролей;
- средств от обледенения;
- добавляют в системы охлаждения компьютеров и автомобилей;
- в небольшом количестве используют в кремах для обуви;
- с помощью него делают взрывчатые вещества.
Действие этиленгликоля на организм
Этиленгликоль часто используют в процессе обработки помещений или зданий с большой площадью, а в результате нанесения средств, предназначенных для мытья, происходит вдыхание паров. При неосторожном использовании вещество может попасть в рот, однако этого мало для отравления. Большую вероятность отравиться получают те, кому подолгу службы приходится часто сталкиваться с веществами, содержащими этиленгликоль. В эту категорию входят водители и работники химических заводов.
Признаки отравления
- Начальный период длится 12 часов и проявляется легким опьянением человека. Изредка проявляется головная боль, тошнота, периодическая рвота, легкая слабость. При этом от человека может исходить легкий сладковатый аромат. Но в целом самочувствие нормальное.
- Спустя двенадцать часов мнимого хорошего самочувствия возникают ощущение передвижения в пространстве собственного тела, боль в голове, приступы тошноты и нарушение натрий-кальциевого обмена, рвота. Живот и поясничные мышцы начинают остро колоть.
- Немногим позже себя проявляют признаки поражения ЦНС: потеря сознания, повышение температуры, судороги.
- На пятые сутки развивается почечная недостаточность, отек легких, нарушается работа сердца и снижается артериальное давление.
- Смерть наступает в течение недели из-за сердечной недостаточности, отека легких и проблем в работе почек и печени.
Легкое отравление проявляется после вдыхания паров и характеризуется головокружением, тошнотой и слабостью. Чтобы спасти пострадавшего, необходимо обратиться в больницу до того, как истекут 12 часов после отравления.
Источник