Методы получения коллоидных систем: диспергационные и конденсационные методы (физическая конденсация, конденсация из паров и химическая конденсация). Условия получения коллоидных систем.
Образование дисперсных систем возможно двумя путями: диспергационным и конденсационным.
Диспергирование – это тонкое измельчение твёрдого тела или жидкости, в результате которого образуются дисперсные системы.
Лиофобные коллоидные системы получают путём дробления крупных кусков вещества до частиц коллоидных размеров. Распространённым методом диспергирования является удар или истирание твёрдых тел. Измельчение осуществляется с помощью шаровых и коллоидных мельниц.
Часто для получения коллоидных систем применяют диспергирование ультразвуком. При прохождении звуковой волны с частотой 20000 Гц в системе возникают местные, быстро чередующиеся сжатия и расширения веществ, которые и приводят к их разрушению
Конденсационные методы – это способы получения коллоидных систем путём объединения (конденсации) молекул и ионов в агрегаты коллоидных размеров. При этом система из гомогенной превращается в гетерогенную. Конденсационные методы классифицируют по природе сил, вызывающих конденсацию, на физическую конденсацию и химическую конденсацию.
Физическая конденсация осуществляется при понижении температуры газовой среды, содержащей пары различных веществ, пар становится пересыщенным и частично конденсируется, образуя дисперсную фазу.
При получении коллоидных систем путём химической конденсации вещество, образующее дисперсную фазу, получается в результате химической реакции. Чтобы в ходе химической реакции образовалась коллоидная система, нужно выполнить следующие условия проведения реакции:
1) вещество дисперсной фазы должно быть нерастворимо в дисперсионной среде;
2) скорость образования зародышей кристаллов дисперсной фазы должна быть гораздо больше, чем скорость роста кристаллов;
3) одно из исходных веществ должно быть взято в избытке, так как именно это вещество является стабилизатором коллоидных частиц.
Восстановление. Важнейшим химическим методом является восстановление в отсутствии или в присутствии высокомолекулярных веществ.
6. Пептизация. Адсорбционная пептизация. Пептизация путѐм поверхностной диссоциации. Пептизация путѐм промывания осадка.
Пептизацией (физико-химическим дробление осадков) называют расщепление на первичные частицы под действием внешней среды агрегатов, возникающих в результате обратимой коагуляции дисперсных систем. В коллоидной химии пептизацией называется перевод свежеприготовленных рыхлых осадков в коллоидный раствор. Иначе говоря, это распад агрегатов частиц в дисперсных системах, т. е. процесс обратный коагуляции Происходит пептизация при помощи электролитов или ПАВ (пептизаторов). Иногда возможно протекание пептизации и при повышении температуры, при удалении коагулянтов в ходе промывания осадка и т. п.
Существует несколько разновидностей пептизации:
адсорбционная пептизация происходит при физической адсорбции молекул или ионов пептизатора на поверхности частиц, входящих в состав крупных агрегатов. Адсорбционные слои сольватированных молекул или ионов раздвигают частицы, ослабляют их притяжение
друг к другу, и в результате перемешивания стабилизированные пептизатором частицы переходят в коллоидный раствор.
Пептизация под действием ПАВ. При адсорбции молекул ПАВ на поверхности мельчайших частиц происходит ослабление их связей со средой, а также друг с другом, что облегчает удаление этих частиц при перемешивании водной среды.
Химическая (диссолюционная) пептизация— получение золя при действии на осадок реагента, который химически реагирует с ним. В этом случае часть молекул вещества осадка взаимодействует с ним с образованием растворимого соединения, которое, собственно, и будет играть роль пептизатора.
Пептизация при отмывании осадка может происходить при промывании на фильтре свежеприготовленных осадков. Её причиной является удаление избытка электролита, вызывающего объединение частиц осадка.
Правило осадка. При постоянном содержании пептизатора с возрастанием количества взятого осадка количество образующегося золя сначала увеличивается, а затем уменьшается
Источник
Конденсационные методы получения коллоидных систем
Образование коллоидных систем в результате конденсации рассматривают как процесс кристаллизации, а коллоидные частицы – как мельчайшие кристаллики. Образование кристалликов протекает в несколько стадий:
— возникновение зародышей (центров кристаллизации) по всему объему раствора. Центры кристаллизации могут возникнуть только в пересыщенных растворах;
— рост зародышей до крупных кристаллов. Причем, скорость образования зародышей должна быть больше скорости роста кристаллов, так как при этом образуется множество кристалликов с размерами коллоидных частиц. Этого можно добиться, если использовать сильноразбавленные растворы. Если скорость роста кристаллов будет больше скорости образования центров кристаллизации, то образуются крупные кристаллы и выпадение их в осадок;
— стабилизация частиц ДФ. Происходит за счёт образования ионов или их введения.
Конденсационные методы делятся на химические и физические.
Физические методы конденсирования связаны с изменением химической при-роды среды (замены растворителя) или условий (температуры, давления) существования раствора и созданием таких условий, при которых один из компонентов системы становится нерастворимым в другом.
Физическая конденсация осуществляется двумя способами: заменой растворителя и конденсацией паров.
Метод замены растворителя основан на выделении растворенного вещества из раствора в виде высокодисперсной нерастворимой фазы в результате замены летучего растворителя. При замене дисперсионной среды, из-за плохой растворимости в новой дисперсионной среде, частицы начинают конденсироваться в более крупные частицы. Например, при постепенном добавлении воды к спиртовому раствору канифоли, молекулы канифоли оказываются в чужеродном окружении молекул воды и они вытесняются из их окружения (молекулы воды сильнее притягиваются между собой, чем с молекулами канифоли) и объединяются в более крупные частицы. И таким образом образуются устойчивые коллоидные системы, например, гидрозоли серы, фосфора, канифоли, некоторых лекарств (карвалола, валерьяны и др).
Метод конденсации паров осуществляется при охлаждении системы. В природе по этому методу образуются туманы, облака, а в промышленности – органозоли. В лабораторных условиях для получения золей для медицины и биологии исполь-зуется метод Рогинского-Шальникова, основанный на одновременной конденса-ции паров диспергируемого вещества и растворителя на холодной поверхности.
Дата добавления: 2016-01-09 ; просмотров: 796 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Методы получения коллоидных растворов



Методы получения и исследования дисперсных систем
Лекция 8
Для получения коллоидных растворов необходимо: 1) достичь коллоидной степени дисперсности; 2) подобрать дисперсионную среду, в которой нерастворимо вещество дисперсной фазы; 3) подобрать третий компонент — стабилизатор, сообщающий коллоидной системе устойчивость.
Образовывать коллоидные растворы в воде могут металлы, малорастворимые в ней оксиды, гидроксиды, кислоты, соли. Хорошо растворимые в воде вещества, но малорастворимые в неполярных органических растворителях не способны образовывать гидрозоли, но могут образовывать органозоли. Так, например, не возможно получить гидрозоль натрия хлорид, но возможно получение его коллоидного раствора в бензоле. И наоборот, можно легко получить гидрозоль камфоры, практически нерастворимой в воде, но невозможно получить ее коллоид в спирте, поскольку камфора хорошо растворима в этом растворителе.
В качестве стабилизаторов используют вещества, препятствующие агрегации коллоидных частиц в более крупные и выпадению их в осадок. Таким действием обладают: небольшой избыток одного из реагентов, из которых получается вещество дисперсной фазы, ПАВ, белки, полисахариды и др.
По размеру частиц дисперсной фазы коллоидные системы (d ≈10 -7 — 10 -9 м ) занимают промежуточное положение между микрогетерогенными (грубодисперсными) системами (d >10 -7 м ) и истинными растворами, (размер растворенных частиц d -9 м ) низкомолекулярных веществ. По способу достижения коллоидной степени дисперсности различают методы (рис. 12.1): диспергационные (от лат.disper-
| Грубодисперсная система | Коллоидно-дисперсная система | Истинный раствор |
| d>l(r 7 M | 10- 7 M10- 9 | d 9 M |
| ДИСПЕРГИРОВАНИЕ | КОНДЕНСИРОВАНИЕ |
Увеличение степени измельчения
Рис.12.1 Способы достижения коллоидной степени дисперсности gire — измельчать) — получение частиц дисперсной фазы путем дробления более крупных частиц и конденсационные (от лат. condensire — укрупнять) — получение частиц дисперсной фазы путем объединения атомов, молекул, ионов
Методы диспергирования. Для измельчения жидкостей и твердых тел необходимо совершить работу. Эта работа тем больше, чем меньше размер частиц дисперсной фазы. Энергия, расходуемая при диспергировании, идет на преодоление молекулярных сил притяжения и на увеличение межфазной поверхности
Для достижения требуемой степени дисперсности применяют механическое дробление, ультразвуковое, электрическое и химическое диспергирование.
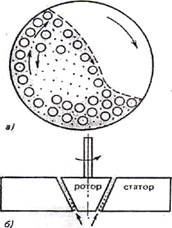
Механическое дробление осуществляют с помощью шаровых и коллоидных мельниц в присутствии жидкой дисперсионной среды и стабилизатора. Схема шаровой мельницы представлена на рис. 12.2, а. Шары измельчают материал дисперсной фазы при вращении за счет раздавливания, раскалывания и истирания.
Измельчение с помощью ультразвука происходит под действием источника ультразвуковых колебаний на смесь нерастворимых друг в друге жидкостей или твердого тела с жидкостью.
Электрическое диспергирование используют для получения золей металлов. К электродам, изготовленным из диспергируемого металла и опущенным в подщелоченную воду, подводят постоянный электрический ток и сближают электроды до образования электрической дуги. Металл, из которого изготовлены электроды, при этом превращается в пар, конденсирующийся в жидкой среде в золь. При получении органозолей (дисперсионная среда органический растворитель) применяют высокочастотный искровой заряд.
Химическое диспергирование, или пептизация, заключается в химическом воздействии на осадок.
Конденсационные методы. Взаимодействие ионов и молекул с образованием частиц коллоидных размеров может быть достигнута физическими и химическими методами.
Физическая конденсация имеет в своей основе физические методы воздействия. Чаще всего для получения золей используют метод замены растворителя. Вначале готовят истинный раствор вещества в летучем растворителе (например, канифоли в спирте) и добавляют к жидкости, в которой вещество нерастворимо (например, к воде). Летучий растворитель удаляют нагреванием. В результате происходит резкое понижение растворимости. Молекулы вещества конденсируются в частицы коллоидных размеров и образуется коллоидный раствор.

При химической конденсации для получения коллоидных растворов используют любые реакции, в результате которых образуются труднорастворимые соединения:
Источник
Конденсационные методы



Дисперсные системы
Дисперсными называют системы, в которых одно вещество (дисперсная фаза) равномерно распределено в другом веществе (дисперсионная среда).
Классификация дисперсных систем
По размеру частиц дисперсной фазы(d)дисперсные системы делятся на грубодисперсные, коллоидные и истинные растворы.
| Грубодисперсные (ГД) | Коллоидные растворы | Истинные растворы |
| d > 10 -7 м | d=10 -7 — 10 -9 м | d -9 м |
| Взвесь глины, мела в воде, эмульсия жира в молоке | Вирусы, гемоглобин крови, нервные клетки, протоплазма | Растворы солей, кислот, оснований, глюкозы |
Классификация коллоидных растворов
1. По агрегатному состоянию фаз
| Агрегатное состояние дисперсионной среды и тип системы | Агрегатное состояние дисперсной фазы условное обозначение | Название системы | Пример |
| Жидкость Лиозоли | Твердое Т/Ж Жидкость Ж/Ж Газ Г/Ж | Золи, суспензии Эмульсии Пены | Золи металлов Молоко, смазки Мыльная пена |
| Газ Аэрозоли | Твердое Т/Г Жидкость Ж/Г Газ Г/Г | Аэрозоль Аэрозоль – | Дым, пыль Туман, облака – |
| Твердое Солидозоли | Твердое Т/Т Жидкость Ж/Т Газ Г/Т | – Твердые эмульсии Твердые пены | Сплавы Почва, жемчуг Пемза, уголь активированный |
2. По характеру взаимодействия фазы и средысистемы бывают лиофобными и лиофильными, если дисперсионная среда – вода, то соответственно – гидрофобными и гидрофильными.
В лиофобных системах частицы фазы слабо взаимодействуют или не взаимодействуют со средой. Эти системы необратимы и термодинамически неустойчивы. Примеры: гидрозоли серебра, золота, хлорида серебра AgCl.
В лиофильных системах взаимодействие частиц фазы со средой достаточно сильное, т.е. частицы фазы сильно сольватированы (гидратированы). Такие системы являются термодинамически устойчивыми и обратимыми (восстанавливаются при добавлении растворителя после его испарения). Примеры: растворы белков, полисахаридов, нуклеиновых кислот в воде.
2.2. Методы получения
коллоидных растворов
Коллоидные растворы (золи) можно получить:
1) из грубодисперсных систем путем диспергирования (измельчения)частиц дисперсной фазы – это диспергационныеметоды;
2) из истинных растворов путем конденсации (укрупнения)частиц – конденсационныеметоды.
Методы диспергирования
1. Механическое дробление в шаровых и коллоидных мельницах.
2. Измельчение под действием ультразвука.
3. Электрическое диспергирование.
Перечисленные методы используются для получения золей металлов, полимеров (крахмала, каучука, нитроцеллюлозы), при производстве лекарственных препаратов, краски, цемента и т.д.
4. Пептизация – перевод свежеполученного осадка в золь под действием пептизатора-стабилизатора.
Пример: расщепление сложных белков на более простые под действием пепсина, получение гидрозоля из осадка Fe(OH)3 под действием пептизатора FeCl3.
Конденсационные методы
1.Физическая конденсация заключается в замене растворителя (дисперсионной среды).
Пример: раствор NaCl в воде – истинный раствор, в бензоле – коллоидный раствор.
См. опыт 1, стр. 45. Получение золя канифоли.
2. Химическая конденсация – получение золей в химической реакции (гидролиза, окислительно-восстановительной, обменной) при следующих условиях:
1) образование труднорастворимого вещества;
2) наличие стабилизатора (избыток одного из реагентов, ПАВ);
3) малые концентрации растворов (для получения d частиц 10 -7 -10 -9 м).
2.3. Методы очистки
коллоидных растворов
От грубодисперсных частиц очищают путем фильтрации. Коллоидные растворы проходят через фильтр, крупные частицы задерживаются.
От низкомолекулярныхпримесей коллоиды очищают методами диализа, электродиализа, ультрафильтрации, компенсационного диализа.
Диализ основан на свойстве полупроницаемых мембран задерживать коллоидные частицы и пропускать молекулы или ионы низкомолекулярных веществ в растворитель, циркулирующий в диализаторе.
Электродиализ – это ускоренный диализ под действием электрического тока (продолжительность диализа – недели, месяцы, электродиализа – минуты, часы).

Ультрафильтрация – это диализ под давлением или при разрежении. Этот метод широко используют для очистки воды, белков, нуклеиновых кислот, витаминов, для определения размеров вирусов.
Компенсационный диализ или вивидиализ – это очистка от части низкомолекулярных примесей. В диализаторе растворитель заменяется раствором низкомолекулярного вещества, которое необходимо оставить в коллоидном растворе.
Вивидиализ применяется для количественного определения веществ в биологических жидкостях. Например, содержание сахара в крови определяется диализом сыворотки крови по сравнению с физиологическим раствором, к которому добавляют различные количества сахара. Концентрация сахара во внешнем растворе не изменяется лишь в том случае, когда она равна концентрации свободного сахара в крови.
По принципу компенсационного диализа работает аппарат «искусственная почка» (АИП), применяемый при острых отравлениях, обширных ожогах, токсикозах для очистки крови (гемодиализа) от шлаков: мочевины, мочевой кислоты, билирубина и т.д. Внешним диализирующим раствором является физиологический раствор (0,85% NaCl).
2.4. Молекулярно-кинетические
свойства коллоидных растворов
Броуновское движение – хаотическое тепловое движение коллоидных частиц вследствие ударов о них молекул растворителя.
Интенсивность броуновского движения оценивается средним квадратичным проекции смещения частицы 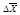

где КБ – константа Больцмана (1,38×10 -23 Дж/К), t – время (с), Т – температура (К), r – радиус частицы (м), h – вязкость среды (Н×с/м 2 ).
Благодаря броуновскому движению коллоидные частицы находятся во взвешенном состоянии, коллоидный раствор обладает кинетической устойчивостью.
Диффузия – самопроизвольный процесс выравнивания концентрации частиц во всем объеме раствора. Cкорость диффузии увеличивается с повышением температуры и уменьшением размера частиц и вязкости среды:

где D – коэффициент диффузии (м 2 /с), КБ – константа Больцмана (1,38×10 -23 Дж/К), Т – температура, r – радиус частицы (м), h – вязкость среды (Н×с/м 2 ).
Осмотическое давление коллоидных растворов подчиняется закону Вант-Гоффа:
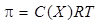


где n – число частиц в единице объема, NA – число Авогадро (6,02 ×10 23 молекул).
Из-за большого размера и малой концентрации коллоидных частиц осмотическое давление коллоидных растворов значительно меньше осмотического давления истинных растворов.
Седиментационное равновесие – это протекание противоположных процессов: диффузии и седиментации. Седиментация – оседание частиц под действием силы тяжести. По закону Стокса на частицу действуют сила тяжести и сила трения:
При оседании с постоянной скоростью Fтрения = Fтяжести. Из уравнения Стокса cледует, что скорость седиментации (u) прямо пропорциональна размеру частиц, разности плотностей дисперсной фазы и дисперсионной среды и обратно пропорциональна вязкости раствора.

где U – скорость седиментации (м/с), r – радиус сферической частицы дисперсной фазы (м), r и r0 –плотность дисперсной фазы и среды соответственно (кг/м 3 ), g – ускорение силы тяжести (9,8 м/с 2 ), h – вязкость (Н ×с/м 2 ).
Определение скорости седиментации лежит в основе седиментационного анализа, который используется:
1) для определения скорости оседания эритроцитов СОЭ (в норме у женщин – 3-12 мм/ч, у мужчин – 2-6 мм/ч);
2) для разделения на фракции центрифугированием компонентов клетки, крови, костного мозга;
3) для выделения белков, ДНК, вирусов.
2.5. Оптические свойства
коллоидных растворов
Оптические свойства коллоидных растворов существенно отличаются от свойств истинных растворов.
Размеры коллоидной частицы соизмеримы с длиной волны падающего света 2r » l. Частица становится вторичным источником света, в коллоидах наблюдается дифракционное рассеяние света. Визуально наблюдается опалесценция – различная окраска золей в проходящем свете (напротив источника света) и в рассеянном свете (сбоку). Это явление было обнаружено Фарадеем и Тиндалем:
При боковом освещении коллоидного раствора хорошо виден светящийся конус Тиндаля.
Интенсивность светорассеяния количественно выражается уравнением Рэлея

где I, I0 – интенсивность рассеянного и падающего света (Вт/м 2 ), КР – константа Рэлея, n – число частиц в 1 м 3 , V –объем частицы (м 3 ), l – длина волны падающего света (м).
Из уравнения Рэлея следует, что I рассеянного света обратно пропорциональна l 4 (I
1/l 4 ), следовательно, сильнее всего рассеиваются волны синей и фиолетовой части спектра (окраска золя в рассеянном свете). Незначительное рассеивание красного и желтого цветов объясняет окраску коллоидного раствора в проходящем свете.
Явление светорассеяния лежит в основе работы ультрамикроскопа, применяемого для определения размеров частиц плазмы, сыворотки крови, лимфы, вакцин и для контроля чистоты инъекционных растворов.
Строение мицеллы
Мицелла – это сложная коллоидная частица. Основой мицеллы является электронейтральный агрегат – совокупность атомов или молекул труднорастворимого вещества.
Коллоидная частица образуется только при избытке одного из реагентов, т.е. в присутствии стабилизатора. На поверхности агрегата избирательно адсорбируются потенциалопределяющие ионы (ПОИ) по правилу Панета – Фаянса (в данном случае – ионы I — ), в результате чего агрегат приобретает заряд. Агрегат и ПОИ образуют ядро мицеллы.
С заряженной поверхностью ядра устойчиво связано некоторое количество ионов противоположного знака – противоионов (в данном примере – ионы К + ). ПОИ и часть противоионов формируют адсорбционный слой. Агрегат вместе с адсорбционным слоем называют гранулой.
Знак заряда гранулы определяется знаком потенциалопределяющих ионов (ПОИ). Заряд гранулы компенсируют остальные противоионы, образующие подвижный диффузный слой. Диффузный слой насыщен молекулами растворителя.
Источник










