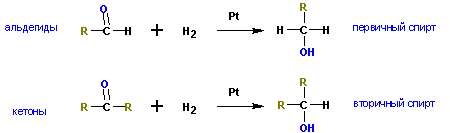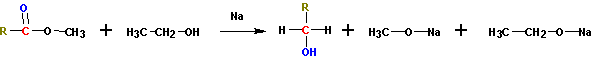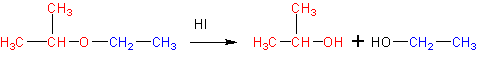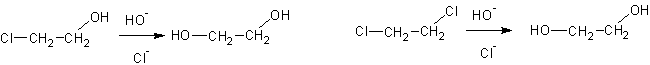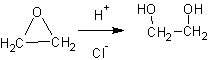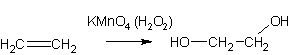Общий способ получения спиртов
Tомский государственный университет
кафедра органической химии
Кислородсодержащие соединения. Спирты
Строение и классификация спиртов
Спиртами называют производные углеводородов, содержащие вместо одного или нескольких атомов водорода одну или несколько гидроксигрупп (- OH ). Общая формула спиртов, таким образом, R — OH .
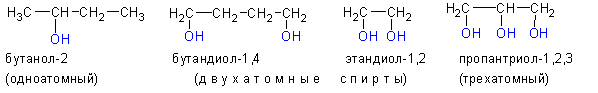
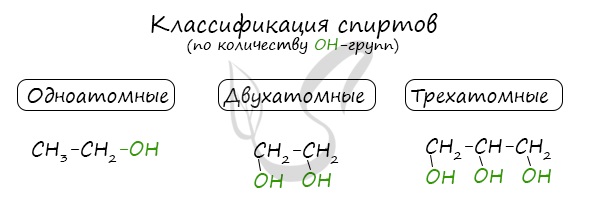
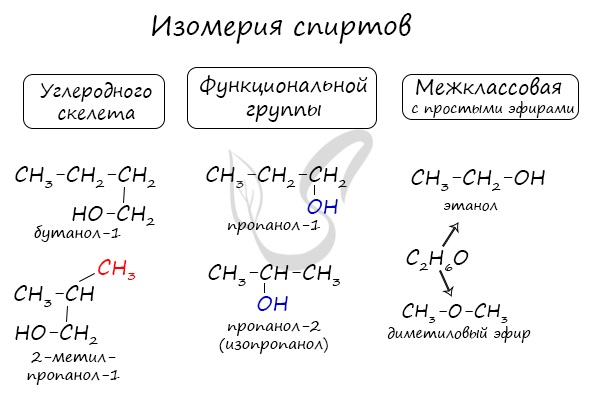
1. По числу гидроксильных групп в молекуле спирты разделяют на одноатомные , двухатомные , трехатомные и т.д. до многоатомных .
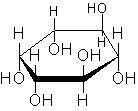
Среди многоатомных спиртов наиболее известен шестиатомный циклический спирт инозит :
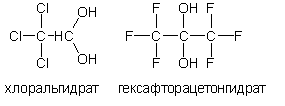
Двухатомные спирты (диолы) с гидроксилами у одного атома углерода (геминальныедиолы) . Нестабильны в индивидуальном состоянии. Обнаруживаются в незначительных количествах только в водных растворах. Наиболее устойчивы двухатомные спирты (существует исключительно в растворе) хлоральгидрат CCl 3— C (OH)2 и гексафторацетонгидрат (CF 3) 2 C ( OH )2:
2. По строению углеводородной цепи спирты разделяют на предельные (насыщенные спирты) и непредельные .
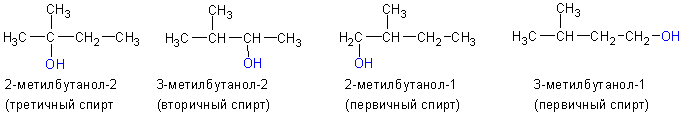
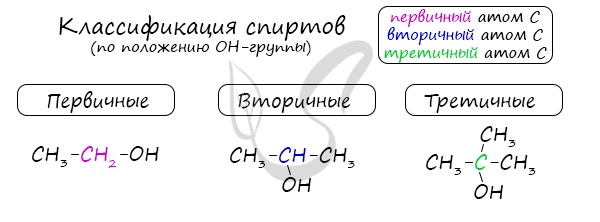
3. По положению гидроксильной группы в цепи различают первичные, вторичные и третичные спирты:
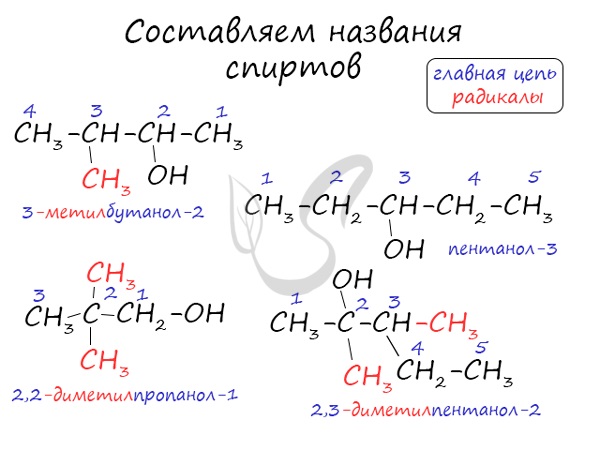
При наименовании спиртов по номенклатуре IUPAC находят самую длинную цепь атомов углерода, содержащую гидрокисльную группу, и нумеруют ее с края, к которому ближе гидроксильная группа. После перечисления заместителей добавляется название, соответствующее углеводороду главной цепи с добавлением окончания –о л и цифры, показывающей место гидроксильной группы в цепи (см. примеры выше).
Заместительная номенклатура используется достаточно редко. По ней спирты называют, как производные карбинола (метанола). Например, фенилкарбино л — бензиловый спирт (оксиметилбензол ), этилкарбинол — пропиловый спирт (или пропанол ), винилкарбинол — пропен-2-ол-1, или аллиловый спирт.
Тривиальная номенклатура , напротив, до сих пор широко применяется. Метанол (метиловый спирт, муравьиный спирт), пропиловый спирт, группа амиловых спиртов (С5) и т.д. Не говоря уже о непредельных спиртах, которые практически только и называются тривиальными названиям и- аллиловый и пропаргиловый спирты (см. выше).
Одноатомные спирты-жидкости с характерным запахом, начиная с метанола (С 1 ) и до нонанола (С9). Высшие спирты запаха практически не имеют. Группа спиртов С4-С5 имеет характерный запах сивухи, а сами они носят неофициальное определение сивушных спиртов или масел. Двухатомные спирты с гидроксилами у разных атомов водорода обладают гораздо большей температурой кипения и вязкостью, чем одноатомные спирты. Этиленгликоль (Ткип=197 о С ), глицерин (Ткип=290 о С , разложением), бутандиол-1,4 (Ткип=213 о С ). Температуры кипения многоатомных спиртов гораздо выше, чем у одноатомных (а у одноатомных спиртов температуры кипения гораздо выше, чем у соответствующих алканов) по причине образования межмолекулярных водородных связей. Шестиатомный спирт инози т- твердое кристаллическое соединение.
Химические свойства спиртов
1. Реакции дегидратации спиртов (внутри- и межмолекулярная дегидратация)
При кипячении с кислотами спирты могут образовывать алкены и простые эфиры.
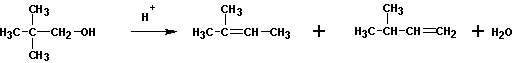

Как правило, получаются смеси продуктов. Преобладание того или иного соединения связано с условиями проведения реакции. Так, при повышении температуры выход алкенов увеличивается. Выходы алкенов также возрастают при переходе от первичных к третичным спиртам. Очень часто перечисленные реакции сопровождаются перестройками в углеродном скелете:
Образование простых эфиров (межмолекулярная дегидратация спиртов).
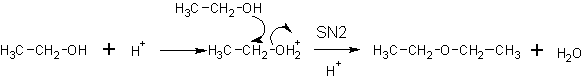
В присутствии серной кислоты:
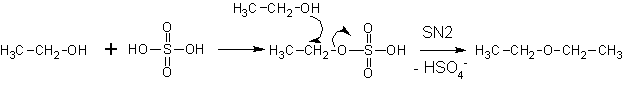
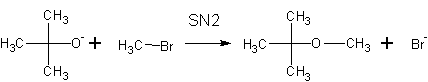
Более предпочтительно получение простых эфиров по реакции Вильямсон а — (суть- нуклеофильные замещения у атома углерода).
Пример получения метил-третбутилового эфира (МТБЭ) реакциями:
При неправильном выборе сочетания реагентов в реакции Вильямсона вместо ожидаемого эфира можно получить алкен . Реакции нуклеофильного замещения с образованием эфира способствует реакция крупного основания и мелкого галогенида, неспособного к элиминированию:
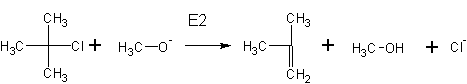
2. Образование галоидных алкилов из спиртов происходит при реакции с различными реагентами:
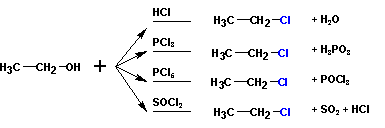
Во всех случаях наиболее гладко протекают реакции с первичными спиртами, третичные спирты чаще дают различные побочные продукты.
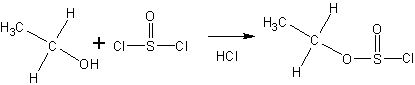
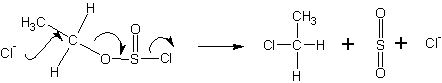
Механизмы галогенирования спиртов тионилхлоридом ( SOCl 2 ) и галогенидами фосфора
Тионилхлорид образует со спиртами эфиры хлорсернистой кислоты (хлорсульфиты ):
При этом генерируется некоторое (заметное) количество анионов хлора.
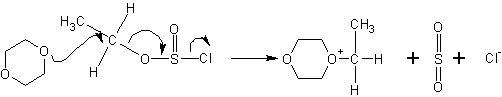
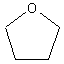
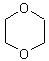
Дальнейшее течение реакции зависит от типа растворителя, в котором она протекает. В случае диоксана , например, происходит сольватация хлорид-ионов и атака диоксаном :
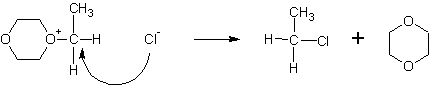
Полученное промежуточное соединение атакуется повторно анионами Cl- с противоположной стороны, в результате чего не происходит обращения оптической конфигурации (если сравнивать с исходным спиртом):
Однако, в таких растворителях, как пиридин или гексаметилфосфотриамид (НМРТ), концентрация свободных ионов хлора достаточно велика, чтобы атаковать эфиры хлорсульфита с образованием галогенпроизводных спирта с обращенной конфигурацией:
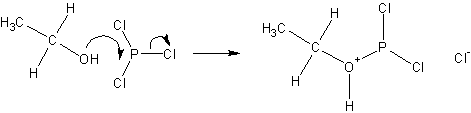
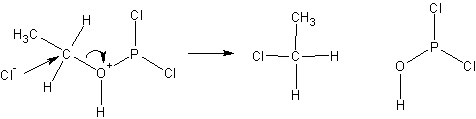
Реакции с галогенидами фосфора протекают с обращением конфигурации согласно ниже приведенной схеме;
После чего хлорид ио н- замещает группировку с атомом фосфора:
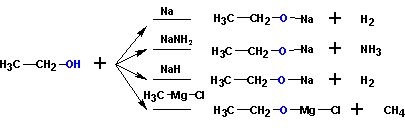
3. Кислотные свойства спиртов
При взаимодействии с сильными основаниями и щелочными металлами спирты ведут себя как кислоты:
4. Окисление спиртов
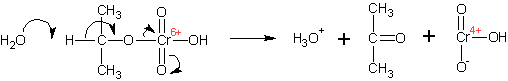
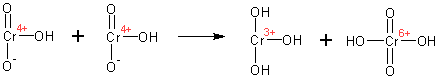
Спирты окисляются различными окислителями до альдегидов (первичные спирты) и кетонов (вторичные спирты). Механизм окисления спиртов хромовой кислотой:
Образующиеся вначале эфиры хромовой кислоты претерпевают отщепление протона от атома углерода, при котором стояла гидроксильная группа (вследствие повышения его кислотности в результате образования эфира, он отщепляется даже таким слабым основанием, как вода):
Образуется продукт окисления и хромистая кислота ( Cr IV ). Хромистая кислота быстро диспропорционирует до гидроокиси хрома ( Cr III ) и хромовой кислоты ( Cr VI ):
Если таким образом окисляются вторичные спирты, то образующиеся кетоны сравнительно устойчивы, однако, при окислении первичных спиртов образуются альдегиды, которые легко окисляются дальш е- до карбоновых кислот (если не предпринимать меры предосторожности). Альдегиды с небольшим числом атомов углерода можно выделить из реакционной смеси отгонкой в процессе получения, однако, для более тяжелых альдегидов такой способ не помогает.
Окисление спиртов реагентом Саретта ( Sarett )- смесью хромового ангидрида и пиридина позволяет выделять альдегиды.
Третичные спирты в нейтральной и щелочной среде окисляются с трудом и с разрушением углеродного скелета. В кислой среде окисляется предварительно образовавшийся алкен , углерод-углеродная связь рвется по месту кратной связи (см. алкены ). Если не удалять из реакционной среды образовавшиеся альдегиды, окисление идет дальше и образуются карбоновые кислоты:
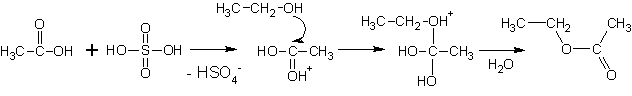
5. Образование сложных эфиров
Сложные эфиры образуются при реакции спиртов с минеральными и органическими кислотами.
(Реакции протекают при умеренном нагревании, кислотный катализ).
6. Образование ацеталей и полуацеталей
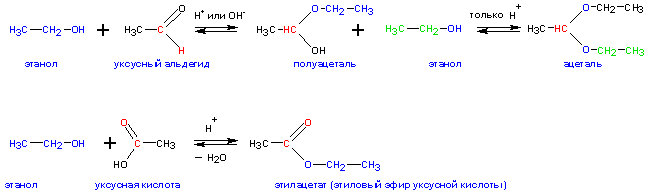
Спирты взаимодействуют с альдегидами и кетонами— с образованием полуацеталей и ацеталей (альдегиды) и полукеталей и кеталей (кетоны):
Реакции образования ацеталей и полуацеталей используются в синтетической практике для временной защиты альдегидных групп (чтобы не допустить их окисления). Ацетали и полуацетали широко распространены в природе. Альдегидные группы регенерируются в кислой среде. В нейтральной и щелочной среде ацетали устойчивы .
Ацетали представляют собой жидкости с приятным эфирным запахом.
Способы получения спиртов
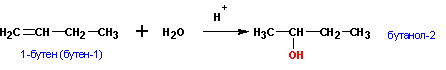
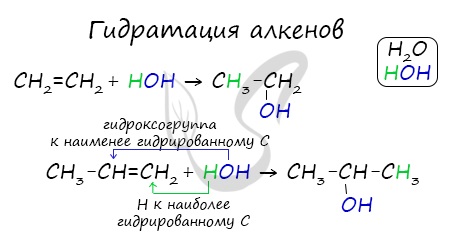
1. Гидратация алкенов (правило Марковникова):
Алкены присоединяют воду в кислой среде по механизму электрофильного присоединения, по правилу Марковникова. (через промежуточное образование карбкатионов , см. химические свойства алкенов).
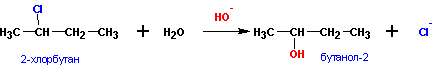
2. Гидролиз галоидных алкилов :
а) обратимый гидролиз в кислой среде;
б) необратимый гидролиз в щелочной среде:
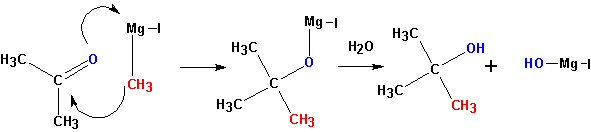
3. Взаимодействие металлорганических соединений (реактивы Гриньяра ) с карбонильными группами (нуклеофильное присоединение по кратной связи С =О):
Взаимодействие с формальдегидом, альдегидами, кетонам и — получение первичных, вторичных и третичных спиртов.
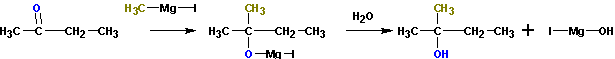
Из кетонов получаются третичные спирты. Так, из метилэтилкетона (бутанон-2) получается 2-метилбутанол-2. Альдегиды в подобной реакции дают вторичные спирты. Из пропионового альдегида (пропаналь ) получается бутанол-2:
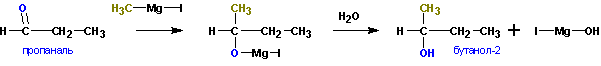
Из формальдегида образуются первичные спирты.
Взаимодействие реактивов Гриньяра со сложными эфирами карбоновых и муравьиной кислот ы- приводит к получению третичных и вторичных спиртов, соответственно.
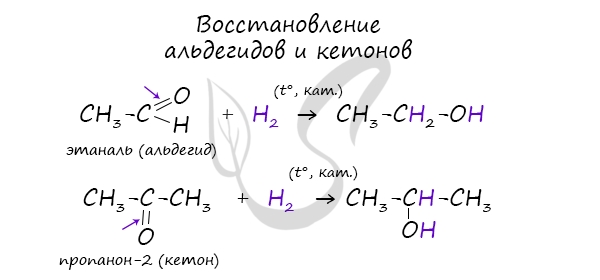
4 . Восстановление альдегидов, кетонов
Менее распространены способы получения спиртов восстановлением альдегидов и кетонов.
5. Восстановление сложных эфиров ( каталитические и некаталитические).
Получение спиртов восстановлением сложных эфиров по Буво-Блану (кипячение с натрием).
6. Расщепление простых эфиров HJ и HBr
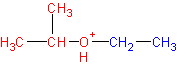
Реакция представляет собой нуклеофильное замещение в алкил оксонии :
который образуется в кислой среде из эфира в результате протонирования атома кислорода. В качестве эффективного нуклеофила в кислой среде с успехом выступает иодид-ион , который атакует соседний с кислородом стерически менее затрудненный вторичный атом углерода . В итоге образуются изопропанол и иодистый этил . Иодистый этил в водной среде легко превращается в этанол , регенерируя катализатор- HJ .
Реакции двухатомных спиртов (отличные от первичных спиртов реакции).
1. внутримолекулярная дегидратация :
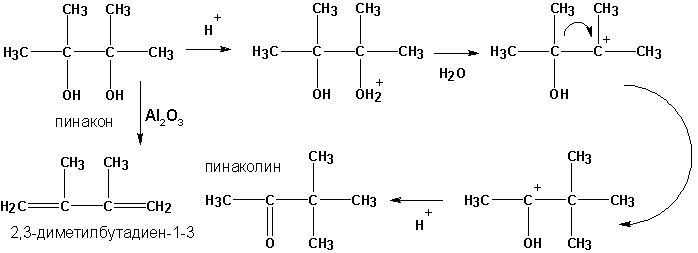
г) пинакон-пинаколиновая перегруппировка
д ) дегидратация пинаконов в присутствии окиси алюминия приводит к диенам:
а) образование спиртоэфиров
б) образование циклических эфиров:
Получение двухатомных спиртов
1. Гидролиз дигалогенпроизводных или хлоргидринов :
2. Гидратация альфа-окисей (эпоксидов ):
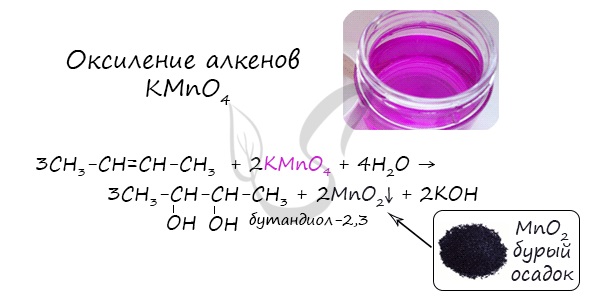
3. Окисление олефинов перекисью водорода или перманганатом (холодные растворы):
4. Каталитическое восстановление сложных эфиров дикарбоновых кислот:
Источник
Спирты
Спирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д.
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты.
Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
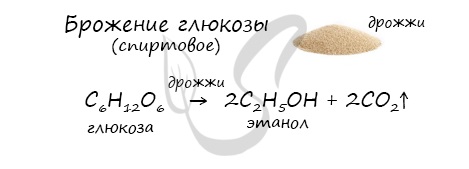
Получение этанола брожением глюкозы
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные.
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.
Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
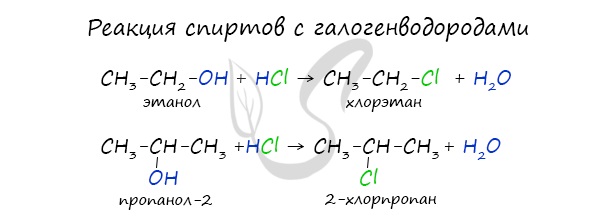
Реакция с галогеноводородами
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.
Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены.
Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
- Диметиловый эфир — CH3-O-CH3
- Метилэтиловый эфир — CH3-O-C2H5
- Диэтиловый эфир — C2H5-O-C2H5
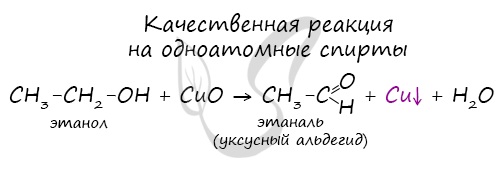
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
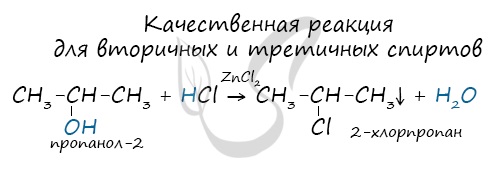
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
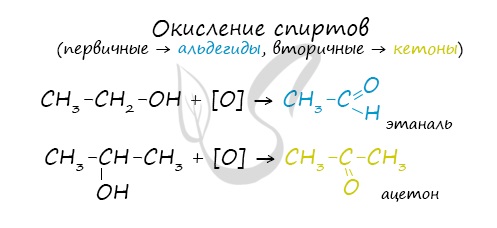
Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами.
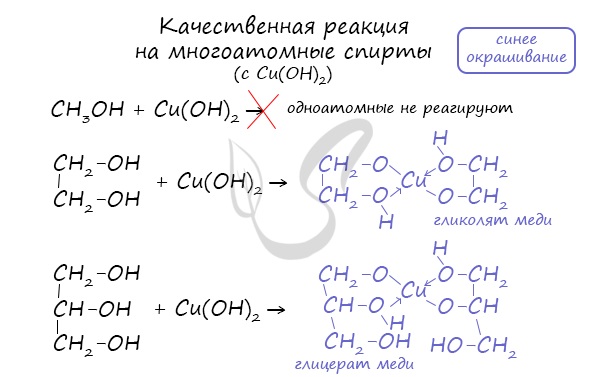
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
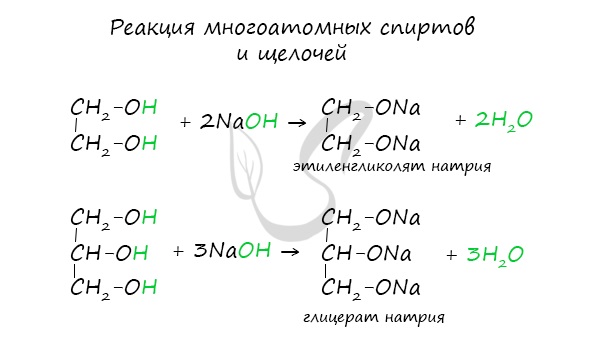
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник