- Конспект по теме «Основные способы получения металлов»
- Химия. 11 класс
- Общий способ получения металлов конспект
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Общая характеристика и способы получения металлов
- Пирометаллургия
- Гидрометаллургия
- Электрометаллургия
- Конспект урока на тему «Способы получения металлов»
Конспект по теме «Основные способы получения металлов»

ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ.
Металлургия — наука о промышленных способах получения
металлов из природного сырья.
I. Пирометаллургия — получение металлов из руд по реакциям восстановления
при высоких температурах.
Из оксидов Восстановители С, СО
ZnO + C°=Zn° + C&T металлы средней активности
Fe + 2b3 +3CO = 2Fe 0 + 3CO2 t и неактивные Восстановитель Н,
ЗМпЬ2 + 4А1 = ЗМп° + 2А1203 для Mn, Cr, Ti, Mo, W
Из сульфидов сульфиды -> оксиды => металлы
ZnO + С = Zn + СО Т
II. Гидрометаллургия — получение металлов из растворов их солей руда => раствор соли => металл
(для Си, Au, Ag, Zn, Mo, U и др.)
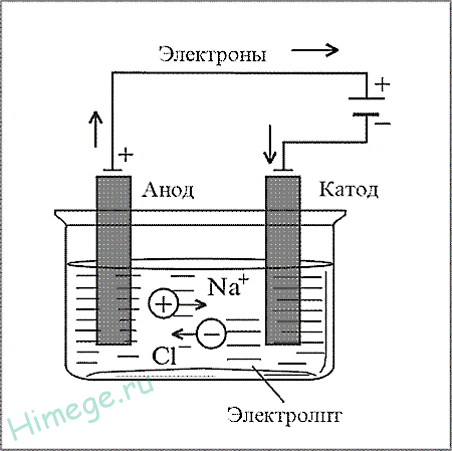
III. Электрометаллургия — получение металлов с помощью электрического тока (электролиз) — для активных металлов.
Электролизом называются окислительно-восстановительные реакции, протекающие на электродах, если через расплав или раствор электролита пропускают постоянный электрический ток.
Например, электролизом расплавов солей и щелочей получают щелочные и щелочноземельные металлы: 2NaCl = 2Na + Cl2 Катод: Nа + + ё = Na° Анод: 2СГ — 2 ё = Сl2 o
Источник
Химия. 11 класс
Конспект урока
Урок № 10. Общая характеристика и способы получения металлов
Перечень вопросов, рассматриваемых в теме: урок посвящён веществам, которые относят к группе металлов, и их взаимодействиям. В ходе урока школьники познакомятся с общими способами получения металлов.
Алюмотермией называют реакции, протекающие между оксидами металлов и алюминием, с образованием соответствующего свободного металла и оксида алюминия.
Гидрометаллургия — вытеснение металлов из руд с помощью растворов различных реагентов без применения высоких температур.
Катион – положительно заряженный ион, который притягивается к катоду в процессе электролиза.
Кристаллическая решётка вещества – это структура с геометрически упорядоченным расположением частиц (атомы, молекулы либо ионы) в определённых точках пространства.
Ко́вкость – способность металлов и сплавов подвергаться изменению при обработке давлением.
Магниетерми́я – метод металлотермии, процесс восстановления элементов из их оксидов, хлоридов, фторидов магнием.
Металлическая связь – химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов – алюминия, магния.
Пласти́чность — свойство твердых тел необратимо деформироваться при действии механических нагрузок.
Теплопрово́дность – способность материальных тел проводить энергию (теплоту) от более нагретых частей тела к менее нагретым частям тела, осуществляемому хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.).
Электро́лиз – физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ.
Эле́ктроотрица́тельность – количественная характеристика способности атома в молекуле смещать к себе общие электронные пары.
Электропроводность – способность тела или среды проводить электрический ток, определяющее возникновение в них электрического тока под воздействием электрического поля.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
На сегодняшний день известно 118 элементов, 96 из которых являются металлами. Открыты и исследованы они были в разное время.
Химические элементы по времени открытия
Источник
Общий способ получения металлов конспект
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Общая характеристика и способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.
В соответствии с этим существуют следующие способы получения металлов:
Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк)
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe 2 Fe 3 2)O4+ CO2
(Fe 2 Fe 3 2)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);
Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.
а) NaCl (электролиз расплава) → 2Na + Cl2
Источник
Конспект урока на тему «Способы получения металлов»
Способы получения металлов
Учитель: Мощенко Л.А.
Тема урока: способы получения металлов
Тип урока: Урок изучения нового материала.
Вид урока: Урок с использованием ИКТ, урок теоретических и практических самостоятельных работ, урок – беседа (смешанный урок)
ТДЦ обучить: умению характеризовать свойства, способы получения металлов, рассматривать реакции с точки зрения ТЭД и
окислительно – восстановительных реакций.
развить: дальнейшее развитие интеллектуальных умений и навыков, основных мыслительных процессов; развитие аналитико-
синтезирующего мышления – развитие умений классифицировать реакции, делать обобщающие выводы, развитие
умений применять знания при составлении уравнений реакции.
воспитать: продолжить формирование научного мировоззрения, личностных качеств, обеспечивающих успешность учебной
деятельности, (дисциплинированности, ответственности, деловитости, трудолюбия). Содействовать идейно
политическому воспитанию (работы Казахстанского ученого Сатпаева К.И)
Оборудование: таблица ПСХЛ, таблица растворимости, ряд активности металлов, CD «Виртуальная лаборатория» — «Металлы»
компьютер, интерактивная доска.
Литература: Н.Н. Нурахметов. «Химия. 9 класс. Учебник», 2013г. Н.Н, Нурахметов «Сборник задач и упражнений по химии». Н.Н, Нурахметов «Химия 9 класс. Рабочая тетрадь» методическая литература, «Книга для чтения по неорганической химии», «Дидактический материал».
СУМ (содержание учебного материала)
МО (методы обучения)
ФОПД (формы организации познавательной деятельности учащихся)
Уровень усвоения программного материала
Задания по развитию функциональной грамотности
Подготовка к внешней оценке учебных достижений
Индивидуально – коррекционная работа
Настрой на учебу. Мотивация на получение положительного результата
2 Воспроизведение ЗУН, необходимых для заданий
Сообщение учащимся цели и предстоящей работы
Подготовка к внешней оценке учебных достижений
Ученик – учитель – ученик
2 Виды коррозии
3 Способы защиты от коррозии
Репродуктивный. Частично поисковый
В теле человека содержится 4-5 г железа, 65% которого находится гемоглобине крови. Определить сколько граммов железа содержится в крови вашего организма
3 Изучение новой темы
Выполнение учащимися заданий и упражнений
2 Способы получения металлов
Физминутка Гимнастика для глаз
4Обсуждение доп-х ошибок коррекцияЗакрепление
Для получения чистых металлов используют водород. Каким способом получают вольфрам из оксида вольфрама
( V |) Напишите уравнение реакции, вычислите массу водорода, необходимую для получения 2 моль вольфрама
Практическое применение полученных знаний
Ионные уравнения реакции
Инструктаж о выполнении д/з
1 параграф 41 №7,8 стр 182
2 Выделить главное
3 Сделать вывод, уметь составлять реакции в молекулярном и ионном виде, электронно-ионном виде
Выучить параграф 41 №8,9
Металлы в природе, получение металлов.
Металлы встречаются в природе в виде соединений. Наименее активные металлы могут образовывать природные кристаллы – самородки ( Cu , Ag . Au . Pt ). Самые активные металлы, стоящие в ряду напряжений от лития до магния, распространены в природе в виде солей – хлоридов, сульфатов, карбонатов, силикатов.
Металлы средней активности – от Mg до Hg , наиболее часто встречаются в земной коре в виде оксидов и сульфидов, сульфатов, фосфатов, силикатов.
Минералы, пригодные для промышленного получения металлов, называются рудами
Если руды содержат соединения нескольких металлов, то они называются полиметаллическими (свинцово – цинковые руды).
Недра Казахстана богаты рудами металлов. Казахстанская земля содержит все элементы периодической системы, которые могут встречаться в природе. В горах Казахстанского Алтая обнаружено около 900 месторождений полиметаллических руд, поэтому его называют Рудным Алтаем. Уникальны месторождения Карагандинской области, где находится запасы руд меди, свинца, никеля, кобальта, алюминия, марганца и др. Горы Каратау хранят в своих недрах свинцовые, цинковые, ванадиевые, и железные руды.
Исследовали меторождения руд металлов в Казахстане известные ученые во главе с академиком К.И. Сатпаевым. Сатпаев Каныш Имантаевич (1899-1964) – первый президент Академии наук Казахстана, академик. Ученый составил металлогенетическую карту полезных ископаемых Казахстана.
Металлургия – это область науки, техники и производства, связанная с промышленным получением металлов из природного сырья.
Металлургия: черная и цветная.
Черная металлургия занимается производством железа и его сплавов, которые в промышленности называются черными металлами.
Производство всех остальных металлов, называемых цветными, является задачей цветной металлургии.
Крупные металлургические комбинаты: в Темиртау, и Актобе, Кокшетау. Соколовско – Сарбайский и Лисаковский горнообогатительные комбинаты . По запасам железной руды Казахстан занимает 8 место в мире.
Ведущая отрасль – цветная металлургия: в Усть – Каменогорске, Риддере, Шымкенте, Павлодаре, Балхаше и Жезказгане. Из извлекаемых руд производят медь, свинец, цинк, титан, магний и редко земельные металлы.
Казахстан является третьим среди государств СНГ производителем золота.
Основные способы получения металлов из руд, процессы обжига и плавки известны человечеству уже много веков. Сегодня в металлургической промышленности производят 75 видов металлов и десятки тысяч сплавов с различными свойствами.
Для авиационной и космической техники в больших количествах получают, магний, алюминий, титан. В современной технике применяют такие металлы как цирконий, бериллий, индий, гафний, ниобий и др.
Современная металлургия в зависимости от используемых методов выделения металлов подразделяется на пирометаллургию, гидрометаллургию, электрометаллургю.
1 Восстановление металлов при высокой температуре. Пирометаллургия
Восстановители: С, СО, Н 2 .
Cu 2 O + C = 2 Cu + CO Cu 2 O + CO = 2Cu + CO 2
2 Восстановление металлов более активными металлами. Металлотермия.
TiO 2 + 2 Mg = 2 MgO + Ti
3 Восстановление металлов из растворов их солей. Гидрометаллургия
4 Восстановление металлов электрическим током, получают металлы от лития до алюминия, из расплавов соединений, а остальные из растворов.
Металлургические процессы включают несколько стадий производства:
1 Измельчение руды
2 Обогащение руды (удаление пустой породы)
3 Агломерация (изготовление кусочков руды определенного размера)
4 Восстановление металла из руды
5 Очитка металла
6 Термическая обработка (закалка и отпуск металла)
7 Механическая обработка (прокатка, ковка, штамповка)
В основе всех металлургических процессов лежит восстановление металлов из руд с помощью различных восстановителей. Наиболее легко эти реакции протекают для неактивных металлов. Чем выше активность металла, тем труднее выделить его из руды.
Источник