- Простые вещества-неметаллы, их состав, строение, общие свойства и способы получения
- § 13. Простые вещества-неметаллы, их состав, строение, общие свойства и способы получения
- Химические свойства и получение неметаллов
- Неметаллы. Общая характеристика неметаллов. Получение и применение неметаллов. Химические свойства неметаллов.
Простые вещества-неметаллы, их состав, строение, общие свойства и способы получения
2. Взаимодействие неметаллов с водородом. Неметаллы взаимодействуют с водородом. Эти реакции — окислительно-восстановительные (водород является восстановителем), экзотермические. Но характер их протекания зависит от условий. Так, например, кислород и хлор могут спокойно реагировать с водородом, а могут и со взрывом (см. учебник химии для 8 класса).
С водородом реагируют и другие неметаллы, например сера:

Поскольку в школьных условиях демонстрация этих реакций небезопасна, дадим их описание.

Если проверенный на чистоту водород поджечь у конца газоотводной трубки от прибора, в котором его получают, и внести пламя в сосуды (рис. 13), наполненные один кислородом, а другой хлором, то водород продолжает гореть в этих газах с изменением характера пламени. Если же поджечь смесь водорода и кислорода («гремучий газ») или смесь водорода и хлора, то их реакция происходит со взрывом (цепная реакция). В данном случае изменение условий повлекло за собой изменение характера взаимодействия, но продукты реакции в обоих случаях будут те же самые. В реакции с кислородом это вода, а с хлором образуется «туман», состоящий из капелек соляной кислоты:

3. Взаимодействие неметаллов с другими неметаллами. В этом случае неметаллы могут выступать в качестве как окислителей, так и восстановителей. Например, при взаимодействии с водородом сера — окислитель (см. свойство 2), а в реакции с хлором она — восстановитель:

Задание. Вы наблюдали, как сгорают в кислороде уголь и фосфор. Охарактеризуйте эти реакции и напишите их уравнения.
4. Взаимодействия неметаллов со сложными веществами. Со многими реакциями этого вида вы встречались при изучении процессов горения, химических свойств галогенов, серы и др. Приведем примеры:

Неметаллы как простые вещества взаимодействуют с металлами, с неметаллами и со сложными веществами. Эти реакции являются окислительно-восстановительными.

Неметаллы как простые вещества можно получить различными способами:
а) разложением сложных веществ:

б) вытеснением их из сложных веществ (реакция замещения):

Простые вещества-неметаллы • Состав и структура неметаллов • Аллотропия неметаллов • Химические свойства и способы получения неметаллов
Вопросы и задания





Источник
§ 13. Простые вещества-неметаллы, их состав, строение, общие свойства и способы получения

С помощью какого типа химической связи образуются простые вещества-неметаллы?
В какие реакции вступают простые вещества-неметаллы?
Состав и агрегатное состояние неметаллов. Вы уже знакомы со многими простыми веществами-неметаллами: кислородом, водородом, галогенами. Это вещества, в молекулах которых атомы одного и того же химического элемента связаны между собой ковалентной неполярной связью. С помощью этой связи образуются разные по составу и строению простые вещества-неметаллы. Одни из них в обычных условиях существуют в виде двухатомных молекул (Н2, Сl2, O2, N2 и др.), другие образуют более сложные по составу молекулы (так, у фосфора они состоят из четырех атомов, а у ромбической серы — из восьми и т. д.), а также есть простые вещества, представляющие собой атомные агрегаты (кремний, углерод в виде алмаза и графита и др.).
В обычных условиях неметаллы существуют в различных агрегатных состояниях: в виде газов, состоящих из одноатомных (инертные газы), двухатомных (кислород, водород, фтор, хлор, азот и др.), трехатомных молекул (озон), и в виде жидкости — бром; в виде твердых кристаллических и аморфных веществ (кремний, углерод и др.).
Строение твердых неметаллов также различно: одни имеют молекулярное, другие немолекулярное строение. Многие простые вещества-неметаллы в твердом состоянии имеют молекулярный тип кристаллической решетки. Из известных вам неметаллов углерод и кремний имеют атомный тип кристаллической решетки, в которой атомы связаны между собой прочной ковалентной связью, имеющей высокую энергию, например алмаз. Поэтому вещества с атомной кристаллической решеткой имеют высокие температуры плавления и кипения. Для молекулярных веществ характерен молекулярный тип кристаллической решетки, где связь между составляющими ее частицами (молекулами) осуществляется сравнительно слабыми межмолекулярными взаимодействиями, которые обусловливают их некоторые физические свойства: малую прочность, сравнительно низкую температуру плавления и кипения, а следовательно, и высокую летучесть.
Молекулярные вещества находятся при обычных условиях в газообразном (кислород, азот и др.) и твердом состоянии (фосфор, сера и др.).
Вспомните свойства кристаллического иода.

Некоторые неметаллы в твердом виде существуют не только в кристаллическом, но и в аморфном состоянии. Аморфные вещества представляют собой агрегаты частиц, расположенных более беспорядочно, чем в кристалле. В отличие от кристаллических веществ, имеющих определенную температуру плавления и кипения, аморфные вещества плавятся в интервале температур. В зависимости от условий, при которых происходит переход из расплавленного состояния в твердое, одно и то же вещество можно получить как в кристаллическом, так и в аморфном виде. Так, например, при прокаливании диоксида кремния SiO2 с магнием можно получить бурый порошок аморфного кремния. Вещества в аморфном состоянии отличает более высокая химическая активность по сравнению с веществами в кристаллическом состоянии.
Задание. Приведите примеры простых веществ, образованных атомами одного и того же химического элемента.
Некоторые неметаллы способны существовать в виде нескольких простых веществ. Примером может служить элемент углерод и его простые вещества: алмаз, графит и др. Способность атомов одного и того же элемента образовывать несколько простых веществ называется аллотропией.
Свойства аллотропных видоизменений элемента зависят от того, как и в каком количестве связываются между собой атомы в данном веществе (кислород O2, озон О3) и как они расположены в пространстве (алмаз и графит).
Явление аллотропии широко распространено у неметаллов. В дальнейшем вы узнаете, что все элементы VIA-группы образуют несколько аллотропных форм.
Простые вещества-неметаллы отличаются по своему составу, строению и агрегатному состоянию, характеризуются широким диапазоном физических свойств и способностью к аллотропии.
Химические свойства и получение неметаллов
Задание. Приведите примеры химических реакций неметаллов. Почему они являются окислительно-восстановительными?
В процессе изучения химии вы уже познакомились со многими химическими реакциями неметаллов, в которых проявляются их химические свойства.
Все реакции неметаллов (кроме аллотропных превращений) относятся к окислительно-восстановительным.
Убедимся в этом, рассмотрев, какие функции выполняют в окислительно-восстановительных реакциях неметаллы, с какими веществами они взаимодействуют.
1. Взаимодействие неметаллов с металлами. Вы уже знаете, что многие металлы горят в кислороде и хлоре.
Задание. Опишите реакции кислорода, серы, хлора и других неметаллов с металлами. Составьте уравнения этих реакций методом электронного баланса (см. учебник химии для 8 класса). Назовите продукты этих реакций. Например:
Источник
Неметаллы. Общая характеристика неметаллов. Получение и применение неметаллов. Химические свойства неметаллов.
Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7, для них характерны высокие значения электроотрицательности и окислительные свойства. Если в Периодической системе провести диагональ от бора к астату, то справа вверх по диагонали будут находиться элементы-неметаллы, а слева снизу – металлы, к ним же относятся элементы всех побочных подгрупп, лантаноиды и актиноиды. Элементы, расположенные вблизи диагонали, например, бериллий, алюминий, титан, германий, сурьма, обладают двойственным характером и относятся к металлоидам. Элементы-неметаллы: s-элемент – водород; р-элементы 13 группы – бор; 14 группы – углерод и кремний; 15 группы – азот, фосфор и мышьяк, 16 группы – кислород, сера, селен и теллур и все элементы 17 группы – фтор, хлор, бром, йод и астат. Элементы 18 группы – инертные газы, занимают особое положение, они имеют полностью завершенный внешний электронный слой и занимают промежуточное положение между металлами и неметаллами. Их иногда относят к неметаллам, но формально, по физическим признакам. Химические элементы-неметаллы могут проявлять как окислительные, так и восстановительные свойства, в зависимости от химического превращения, в котором они принимают участие. Атомы самого электроотрицательного элемента – фтора – не способны отдавать электроны, он всегда проявляет только окислительные свойства, другие элементы могут проявлять и восстановительные свойства, хотя намного в меньшей степени, чем металлы. Наиболее сильными окислителями являются фтор, кислород и хлор, преимущественно восстановительные свойства проявляют водород, бор, углерод, кремний, фосфор, мышьяк и теллур. Промежуточные окислительно-восстановительные свойства имеют азот, сера, йод.
Химические свойства 1. Окислительные свойства неметаллов проявляются при взаимодействии с металлами
4Al + 3C = Al4C3 2. Неметаллы играют роль окислителя при взаимодействии с водородом
H2 + F2 = 2HF 3 Любой неметалл выступает в роли окислителя в реакциях с теми металлами, которые имеют низкую ЭО 2P + 5S = P2S5 4. Окислительные свойства проявляются в реакциях с некоторыми сложными веществами
CH4 + 2O2 = CO2 + 2H2O 5. Неметаллы могут играть роль окислителя в реакциях со сложными веществами
2FeCl2 + Cl2 = 2FeCl3 6. Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом
4P + 5O2 = 2P2O5 7. Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями S + 6HNO3 = H2SO4 + 6NO2 + 2H2O 8. Наиболее сильные восстановительные свойства имеют углерод и водород ZnO + C = Zn + CO; CuO + H2 = Cu + H2O 9. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования) Cl2 + H2O =HCl + HClO
Физические свойства неметаллов Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях: газы (благородные газы: He, Ne, Ar, Kr, Xe, Rn;водород H2, кислород O2, азот N2, фтор F2, хлор Cl2.), жидкость (бром Br2) , твердые вещества ( йод I2, углерод C, кремний Si, сера S, фосфор P и др. ) . Атомы неметаллов образуют менее плотно упакованную структуру чем металлы, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
АЛЛОТРОПИЯ – существование химических элементов в двух или более молекулярных либо кристаллических формах. Например, аллотропами являются обычный кислород O2 и озон O3; в этом случае аллотропия обусловлена образованием молекул с разным числом атомов. Чаще всего аллотропия связана с образованием кристаллов различных модификаций. Углерод существует в двух четко различающихся кристаллических аллотропных формах: в виде алмаза и графита. Раньше полагали, что т.н. аморфные формы углерода, древесный уголь и сажа, – тоже его аллотропные модификации, но оказалось, что они имеют такое же кристаллическое строение, что и графит. Сера встречается в двух кристаллических модификациях: ромбической (a-S) и моноклинной (b-S); известны по крайней мере три ее некристаллические формы: l-S, m-S и фиолетовая. Для фосфора хорошо изучены белая и красная модификации, описан также черный фосфор; при температуре ниже –77°С существует еще одна разновидность белого фосфора. Обнаружены аллотропные модификации As, Sn, Sb, Se, а при высоких температурах – железа и многих других элементов.
Получение неметаллов Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов не существует. Рассмотрим основные способы получения некоторых неметаллов.
1. Получение галогенов. Самые активные галогены – фтор и хлор – получают электролизом. Фтор – электролизом расплава KHF2, хлор – электролизом расплава или раствора хлорида натрия:
2Г — — 2 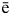
2. Получение водорода. Основной промышленный способ получения водорода – конверсия метана (каталитический процесс): CH4 + H2O = CO + 3H2.
3. Получение кремния. Кремний получают восстановлением коксом из кремнезема: SiO2 + 2C = Si + 2CO.
4. Получение фосфора. Фосфор получают восстановлением из фосфата кальция, который входит в состав апатита и фосфорита: Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO.
5. Кислород и азот получают фракционной перегонкой жидкого воздуха.
6. Сера и углерод встречаются в природе в самородном виде.
7. Селен и теллур получают из отходов производства серной кислоты, так как эти элементы встречаются в природе вместе с соединениями серы.
8. Мышьяк получают из мышьяковистого колчедана по сложной схеме превращений, включающей стадии получения оксида и восстановления из оксида углеродом.
9. Бор получают восстановлением оксида бора магнием.
Применение неметаллов
Водород используется в химической промышленности для синтеза аммиака, хлороводорода и метанола, применяется для гидрогенизации жиров. Используется в качестве восстановителя при производстве многих металлов, например, молибдена и вольфрама, из их соединений. Хлор применяют для производства соляной кислоты, винилхлорида, каучука и многих органических веществ и пластмасс, в текстильной и бумажной промышленности используют в качестве отбеливающего средства, в быту – для обеззараживания питьевой воды. Бром и йод используют в синтезе полимерных материалов, для приготовления лекарственных препаратов и др. Кислород применяется при сжигании топлива, при выплавке чугуна и стали, для сварки металлов, необходим для жизнедеятельности организмов. Сера используется для производства серной кислоты, изготовления спичек, пороха, для борьбы с вредителями сельского хозяйства и лечения некоторых болезней, в производстве красителей, взрывчатых веществ, люминофоров. Азот и фосфор применяются при производстве минеральных удобрений, азот применяется при синтезе аммиака, для создания инертной атмосферы в лампах, используется в медицине. Фосфор применяется при производстве фосфорной кислоты. Алмаз используется при обработке твердых изделий, в буровых работах и ювелирном деле, графит – для изготовления электродов, тиглей для выплавки металлов, в производстве карандашей, резины и др.
Источник





