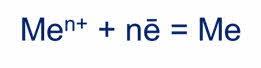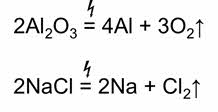- Металлы в природе. Способы получения металлов
- Урок 31. Химия 11 класс ФГОС
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Металлы в природе. Способы получения металлов»
- Презентация по теме «Получение металлов» химия 9 класс
- Дистанционное обучение как современный формат преподавания
- Современные педтехнологии в деятельности учителя
- Методическая работа в онлайн-образовании
- Оставьте свой комментарий
- Безлимитный доступ к занятиям с онлайн-репетиторами
- Подарочные сертификаты
Металлы в природе. Способы получения металлов
Урок 31. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Металлы в природе. Способы получения металлов»
С металлами в свободном состоянии человек знаком с самой глубокой древности. Изначально человеку было известно только 7 металлов, так называемы «металлы древности».
За последние 250 лет открыто и получено в свободном виде 86 новых металлов.
Использовать металлы в свободном виде человек начал в древние века. Первыми металлами из них были золото, серебро, медь. Освоение выплавки железа в больших масштабах сделало огромный переворот в промышленности.
В природе металлы встречаются как в виде простых веществ (в свободном виде), а также в виде соединений. Малоактивные металлы: медь, золото, серебро, платина, палладий и др. в природе могут находиться как в свободном виде, так и в составе соединений. Активные металлы: натрий, калий, кальций, алюминий, магний и др. встречаются в природе только в виде соединений: оксидов, сульфидов, карбонатов и т.д.
Если металл в природных условиях находится в свободном состоянии, то для получения чистого металла нужно только избавиться от соответствующих смесей. Получение металлов из соединений – это задача металлургии.
Большинство металлов находится в природных условиях в виде соединений – руд. Руда – это природное минеральное образование, в котором атомы химических элементов находятся в окисленном состоянии. Для получения металла для этого необходимо провести процесс восстановления:
Для данного процесса используют восстановители, такие как, водород, более активные металлы, углерод (в виде кокса), оксид углерода (II), постоянный электрический ток.
Технологические процессы, лежащие в основе промышленных способов получения металлов из руд, можно разделить на пирометаллургические, гидрометаллургические, электрометаллургические.
Пирометаллургические способы получения металлов основаны на использовании различных восстановителей для получения металлов путем восстановления из руд при высокой температуре.
В гидрометаллургических методах процесс восстановления протекает в водном растворе.
В электрометаллургических процессах восстановителем является постоянный электрический ток.
Водород как восстановитель может использоваться для получения металлов со средней и малой химической активностью: например, меди, вольфрама, молибдена. В данном случае водород восстанавливает металл из его оксида при высокой температуре.
Восстановить металлы из их оксидов можно с помощью более активного металла, поэтому процесс восстановление металлами называется металлотермией. Если в роли восстановителя металла выступает алюминий, то данный процесс называется алюмотермией.
Так, алюминий используется для получения кальция из его оксида, а металлический кальций используют для получения цезия.
Ca + 2СsСl = CaCl2 + 2Cs
Углерод и оксид углерода (II) являются сильными восстановителями.
CuO + CO = Cu + CO2↑
Свободный углерод (в виде кокса) и оксид углерода (II) служат восстановителями при производстве железа в доменном процессе. В общем виде:
Постоянный электрический ток является самым сильным восстановителем. С помощью электрического тока получают многие активные металлы: натрий, калий, кальций и др. При этом процесс идёт не в водном растворе, а в расплаве при повышенной температуре.
Алюминий в промышленных масштабах получают путём электролиза раствора оксида алюминия в расплавленном криолите (Na3AlF6).
Таким образом, большинство металлов в природе находятся только в виде соединений, в самородном состоянии встречаются золото, медь, палладий и др. Получение металлов из соединений – это задача металлургии. В зависимости от способа получения металлов различают следующие методы: пирометаллургия, электрометаллургия и гидрометаллургия. В пирометаллургическом методе использую восстановители: водород, углерод, оксид углерода (II), более активные металлы.
Источник
Презентация по теме «Получение металлов» химия 9 класс
Описание презентации по отдельным слайдам:
Здравствуйте, ребята! Мы продолжаем изучать большую главу «Металлы». А тема сегодняшнего урока …
Тема урока «Получение металлов». Урок химии в 9 классе. Учитель Сутугина Ирина Владимировна. «Металл – всех недр земных владыка»…
Цели урока: 1.Познакомить обучающихся с природными соединениями металлов. 2. Сформировать понятия о самородных металлах, минералах, рудах. 3. Ознакомить обучающихся с металлургией и её видами. Задачи урока: Образовательные задачи: · обобщить знания учащихся об основных свойствах элементов-металлов и образуемых ими простых и сложных веществ. · закрепить материал по теме «Металлы», навыки решения задач · выработать умение логически рассуждать, грамотно выражать свои мысли · развивать умение работать коллективно Развивающие задачи: · Развивать знания, умения и навыки по химическим формулам металлов и их соединений · Развивать речевые навыки, наблюдение и умение делать выводы · Развивать интерес к предмету Воспитательные задачи: · Воспитывать желание учиться с интересом, без принуждения и нагрузок · Воспитывать самостоятельность мышления посредством саморефлексии
Теперь, давайте вспомним прошлую тему: Составьте уравнения возможных реакций: а) Аl + СI2 → б) Zn + AgNO3 → в) MgO + HCl → г) Аg + FeSO4 → д) СuСI2 + NaOH → а) Аg + Н2О → б) Cu + ZnСI2 → в) Мg + О2 → г) Сu + НСI → д) Fe + CuSO4 →
Надеюсь, все справились а) 4Аl +3СI2 →2 Al2Cl3 б) Zn + 2AgNO3 →Zn(NO3)2+2Ag в) MgO + 2HCl → MgCl2+ Н2О г) Аg + FeSO4 → нет реакции д) СuСI2 +2NaOH → 2NaCl+Cu(OH)2 а) Аg + Н2О → нет реакции б) Cu + ZnСI2 → нет реакции в) 2Мg + О2 → 2MgO г) Zn + 2НСI → ZnCl2+Н2 д) Fe + CuSO4 →FeSO4 +Cu
Проблема! Могут ли металлы находиться в природе в свободном ( самородном ) состоянии, т.е. в виде Ме0 ? Если могут, то какие это металлы? Это металлы низкой химической активности.
В природе металлы могут встречаться в виде простого вещества (самородки) или в виде сложного вещества: Благородные Ме – Аu, Рt , встречаются в природе только в свободном виде. Самородок серебра Самородок золота Самородок платины
В природе металлы встречаются чаще всего в виде соединений (металлических руд). А что такое металлические руды? Руды – содержащие металлы природные образования, в которых металлы находятся в количествах, пригодных в технологическом и экономическом отношении для получения металлов в промышленности. Из 1 тонны медной руды можно получить лишь 4 кг чистой меди Медная руда
Выполнение лабораторного опыта №13. Ознакомление с рудами железа. (работа в парах) Цель: ознакомиться с образцами природных соединений железа Образцы: магнитный железняк, красный железняк, бурый железняк. Содержание и порядок выполнения работы: Внимательно рассмотрите образцы, выданных вам руд и определите их цвет и блеск. Возьмите фарфоровую ступку и кусочком руды нанесите на её поверхности черту. Какого цвета получилась черта? Кусок руды поднесите к компасу. Отклоняется ли стрелка компаса? Если да, то велико ли это отклонение?
Результаты опытов оформите в виде таблицы. Подумайте: 1. Чем различаются эти руды? 2. Какую руду лучше использовать для получения железа?
Активные Ме (до Sn) встречаются только в виде соединений. Менее активные металлы могут встречаются и в свободном виде и в виде соединений (Sn, Cu, Hg, Ag). . хлоридов :сильвинит КСl • NaCl, каменная соль NaCl; нитратов – чилийская селитра NaNO3; сульфатов – глауберова соль Na2SO4 * 10 H2O, гипс CaSO4 • 2Н2О; карбонатов – мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 • MgCO3; сульфидов :серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS; фосфатов – фосфориты, апатиты Ca 3(PO4)2 ; оксидов – магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк, содержащий различные гидроксиды железа (III) Fe2O3 • Н2О.
Вопрос! Как вы думаете, ребята, какой основной химический процесс лежит в основе получения металлов? • Так как большинство металлов встречаются в природе в составе соединений, в которых металлы находятся в положительной степени окисления Ме+п, значит для того чтобы их получить в виде Ме0, необходимо про вести процесс восстановления. Ме+n+ne= Ме0
Получением металлов из их соединений занимается важнейшая отрасль промышленности, называемая металлургией.
Вопрос! Как добиться доступной формы для переработки? Это может быть обжиг руд для перевода металла в оксид его или растворение нерастворимых соединений: обработка кислотами, содой и др. Катионы металлов Ме+n в металлургических процессах являются окислителями. Восстановителями выступают следующие вещества: С (уголь), Н2, СО, Al, Mg, активные металлы — щелочные и щелочноземельные, электрический ток.
Основные способы получения металлов. Заполнение таблицы:
Пирометаллургия. восстановление металлов из их руд, происходящее при высоких температурах Обжиг в древности Обжиг (окисление): 2PbS + ЗО2 = 2РЬО + 3SO2↑ Плавка (восстановление): РЬО + Н2 = Pb + Н2О WO3 + ЗН2 = W + ЗН2О TiCl4 + 2Mg = Ti + 2MgCl2 Отраслью пирометаллургии является металлотермия – восстановление Ме из оксидов более активными металлами, чаще алюминием ( алюминотермия). Так получают марганец, хром, молибден, вольфрам. Сr 2О3 + 2 АI → АI 2О3 + 2 Сr
Гидрометаллургия Методы восстановления металлов из растворов их солей другими более активными металлами. Этим способом можно получить следующие металлы: Ag, Au, Zn, Zn, Mo. CuO + H2SO4 = CuSO4 + Н2О CuSO4 + Fe = FeSO4 + Сu
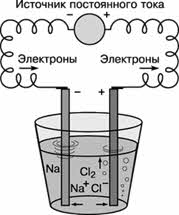
Электрометаллургия получение Ме с помощью электрического тока (электролиз). Так получают активные легкие Ме: щелочные и щелочноземельные, алюминий. Электролиз расплава: 2 NaCI → 2Na + CI2 ↑ 2КCI →2K + CI2↑
Термическое разложение соединений : так получают Ме в особо чистой форме : титан, цирконий, торий — из галогенидов, ванадий, ниобий, тантал – из оксидов. Fe(CO)5 → Fe + 5CO Ni(CO)4→ Ni + 4CO Микробиологический метод тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты.
Закрепление темы: Предложите цепочку производства : Как можно получить из пирита FeS2 железо и серную кислоту? Запишите уравнения реакций. Предложите технологическую цепочку производства свинца из минерала галенита PbS. Запишите уравнения реакций
Почти все справились. Молодцы! FeS2→Fe2O3→Fe FeS2→SO2→SO3→H2SO4 1)4FeS2+11O2=2 Fe2O3 +8SO2 2) Fe2O3+ 3C = 2Fe + 3CO ↑ 3)2SO2+O2=2SO3 4)2SO3+H2O=H2SO4 PbS→PbO→Pb 1)2PbS+3O2=2SO2↑+2PbO 2) PbO+CO=Pb+CO2
Молодцы! Всем спасибо! Домашнее задание: §12, упр. 1. Выписать названия минералов из текста учебника. Творческое задание: подготовить сообщение о любом минерале и его использовании.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 807 человек из 76 регионов
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
- Курс добавлен 23.09.2021
- Сейчас обучается 46 человек из 23 регионов
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
- Сейчас обучается 24 человека из 13 регионов
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-195967
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Российский совет олимпиад школьников намерен усилить требования к олимпиадам
Время чтения: 2 минуты
Рособрнадзор откажется от ОС Windows при проведении ЕГЭ до конца 2024 года
Время чтения: 1 минута
Попова предложила изменить школьную программу по биологии
Время чтения: 1 минута
Минпросвещения разрабатывает образовательный минимум для подготовки педагогов
Время чтения: 2 минуты
Минпросвещения работает над единым подходом к профилактике девиантного поведения детей
Время чтения: 1 минута
Спортивные и творческие кружки должны появиться в каждой школе до 2024 года
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник