- Установка производства серной кислоты
- Назначение
- Сырье и продукты
- Современные методы производства серной кислоты
- Технологическая схема
- Подготовка сырья, удаление конденсата
- Сжигание СВСГ/отработанной серной кислоты
- Окисление сернистого ангидрида в конвертере
- Блок охлаждения дымовых газов и утилизации тепла реакции
- WSA-конденсатор
- Материальный баланс
- Достоинства и недостатки
- Недостатки
- Достоинства
- Существующие установки
- Оборудование для производства серной кислоты
- Контактный четырехслойный аппарат
- Технические характеристики контактных четырехслойных аппаратов:
- Контактный четырехслойный аппарат со встроенными теплообменниками
- Технические характеристики контактных четырехслойных аппаратов со встроенными теплообменниками:
- Контактный пятислойный аппарат
- Технические характеристики контактного пятислойного аппарата:
- Корпус реактора R106 для установки WSA
- Технические характеристики корпуса реактора R106 для установки WSA:
- Башни увлажнительные, промывные, абсорберы
- Технические характеристики башни увлажнительной, промывной, абсорберов:
- Оборудование для производства серной кислоты контактным способом
Установка производства серной кислоты
Назначение
Установка производства серной кислоты предназначена прежде всего для утилизации сероводородсодержащих газов (СВСГ), а также для получения технической серной кислоты.

Сырье и продукты
Сырьем установки является сероводородсодержащий газ (СВСГ), который поступает с установок:
- Гидроочистки
- Регенерации амина
- Отпарки кислых стоков
- Блока сероочистки газов
Современные методы производства серной кислоты
Также сырьем может являться отработанная серная кислота после процесса сернокислотного алкилирования.
В настоящее время в промышленности применяют два метода окисления диоксида серы в производстве серной кислоты:
- контактный — с использованием твердых катализаторов,
- нитрозный (башенный), в котором в качестве катализатора используют оксиды азота.
В качестве окислителя обычно используют кислород.
При контактном методе реакционная смесь пропускается сквозь слой твердого катализатора, во втором орошается водой или разбавленной серной кислотой в реакторах башенного типа.
Вследствие высокой эффективности (производительность, компактность, чистота и стоимость продукта и др.) контактный способ вытесняет нитрозный.
Технология получения серной кислоты методом “мокрого катализа” также относится к контактному методу.
Технологическая схема
Процесс получения серной кислоты методом мокрого катализа состоит из нескольких основных стадий.
Подготовка сырья, удаление конденсата
СВСГ поступает на сжигание через приемный сепаратор и фильтры механической очистки. Вода содержится в продуктах реакции окисления сероводорода. Сероводород H2S с концентрацией 99,5% поступает на блок подготовки газов в сепарационную емкость.
Конденсат моноэтаноламина, содержащийся в сырьевом газе, улавливается и под силой гравитации стекает сначала в нижнюю часть емкости, а затем по трубам в сборную емкость меньшего размера находящийся ниже уровня, после чего дренируется.
Сжигание СВСГ/отработанной серной кислоты
Получение сернистого ангидрида SО2 путем сжигания сероводородсодержащего газа происходит по последующей реакции: 2H2S + 3O2 → 2SO2 + 2H2O
Топливный газ очищается от жидкости в газовом сепараторе, после чего поступает на горелки топки. Сероводород сжигается в циклонной топке (камера сгорания) в результате чего получается сернистый газ SО2. Температура на выходе котлов от 450 до 560 °С.

Окисление сернистого ангидрида в конвертере
Окисление сернистого ангидрида до серного ангидрида SО3 происходит на ванадиевом катализаторе в контактном аппарате – конвертере по следующей реакции:

Перед подачей сернистого ангидрида в контактный аппарат предусмотрены фильтры для очистки от сажи, металлов, образующихся при сжигании СВСГ, либо отработанной серной кислоты.
Далее сернистый газ смешивается с воздухом и с температурой 390 °С поступает в контактный аппарат, где окисляется на твердом ванадиевом катализаторе до оксида серы SO3. Реакция протекает последовательно на 3 слоях катализатора с промежуточным охлаждением.
Воздух для охлаждения подается воздуходувками. Эти же воздуходувки обеспечивают подачу воздуха в котлы-утилизаторы.
Далее сернистый газ с температурой 430°С поступает в блок охлаждения газа, пройдя через четыре секции трубных пучков газ охлаждается до 255 °С.

Далее для снижения выбросов и SO3 в атмосферу, в дымоход с блока управления туманом впрыскивают пары силиконового масла.
Блок охлаждения дымовых газов и утилизации тепла реакции
При утилизации тепла в конвертере, вырабатывается пар, который собирается в барабане- паросборнике. На установке используется химически очищенная вода, которая готовится на блоке ХОВ. Химически очищенная вода подается в деаэратор, после чего подается питательными насосами в котлы-утилизаторы и в барабан-паросборник блока охлаждения газа, где получается водяной пар высокого давления.
WSA-конденсатор
Получение серной кислоты H2SO4 путем конденсации в конденсаторе происходит по реакции:
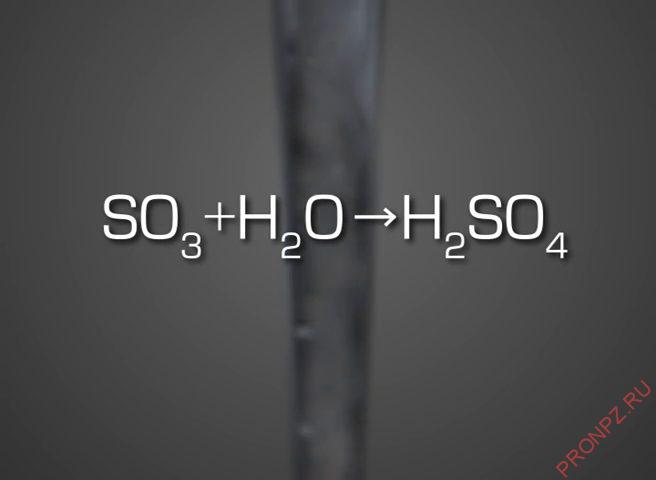
Газовая смесь охлаждается в WSA-конденсаторе, где пары образующейся серной кислоты превращаются в жидкий продукт H2SO4.
В качестве охладителя используется воздух, который подается воздуходувками через фильтр из атмосферы. Пройдя через аппарат, он смешивается с дымовыми газами и выводится через дымовую трубу.
Сконденсированная серная кислота стекает по стенкам трубок вниз аппарата в емкость системы циркуляции кислоты. Температура на выходе составляет около 120°С.
Для снижения температуры кислоты до 65°С в горячий поток добавляется холодный поток циркулирующей кислоты.
Серная кислота с концентрацией от 92 до 94% насосом из емкости направляется:
- основная часть в качестве рециркулята на смешение с горячей кислотой.
- балансовое количество серной кислоты насосами откачивается с установки.

Материальный баланс
| Наименование продукта | Измерение | Сутки |
| един. | итого | |
| Входы | ||
| СВСГ | т | 64,6 |
| Серная кислота отработанная | т | 12,5 |
| Воздух | 92,8 | |
| Итого сырья | т | 169,9 |
| Выходы | ||
| Серная кислота 93% | т | 169,9 |
Достоинства и недостатки
Недостатки
- Недостатком метода мокрого катализа является то, что из влажного газа, особенно с пониженным содержанием SO2, нельзя получить олеум. В остальном этот метод очень эффективен.
- Процесс производства серной кислоты не является экономически выгодным для предприятия. Основная цель процесса – переработка сероводородсодержащего газа в серную кислоту для удобства транспортировки, а также снижения выбросов в атмосферу при сжигании СВСГ на факелах.
- Несмотря на высокую степень автоматизации для рабочего персонала существует риск отравления сернистыми газами, особенно в период капитальных и текущих ремонтов.
Достоинства
- По аппаратурной схеме процесс мокрого катализа гораздо проще и рентабельнее обычного контактного процесса.
- В процессе не образуются сточные воды
- Нет расхода абсорбентов и вспомогательных химикатов
- Эффективная рекуперация тепла, обеспечивающая экономичность работы
- Простое и полностью автоматизированное управление, вариативное к изменениям расхода и состава сырья
Существующие установки
Процесс мокрого катализа разработан компанией Хальдор-Топсе и является распространенной и широко используемой технологией как в мире, так и в России. В России технология мокрого катализа используется для получения серной кислоты на таких заводах, как:
- ПАО «Славнефть-ЯНОС»
- ПАО «Карабашмедь»
- ПАО РН-Новокуйбышевский НПЗ»
- ПАО РН-Сызранский НПЗ и др.
Источник
Оборудование для производства серной кислоты
Контактный четырехслойный аппарат
Контактный аппарат используется для окисления сернистого газа (SО3) контактным способом в процессе производства серной кислоты.
Внутри устройства все детали, производимые из углеродистых сталей металлизируются алюминием (толщина покрытия 0,15±0,03 мм) для защиты от соприкосновения с газом.
Контактный аппарат доставляются блоками и узлами и монтируетсянепосредственно на площадке заказчика.
Технические характеристики контактных четырехслойных аппаратов:
Вместимость 390 м3
Поверхность теплообмена 1736 м2
Производительность по моногидрату 20000 м3/ч
- в трубном пространстве сернистый газ
- в межтрубном и корпусе сернистый и серный газ
Степень контактирования 99 %
Рабочее давление 0,03 (0,3)МПа (кгс/см2)
Рабочая температура среды6 05 – 420 Сº
Допустимая температура стенки корпуса Сº:
- максимальная 475
- минимальная 0
Скорость газа 0,27 м/с
- корпуса сталь 09Г2С
- теплообменников 12Х18Н10Т
- внутренних устройств сталь 09Г2С 12Х18Н10Т, жаропрочный чугун ЧХ2
Масса 178000 кг
Контактный четырехслойный аппарат со встроенными теплообменниками
Данный ти аппаратов используется для окисления контактным способом сернистого газа (SO2) в серный газ (SO3) на производстве серной кислоты.
Технические характеристики контактных четырехслойных аппаратов со встроенными теплообменниками:
Поверхность теплообмена,1130 м2
Производительность по моногидрату 120 т/сутки
- в трубном пространстве сернистый газ
- в межтрубном пространстве сернистый и серный газ
Рабочее давлениедо 0,03 (0,3) МПа (кгс/см2)
Рабочая температура среды Сº:
- максимальная 620
- минимальная 220
- корпуса Вст3сп5
- теплообменников сталь 10, Вст3сп5
- внутренних устройств Вст3сп5
Масса 100050 кг
Контактный пятислойный аппарат
Технические характеристики контактного пятислойного аппарата:
Вместимость 500 м3
Производительность по моногидрату 136000 м3/ч
Среда сернистый газ
Степень контактирования 97 %
- Рабочее давление, МПа (кгс/см2) до 0,024 (0,24)
- Рабочая температура среды 422 – 588 оС
Допустимая температура стенки корпуса, оС:
- максимальная 475
- минимальная 0
Скорость газа 0,15 м/с
- корпуса сталь 09Г2С
- внутренних устройств сталь 09Г2С,12Х18Н10Т, жаропрочный чугун ЧХ2
Масса 518000 кг
Корпус реактора R106 для установки WSA
Используется при образовании сернистого газа SO 2 в парообразную серную кислоту.
Технические характеристики корпуса реактора R106 для установки WSA:
Поверхность теплообмена 353 м2
Рабочее давление, МПа (кгс/см2)
- в трубном пространстве 16 (16)
- в аппарате 0,009(0,09)
Рабочая температура среды 290 – 570 оС
- длина 12425 мм
- ширина 12500 мм
- высота 18050 мм
- корпуса 08Х18Н10Т
- внутренних устройств 08Х18Н10Т
Масса 200000 кг
Башни увлажнительные, промывные, абсорберы
Предназначены для сушки моногидрата двуокиси серы в производстве серной кислоты.
Основные рабочие составляющие башни:
- распределительные устройства,
- коллекторы, выполненные из корозионностойких материалов,
- распределительные сепарационные тарелки желобчатого типа
- распылительные устройства.
Узлы подачи и распределения серной кислоты унифицированны.
В соответствии с требованиями технического проекта поверхности, контактирующие со средой, защищаются свинцом или методом гомогенного покрытия свинцом С1 слоем 5 мм.
Технические характеристики башни увлажнительной, промывной, абсорберов:
Вместимость 70 – 1000 м3
Внутренний диаметр 4000 – 10000 мм
Рабочее давление до 0,3 кгс/см2
Рабочая температура от –40 до +200 оС
Среда коррозионная, токсичная, невзрывоопасная
Источник
Оборудование для производства серной кислоты контактным способом
Серную кислоту в промышленности производят двумя способами: контактным и нитрозным.
Контактный способ производства серной кислоты.
Серную кислоту контактным способом производят в больших количествах на сернокислотных заводах.
I. Сырьё, используемое для производства серной кислоты:
Самородная сера S
Пирит (серный колчедан) FeS2
Сульфиды цветных металлов ZnS , Cu2S
Производство серной кислоты из пирита FeS2.
1) Измельчение пирита. Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ.
2) Очистка пирита. После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют .
Производство серной кислоты из пирита состоит из трёх стадий.
ПЕРВАЯ СТАДИЯ — обжиг пирита в печи для обжига в «кипящем слое».
Уравнение реакции первой стадии
4FeS2 + 11O2
2Fe2O3 + 8SO2 + Q
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в «подвешенном состоянии» из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом — сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется принцип химического производства — безотходность производства.
Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка печного газа от твёрдых частичек огарка проводят в два этапа — в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
Осушку печного газа проводят в сушильной башне — снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О 2 .
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO2 + O2
2SO3 + Q
Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3).
Прямая реакция является экзотермической +Q, согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём химики-технологи установили, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO3 является температура 400-500°С. Это достаточно низкая температура в химических производствах. Для того , чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор. Экспериментальным путём установили, что наилучшим катализатором для этого процесса является оксид ванадия V2O5.
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO2 и 1V O2), а справа — 2V SO3. Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO3 из контактного аппарата. Попадая в контактный аппарат смесь SO2 и О 2 продолжает нагреваться до нужной температуры, проходя между трубками в контактном аппарате.
Температура 400-500 °С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO2 в SO3. Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO2 в SO3.
Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
Протекает в поглотительной башне.
А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2O
H2SO4. Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того , чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды — это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Уравнение реакции этого процесса nSO3 + H2SO4
H2SO4·nSO3
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Нитрозный способ производства серной кислоты.
На первой стадии, одинаковой для обоих методов, получают сернистый ангидрид SO 2. Исходным сырьём может быть, в принципе, любое вещество, содержащее серу: природные сульфиды железа (прежде всего, пирит FeS 2), а также сульфиды меди и никеля, сульфидные полиметаллические руды, гипс CaSO 4 . 2 H 2 O и элементарные сера. Всё больше и больше используют газы, которые выделяются при переработке и сжигании горючих ископаемых (угля, нефти), содержащих соединения серы.
Полученный SO 2 окисляют до H 2 SO 4, используется для этого в нитрозном методе используется окислы азота. С этой стадии оба метода отличаются друг от друга.
В специальной окислительной башне 3 смешивают окись азота NO и NO 2 с воздухом в таком соотношении, чтобы половина имеющихся NO и NO 2.
В результате газовая смесь содержит равные NO и NO 2. Она подаётся в башни 4 и 5, орошаемые 75% — ной серной кислотой; здесь смесь окислов азота поглощается с образованием нитрозиллерной кислоты:
Раствор нитрозиллерной кислоты в серной кислоте, называемый нитрозой, орошает башни 1 и 2, куда противотоком поступает SO 2 и добавляется вода. В результате гидролиза нитрозиллерной кислоты образуется азотная кислота:
В нижней части башен 1 и 2 накапливается 75%-ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество её меряется с выхлопными газами, приходится добавлять в систему HNO 3, служащую источником окислов азота.
Недостаток башенного метода состоит в том, что полученная серная кислота имеет концентрацию лишь 75% (при большей концентрации плохо идёт гидролиз нитрозиллерной кислоты). Концентрирование же серной кислоты упариванием представляет дополнительную трудность. Преимущество этого метода в том, что примеси содержащиеся в SO 2, не влияют на ход процесса, так что исходный SO 2 достаточно очистить от пыли, т.е. механических загрязнений. Естественно, башенная серная кислота бывает недостаточно чистой, что ограничивает её применение.
Основным сырьем для производства серной кислоты, является сера. Она относится к числу наиболее распространенных числу химических элементов на нашей планете.
Производство серной кислоты происходит в три стадии на первой стадии получают SO 2, путем обжига FeS 2, затем SO 3, после чего на третьей стадии получают серную кислоту.
Научно-техническая революция и связанный с ней интенсивный рост химического производства, вызывает существенные негативные изменения в окружающей среде. Например отравление пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В результате мир оказался в тисках экологического кризиса. Вредные выбросы сернокислых заводов следует оценивать не только по действию содержащегося в них оксида серы на расположенные вблизи предприятия зоны, но и учитывать другие факторы — увеличение количества случаев респираторных заболеваний человека и животных, гибель растительности и подавление ее роста, разрушение конструкций из известняка и мрамора, повышение коррозионного износа металлов. По вине “кислых” дождей повреждены памятники архитектуры.
В зоне до 300 км от источника загрязнения ( SO 2) опасность представляет серная кислота, в зоне до 600 км . — с ульфаты. Серная кислота и сульфаты замедляют рост с/ х культур. Закисление водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб. Помимо экологического ущерба налицо экономический ущерб — громадные суммы каждый год теряются при раскисление почв.
Рассмотрим химические метода очистки от наиболее распространенных газообразных загрязняющих воздух веществ. Известно более 60 методов. Наиболее перспективны методы, основанные на поглощение оксида серы известняком, раствором сульфита — гидросульфита аммония и щелочным раствором алюмината натрия. Интерес также представляют каталитические методы окисления оксида серы в присутствии оксида ванадия.
Особое значение имеет очистка газов от фторсодержащих примесей, которые даже в незначительной концентрации вредно влияют на растительность. Если в газах содержится фтороводород и фтор, то их пропускают через колоны с насадкой противотоком по отношению к 5-10% раствору гидроксида натрия. В течени и одной минуты протекают следующие реакции:
Образующийся фторид натрия обрабатывают для регенерации гидроксида натрия:
Источник

















 2Fe2O3 + 8SO2 + Q
2Fe2O3 + 8SO2 + Q 


 2SO3 + Q
2SO3 + Q





