Производство серной кислоты нитрозным методом
Автор работы: Пользователь скрыл имя, 06 Января 2015 в 16:41, реферат
Краткое описание
Образующийся плохо растворим в нитрозе и поэтому выделяется из нее, а затем частично окисляется кислородом в газовой фазе до диоксида . Смесь оксидов азота и вновь поглощается серной кислотой и т. д. Оксиды азота, по существу, не расходуются в нитрозном процессе и возвращаются в производственный цикл. Однако вследствие неполного поглощения их серной кислотой они частично уносятся отходящими газами; это составляет невозвратимые потери оксидов.
Прикрепленные файлы: 1 файл
Производство серной кислоты нитрозным методом.doc
Производство серной кислоты нитрозным методом
Сущность нитрозного метода состоит в том, что обжиговый газ после очистки от пыли обрабатывается серной кислотой, в которой растворены оксиды азота, — так называемой нитрозой. Диоксид серы поглощается нитрозой и затем окисляется оксидами азота по реакции
Образующийся плохо растворим в нитрозе и поэтому выделяется из нее, а затем частично окисляется кислородом в газовой фазе до диоксида . Смесь оксидов азота и вновь поглощается серной кислотой и т. д. Оксиды азота, по существу, не расходуются в нитрозном процессе и возвращаются в производственный цикл. Однако вследствие неполного поглощения их серной кислотой они частично уносятся отходящими газами; это составляет невозвратимые потери оксидов.
Процесс производства серной кислоты нитрозным методом состоит из следующих стадий:
4)освобождение нитрозы от оксидов азота (денитрация);
5)окисление выделившегося из нитрозы оксида азота кисло
родом в газовой фазе;
6)поглощение оксидов азота серной кислотой.
Раньше нитрозный процесс осуществляли в свинцовых камерах, потому он назывался камерным способом. В настоящее время этот способ, как малопроизводительный, в СССР не применяется. Вместо него применяют башенный способ, по которому все основные и промежуточные процессы переработки протекают не в камерах, а в башнях, заполненных насадкой и орошаемых серной кислотой.
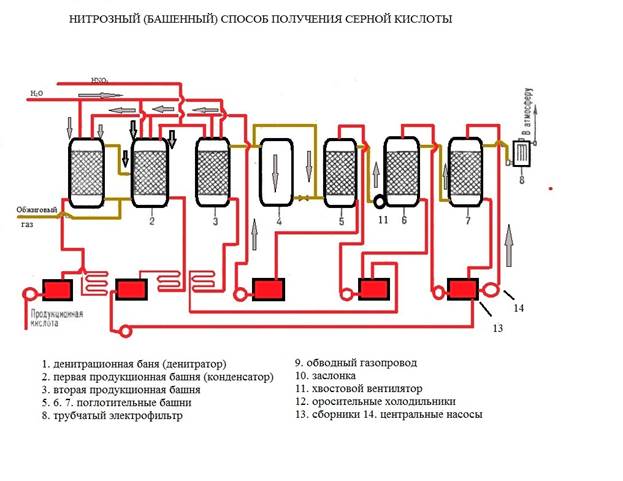
На рис.1 изображена принципиальная схема производства серной кислоты башенным способом. Первая башня, в которую поступает горячий обжиговый газ, предназначена для выделения оксидов азота из кислоты, орошающей башню. Этот процесс называют денитрацией серной кислоты, а башня 1 носит название денитрационной. Около денитрационной кислоты, вытекающей из этой башни, передают на склад как готовую продукцию, а остальное поступает на орошение последней башни 4.
Рис.1 Принципиальная схема башенной системы.
Денитрационная башня орошается небольшим количеством серной кислоты, поэтому кислота в ней сильно нагревается, что способствует выделению оксидов азота. Одновременно с денитрацией кислоты в башне 1 диоксид серы частично абсорбируется серной кислотой и окисляется оксидами азота. По характеру протекающих процессов первую башню можно схематически разделить на три зоны. В нижней зоне происходит упаривание серной кислоты с выделением паров воды в газовую фазу, в средней зоне оксиды азота выделяются из нитрозы в результате наибольшего ее разбавления, в верхней зоне конденсируются поступающие снизу пары воды и, следовательно, происходит разбавление нитрозы и частичное окисление растворяющегося в ней .
Строгого разделения перечисленных процессов по зонам провести нельзя, так как частично они совмещаются друг с другом. Кроме протекания этих процессов, в первой башне из газа улавливаются также остатки пыли, поглощаются мышьяковистый ангидрид и диоксид селена, конденсируются пары серной кислоты (образуются из , присутствующего в обжиговом газе) и др. Туман серной кислоты лишь частично поглощается в первой башне, большая часть его поступает в последующие башни системы, где вследствие большой суммарной поверхности частиц тумана он оказывает существенное влияние на протекающие в башнях процессы.
Готовую продукцию в башенных системах отводят только из денитрационной башни, где почти полностью улавливаются все примеси обжигового газа, поэтому башенная кислота загрязнена мышьяком, селеном, огарковой пылью и другими примесями.
Основное назначение второй башни— абсорбция диоксида серы из обжигового газа серной кислотой и окисление нитрозой. В этой башне образуется большая часть серной кислоты (70—80% всей продукции), поэтому ее часто называют продукционной башней. Процесс образования кислоты протекает по всей высоте башни 2, однако основное количество окисляется в ее нижней части, где создаются условия, наиболее благоприятные для этого процесса. Оксиды азота, выделяющиеся из нитрозы при окислении , частично поглощаются в верхней части башни орошающей ее нитрозой, но большая часть оксидов поступает вместе с газовым потоком в окислительную башню 3. Здесь окисляется такое количество оксида азота, которое требуется, чтобы соотношение между и соответствовало образованию ; в таком виде оксиды азота наиболее полно поглощаются в абсорбционных башнях.
В башне 3 окисляется кислородом, содержащимся в газе. Степень его окисления регулируют, пропуская часть газа по обводному газопроводу помимо башни (байпас). Из окислительной башни газ поступает в башню 4, где оксиды азота поглощаются орошающей ее серной кислотой; эту башню называют абсорбционной, или поглотительной.
При охлаждении обжигового газа и образовании серной кислоты выделяется большое количество тепла, поэтому в денитрационной и продукционных башнях орошающая кислота нагревается и перед возвратом на орошение ее приходится охлаждать. Для этого установлены холодильники 5. При производстве башенной кислоты неизбежны потери оксидов азота с отходящими газами, с продукционной кислотой и др. Для восполнения этих потерь в денитрационную башню 1 и продукционную башню 2 подается азотная кислота. Вода, необходимая для образования серной кислоты, также вводится в эти башни.
Физико-химические основы нитрозного процесса
В нитрозном процессе окисление ЗО2 происходит с помощью оксидов азота, растворенных в серной кислоте, поэтому прежде всего необходимо рассмотреть свойства оксидов азота и абсорбцию их серной кислотой.
Оксид азота представляет собой бесцветный газ, сжижающийся в бесцветную жидкость при атмосферном давлении и температуре — 151,8 °С. Кислород окисляет в газовой фазе
Эта реакция отличается от большинства гомогенных реакций тем, что ее скорость понижается с повышением температуры.
В зависимости от температуры и концентрации и в газовой фазе устанавливается определенное равновесие между компонентами реакционной массы. Зависимость константы равновесия реакции (1)
от абсолютной температуры Т выражается уравнением
где -парциальные давления в газовой фазе,МПа.
Следует полагать, что окисление кислородом протекает также и в жидкой фазе
Диоксид азота — темно-бурый газ, сжижающийся при атмосферном давлении уже в условиях комнатной температуры (20,7 °С). Диоксид азота превращается в тетраксид (бесцветный газ) по реакции
Зависимость константы равновесия этой реакции
от температуры выражается уравнением
где , -парциальные давления и в газовой фазе, МПа.
В нитрозных газах общее содержание оксидов азота меньше 15%, а степень окисления редко превышает 0,5, поэтому из уравнения (7) следует, что возможное содержание в газах нитрозного процесса очень мало.
С серной кислотой диоксид азота образует нитрозилсерную и азотную кислоты
Оксид азота (азотистый ангидрид) при комнатной температуре представляет собой газ; это соединение устойчиво только при высоком давлении. При 25 °С и давлении 0,1 МПа лишь 10,5% эквимолекулярной смеси оксидов азота находится в виде ; остальное количество азотистого ангидрида разлагается на и . При температуре 3,5 °С азотистый ангидрид снижается с образованием жидкости сине-голубого цвета, которая также быстро разлагается.
Равновесие реакции образования азотистого ангидрида
сдвигается вправо при понижении температуры и повышении давления, причем состояние равновесия устанавливается очень быстро. Константа равновесия этой реакции
определяется при различной температуре следующими уравнениями
где М — условная мольная концентрация всех оксидов азота.
В пересчете на (в моль/л) условная мольная концентрация составляет
В условиях нитрозного процесса содержание азотистого ангидрида в газе по сравнению с суммарным содержанием весьма незначительно.
С серной кислотой образует нитрозилсерную кислоту
В технике нитрозой называют растворы оксидов азота ( ) в водных растворах серной кислоты. Оксиды азота в зависимости от степени их окисления образуют нитрозилсерную кислоту в соответствии с уравнением (14) или нитрозилсерную и азотную кислоты — с уравнением (8).
Нитрозилсерная кислота представляет собой бесцветные гигроскопические кристаллы (т. пл. ),расплывающиеся при соприкосновении с влажным атмосферным воздухом. Нитрозилсерная кислота, полученная при растворении оксидов азота в безводной серной кислоте, вполне устойчива, в водных же растворах серной кислоты она гидролизуется
Степень гидролиза нитрозилсерной кислоты увеличивается с повышением температуры и понижением конденсации серной кислоты. В зависимости от содержания в исходной кислоте степень гидролиза нитрозилсерной кислоты при комнатной температуре изменяется следующим образом:
Содержание , % 98 95 92 90 87 80 70 57
, % . . . . 1,1 4,0 7,3 12,4 19,4 27,7 49,8 100
В нитрозе, содержащей менее 73% , азотистая кислота, образующаяся при гидролизе , распадается
Растворимость в водных растворах серной кислоты очень мала; в нитрозе она несколько больше, растворимость повышается при увеличении концентрации нитрозилсерной кислоты и исходной серной кислоты и понижается с ростом температуры. Ниже приведены данные о растворимости оксида азота в нитрозе (в %) при давлении, равном 0,1 МПа (760 мм рт. ст.) и температуре 40 °С:
Содержание , % . 2 4 6 8 10
в 75%-ной . . 0,04 0,11 0,17 0,26 0,28
в 92%-ной . 0,08 0,19 0,28 0,31 0,32
Растворимость в водных растворах серной кислоты, пропорциональна давлению оксидов азота и понижается с ростом температуры.
Над растворами смеси нитрозилсерной и азотной кислот парциальное давление оксидов азота повышается с увеличением концентрации . Давление над такими смесями больше, чем над растворами нитрозилсерной кислоты и растворами азотной кислоты при одинаковом содержании .
Скорость абсорбции оксидов азота
В газе башенных систем содержатся оксиды азота различной степени окисления ( ,. , ). Они должны быть возможно полнее выделены из газа в последней стадии нитрозного процесса, так как окисление протекает в жидкой фазе, непоглощенные оксиды удаляются в атмосферу с отходящими газами и таким образом теряются.
Экспериментально показано, что скорость абсорбции оксидов азота из эквимолекулярной смеси и почти в 2 раза выше, чем из газа, содержащего только . Следовательно, эквимолекулярное соотношение и в газе является оптимальным условием для протекания процесса абсорбции оксидов азота серной кислотой.
Скорость этого процесса в башне с насадкой зависит от многих факторов (скорости газа в насадке, плотности орошения, температуры и др.). Влияние каждого из них определяется конкретными условиями. Для установления оптимальных условий абсорбции оксидов азота нитрозой были проведены многочисленные исследования, позволившие определить влияние различных факторов на этот процесс. Оказалось, что до определенной скорости газового потока в насадке наиболее медленной стадией является диффузия газа через газовую пленку. Увеличение скорости газа оказывает большое влияние на скорость абсорбции оксидов азота серной кислотой, орошающей насадку. При дальнейшем же повышении скорости газа диффузия через газовую пленку перестает лимитировать процесс абсорбции и скорость газового потока уже не оказывает влияния на скорость абсорбции.
Источник
Схема производства серной кислоты нитрозным способом
Оксиды азота смешиваются H2SO4 с получением нитрозилсерной кислоты
N2O3 + 2H2SO4 = 2(NO) HSO4 + Н2О
Скорость взаимодействия N2O3 с H2SO4 выше чем у NO2, H2SO4 берут в избытке нитрозилсерная кислота растворяется в H2SO4 – этом раствор называют нитрозой.
При взаимодействии SO2 с нитрозой в присутствии Н2О происходят следующие процессы:
1) образование сернистой кислоты: SO2 + Н2О= H2SO3
2) гидролиз нитрозил серной кислоты (NO) HSO4 + Н2О = H2SO4 + HNO2
3) образование серной кислоты: H2SO3+ HNO2 = H2SO4+ H2O + 2 NO
При окислении NO в окислительном объеме в зависимости от количества кислорода может образоваться NO2 или N2O3.
Причем, N2O3 лучше поглощается серной кислотой. Превращение NO в NO2 и в N2O3 происходит в газовой фазе, поэтому процесс проводят в объемной полой башне. Скорость реакции увеличивается с повышением давления, но падает с повышением температуры. Например: при увеличении t от 0 до100˚С скорость процесса снижается в 3 раза. Затем оксиды азота поглощаются серной кислотой, осуществляется это в последних по ходу башнях, называемых абсорбционными. Получаемая нитроза направляется в продукционные башни.
Таким образом, NO2 и N2O3 возвращаются в процесс вновь и теоретически не должна расходоваться. Однако в производстве поглотить все оксиды азота без потерь не удается. Часть выходит с выхлопными газами в последней башне. Восполняются потери оксидов азота введение HNO3 в продукционную башню. На 1 т произведенной серной кислоты расход HNO3 составляет 10-20 кг в пересчете на 100%
Корпуса башен изготовлены из листовой стали, внутри футерованы кислотоупорным материалом — андезитом. Размеры башни: h = 18м; d = 10 м количество башен от 4 до 7. печной газ может содержать 9% SO2 , температура его 350˚С, J= 200кг/сут/м 3 .
Для высокой интенсивности нитрозного производства необходимо: высококонцентрированной по содержанию SO2 обжиговый газ, крепкая нитроза: 8-11% оксидов азота, повышать t в продукционной башне и понижать t кислоты и газа в абсорбционной башнях, хорошая смачиваемость всей поверхности насадки при орошении.
Недостатки этого способа:
— низкая концентрация полученной H2SO475-77%
— высокое содержание примесей (Se, As, оксиды азота)
-неполный возврат оксидов азота (добавление HNO3) Выбросы их вредны.
В настоящее время предпочтение отдается контактному способу производства, т.к. получается более чистая и концентрированная H2SO4 и олеум.
Но еще достаточно много получают и башен H2SO4 на существующих установках. Особенно на суперфосфатных заводах.
Источник
Нитрозный способ производства серной кислоты схема
Репетитор по Химии и Биологии
Главная • Биология • Химия • Резюме • Цены • Контакты
Химия  | ||
Программа  | Конспекты  | Контрольные работы  |
Репетитор по Химии
Конспекты
На этой странице Вы можете найти конспект на тему «Производство серной кислоты» и оценить уровень подготовленного материала. Я надеюсь, что Вы, обращаясь ко мне за помощью, уже не будете покупать кота в мешке. Вы будете знать, что Вашего ребенка или Вас учит знающий свое дело специалист — репетитор по химии. Более подробную информацию обо мне Вы сможете прочитать здесь.
С уважением,
доктор биологических наук,
ведущий научный сотрудник НИИ акушерства и гинекологии им. Д.О.Отта
репетитор по химии и биологии
Соколов Дмитрий Игоревич
Производство серной кислоты .
Серную кислоту в промышленности производят двумя способами: контактным и нитрозным.
Контактный способ производства серной кислоты.
Серную кислоту контактным способом производят в больших количествах на сернокислотных заводах.
I. Сырьё, используемое для производства серной кислоты:
Самородная сера S
Пирит (серный колчедан) FeS2
Сульфиды цветных металлов ZnS , Cu2S
II. Подготовка сырья.
Разберём производство серной кислоты из пирита FeS2.
1) Измельчение пирита. Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ.
2) Очистка пирита. После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют .
III. Химизм производства.
Производство серной кислоты из пирита состоит из трёх стадий.
ПЕРВАЯ СТАДИЯ — обжиг пирита в печи для обжига в «кипящем слое».
Уравнение реакции первой стадии
4FeS2 + 11O2 
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в «подвешенном состоянии» из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом — сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется принцип химического производства — безотходность производства.
 |
Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка печного газа от твёрдых частичек огарка проводят в два этапа — в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
 |
Осушку печного газа проводят в сушильной башне — снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О 2 .
ВТОРАЯ СТАДИЯ — окисление SO2 в SO3 кислородом.
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO2 + O2 
Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3).
 |
Прямая реакция является экзотермической +Q, согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём химики-технологи установили, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO3 является температура 400-500°С. Это достаточно низкая температура в химических производствах. Для того , чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор. Экспериментальным путём установили, что наилучшим катализатором для этого процесса является оксид ванадия V2O5.
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO2 и 1V O2), а справа — 2V SO3. Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO3 из контактного аппарата. Попадая в контактный аппарат смесь SO2 и О 2 продолжает нагреваться до нужной температуры, проходя между трубками в контактном аппарате.
Температура 400-500 °С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO2 в SO3. Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO2 в SO3.
Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
ТРЕТЬЯ СТАДИЯ — поглощение SO3 серной кислотой.

А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2O 
Уравнение реакции этого процесса nSO3 + H2SO4 
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Нитрозный способ производства серной кислоты.
Технологическая схема производства серной кислоты контактным путём хорошо известна из школьных учебников. В нашей стране используется и другой, так называемый нитрозный, способ её получения.
На первой стадии, одинаковой для обоих методов, получают сернистый ангидрид SO 2 . Исходным сырьём может быть, в принципе, любое вещество, содержащее серу: природные сульфиды железа (прежде всего, пирит FeS 2 ), а также сульфиды меди и никеля, сульфидные полиметаллические руды, гипс CaSO 4 . 2 H 2 O и элементарные сера. Всё больше и больше используют газы, которые выделяются при переработке и сжигании горючих ископаемых (угля, нефти), содержащих соединения серы.
Полученный SO 2 окисляют до H 2 SO 4 , используется для этого в нитрозном методе используется окислы азота. С этой стадии оба метода отличаются друг от друга.
В специальной окислительной башне 3 смешивают окись азота NO и NO 2 с воздухом в таком соотношении, чтобы половина имеющихся NO и NO 2 .
В результате газовая смесь содержит равные NO и NO 2 . Она подаётся в башни 4 и 5, орошаемые 75% — ной серной кислотой; здесь смесь окислов азота поглощается с образованием нитрозиллерной кислоты:
Раствор нитрозиллерной кислоты в серной кислоте, называемый нитрозой, орошает башни 1 и 2, куда противотоком поступает SO 2 и добавляется вода. В результате гидролиза нитрозиллерной кислоты образуется азотная кислота:
Она — то и окисляет SO 2 по уравнению:
В нижней части башен 1 и 2 накапливается 75%-ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество её меряется с выхлопными газами, приходится добавлять в систему HNO 3 , служащую источником окислов азота.
Недостаток башенного метода состоит в том, что полученная серная кислота имеет концентрацию лишь 75% (при большей концентрации плохо идёт гидролиз нитрозиллерной кислоты). Концентрирование же серной кислоты упариванием представляет дополнительную трудность. Преимущество этого метода в том, что примеси содержащиеся в SO 2 , не влияют на ход процесса, так что исходный SO 2 достаточно очистить от пыли, т.е. механических загрязнений. Естественно, башенная серная кислота бывает недостаточно чистой, что ограничивает её применение.
Охрана окружающей среды,
связанная с производством серной кислоты.
Основным сырьем для производства серной кислоты, является сера. Она относится к числу наиболее распространенных числу химических элементов на нашей планете.
Производство серной кислоты происходит в три стадии на первой стадии получают SO 2 , путем обжига FeS 2 , затем SO 3 , после чего на третьей стадии получают серную кислоту.
Научно-техническая революция и связанный с ней интенсивный рост химического производства, вызывает существенные негативные изменения в окружающей среде. Например отравление пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В результате мир оказался в тисках экологического кризиса. Вредные выбросы сернокислых заводов следует оценивать не только по действию содержащегося в них оксида серы на расположенные вблизи предприятия зоны, но и учитывать другие факторы — увеличение количества случаев респираторных заболеваний человека и животных, гибель растительности и подавление ее роста, разрушение конструкций из известняка и мрамора, повышение коррозионного износа металлов. По вине “кислых” дождей повреждены памятники архитектуры ( Тадж-Макал ).
В зоне до 300 км от источника загрязнения ( SO 2 ) опасность представляет серная кислота, в зоне до 600 км . — с ульфаты. Серная кислота и сульфаты замедляют рост с/ х культур. Закисление водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб. Помимо экологического ущерба налицо экономический ущерб — громадные суммы каждый год теряются при раскисление почв.
Рассмотрим химические метода отчистки от наиболее распространенных газообразных загрязняющих воздух веществ. Известно более 60 методов. Наиболее перспективны методы, основанные на поглощение оксида серы известняком, раствором сульфита — гидросульфита аммония и щелочным раствором алюмината натрия. Интерес также представляют каталитические методы окисления оксида серы в присутствии оксида ванадия.
Особое значение имеет очистка газов от фторсодержащих примесей, которые даже в незначительной концентрации вредно влияют на растительность. Если в газах содержится фтороводород и фтор, то их пропускают через колоны с насадкой противотоком по отношению к 5-10% раствору гидроксида натрия. В течени и одной минуты протекают следующие реакции:
Образующийся фторид натрия обрабатывают для регенерации гидроксида натрия:
Источник