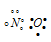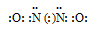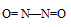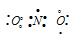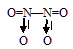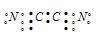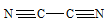- Аммиак: получение и свойства
- Аммиак
- Строение молекулы и физические свойства
- Способы получения аммиака
- Химические свойства аммиака
- Форум химиков
- Способы образования ковалентных связей
- Способы образования ковалентных связей
- Re: Способы образования ковалентных связей
- Re: Способы образования ковалентных связей
- Re: Способы образования ковалентных связей
- Re: Способы образования ковалентных связей
- Re: Способы образования ковалентных связей
- Описание с позиций метода валенттных связей (ВС) электронное строение молекул и ионов
Аммиак: получение и свойства
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Источник
Форум химиков
Способы образования ковалентных связей
Способы образования ковалентных связей
Сообщение svetlyachock » Пт май 10, 2013 9:50 pm
Сравните способы образования ковалентных связей в молекулах CH4, NH3 и ионе Nn4 + (положительный ион).
Не знаю как решить и с чего начать..Помогите пожалуйста!
Re: Способы образования ковалентных связей
Сообщение Гесс » Пт май 10, 2013 10:49 pm
Re: Способы образования ковалентных связей
Сообщение svetlyachock » Сб май 11, 2013 12:47 am
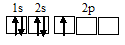
CH4 — молекулы представляет собой тетраэдр. Атом углерода образует с четырьмя атомами водорода совершенно одинаковые по длине и энергии связи. В них, согласно вышеприведенному примеру, участвуют 3 – Р электрона и 1 S – электрон, орбиталь которого стала в точности соответствовать орбиталям трех других электронов в результате произошедшей гибридизации. Такой тип гибридизации называется sp^3 гибридизацией.
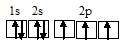
NH3 — характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода. Молекула имеет форму правильной пирамиды, в вершине которой стоят атомы азота, а в углах – водорода.
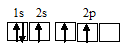
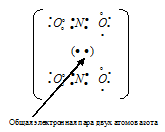
NH4 — При образовании иона аммония связь образуется за счет неподеленной пары s-электронов молекулы аммиака NH3 и свободной s-орбитали иона водорода H+.
Ион аммония является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра.
Посмотрите, проверьте пожалуйста!
Re: Способы образования ковалентных связей
Сообщение Гесс » Сб май 11, 2013 1:30 am
Переписано без ошибок.
Разве что водороды не в углах пирамиды а в основании.
И много вам такого порешать надо?
Re: Способы образования ковалентных связей
Сообщение svetlyachock » Сб май 11, 2013 1:43 am
Гесс писал(а): Переписано без ошибок.
Разве что водороды не в углах пирамиды а в основании.
И много вам такого порешать надо?
Приходится переписать.
А ничего не нужно доказывать? Я имела ввиду написать структурную формулу или электронную, как вы думаете?
Задания всего 5. Два из них, я не могу решить: это и строение молекул CN и СO, а остальные сама сделала
Re: Способы образования ковалентных связей
Сообщение Гесс » Сб май 11, 2013 2:06 am
Источник
Описание с позиций метода валенттных связей (ВС) электронное строение молекул и ионов
Задача 236.
Описать с позиций метода ВС электронное строение молекулы BF3 и иона BF4 — .
Решение:
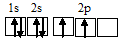
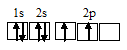
Электронная конфигурация валентного слоя атома бора 1s 2 2s 2 2p 1 . Электронное строение его валентного слоя в стационарном состоянии может быть представлено следующей графической схемой:
При возбуждении атом бора переходит в состояние 1s 2 2s 1 2p 2 , а электронное строение его валентного слоя соответствует схеме:
Три неспаренных электрона возбуждённого атома могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами фтора (1s 2 2s 2 2р 5 ), имеющими по одному неспаренному электрону, с образованием молекулы BF3.
Для образования иона BF4 — должен присоединиться один ион (1s 2 2s 2 2р 6 ), все валентные электроны которого спарены. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов из фторид-иона и одной валентной p-орбитали атома бора.
Задача 237.
Сравнить способы образования ковалентных связей в молекулах CH4, NH3 и в ионе NH4 + . Могут ли существовать ионы CH5 + и NH4 2+ ?
Решение:
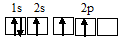
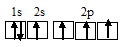
Электронная конфигурация атома углерода 1s 2 2s 2 2р 2 . Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
При возбуждении атом углерода переходит в состояние 1s 2 2s 1 2р 3 , а электронное строение его валентных орбиталей соответствует схеме:
Четыре неспаренных электрона возбуждённого атома углерода могут участвовать в образовании четырёх ковалентных связей по обычному механизму с атомами водорода (1s 1 ), имеющими по одному неспаренному, с образованием молекулы CH4.
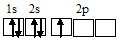
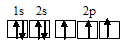
Электронная конфигурация атома азота 1s 2 2s 2 2р 3 . Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
Три неспаренных электрона невозбуждённого атома азота могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами водорода (1s 1 ), имеющими по одному неспаренному электрону, с образованием молекулы NH3.
Для образования иона NH4 + к молекуле NH3 должен присоединиться один ион H + (1s 0 ), имеющим одну свободную s-орбиталь. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов атома азота и одной вакантной s-орбитали атома водорода.
Углерод (1s 2 2s 2 2р 2 ) может образовать соединение CH4, но при этом валентные возможности углерода будут исчерпаны (нет неспаренных электронов, неподелённых пар электронов и валентных орбиталей на валентном энергетическом уровне), ион CH5 + образоваться не может.
Азот (1s 2 2s 2 2р 3 ) может образовать соединение NH3 (за счёт трёх неспаренных 2р-электронов) и ион NH4 + (за счёт донорно-акцепторного механизма между молекулой NH3 и ионом H +) , но при этом валентные возможности азота будут исчерпаны (нет неподелённых пар электронов, свободных валентных орбиталей и неспаренных электронов на валентном уровне), ион NH5 2+ образоваться не может.
Задача 238.
Какой атом или ион служит донором электронной пары при образовании иона BH4 — ?
Решение:
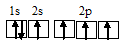
Электронная конфигурация атома бора 1s 2 2s 2 2р 1 . Электронное строение его валентного слоя в стационарном состоянии может быть представлено следующей графической схемой:
При возбуждении атом бора переходит в состояние 1s 2 2s 1 2p 2 , а электронное строение его валентного слоя соответствует схеме:
Три неспаренных электрона возбуждённого атома бора могут участвовать в образовании трёх ковалентных связей по обычному механизму с атомами водорода (1s 1 ), имеющими по одному неспаренному электрону, с образованием молекулы BH3.
Для образования иона BH4 — к молекуле BH3 должен присоединиться ион H — (1s 2 ), имеющий на валентном уровне свободную пару электронов. Связь осуществляется по донорно-акцепторному механизму за счёт пары электронов иона и свободной (вакантной) 2р-орбитали.
Задача 239.
Объяснить с позиций метода ВС способность оксидов NО и NО2 образовывать димерные молекулы.
Решение:
На внешнем электронном слое атома азота содержится два спаренных 2s-электрона и три неспаренных 2р-электрона (2s 2 2р 3 ). Атом кислорода на внешнем слое содержит пару 2s-электронов и четыре 2р-электрона, из которых два неспаренных (2s 2 2р 4 ).
а) В молекуле NO связь осуществляется по обычному ковалентному механизму за счёт двух неспаренных электронов атома азота и двух неспаренных электронов атома кислорода, с образованием двух ковалентных связей в молекуле. Электронная схема молекулы NO имеет вид:
Таким образом, в молекуле NO атом азота содержит один неспаренный 2р-электрон. Поэтому между двумя молекулами N2О2 может образоваться ковалентная связь по обычному механизму. Валентная схема молекулы N2О2 имеет вид:
В димере N2О2 атомы азота и имеют восьмиэлектронную устойчивую конфигурацию. Структурная формула имеет вид:
б) В молекуле NO2 атом азота соединён двумя ковалентными связями с одним атомом кислорода, находящимся в невозбуждённом состоянии, связь образуется за счёт двух неспаренных электронов атома азота и двух неспаренных электронов атома кислорода. Второй атом кислорода соединяется с атомом азота по донорно-акцепторному механизму за счёт пары электронов атома азота и свободной валентной 2р-орбитали атома кислорода. Молекула NO2 содержит один неспаренный электрон у атома азота.
Две молекулы NO2 могут соединиться друг с другом, образовав димер N2O4. Связь между двумя молекулами NO2 образуется по обычному ковалентному механизму за счёт неспаренных электронов атомов азота. Валентная схема димера N2O4 имеет вид:
Задача 240.
Объяснить с позиций метода ВС возможность образования молекулы С2N2.
Решение:
Электронная конфигурация атома углерода 1s 2 2s 2 2р 2. Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
При возбуждении атом углерода переходит в состояние 1s 2 2s 1 2р 3 , а электронное строение его валентных орбиталей соответствует схеме:
Электронная конфигурация атома азота 1s 2 2s 2 2р 3 . Электронное строение его валентных орбиталей в стационарном состоянии может быть представлено следующей схемой:
Для образования молекулы C2N2 к каждому атому углерода присоединяется по одному атому азота. Связи между атомами углерода и азота образуются за счёт трёх неспаренных электронов углерода и трёх неспаренных электронов азота. Оставшийся неспаренный электрон одного атома углерода образует ковалентную связь по обычному механизму с неспаренным электроном другого атома углерода. Таким образом, в молекуле C2N2 два атома углерода образуют ковалентную связь между собой и по три ковалентные связи с атомом азота по обычному механизму. Валентная схема молекулы C2N2 будет иметь вид:
Таким образом, молекула C2N2 реально существует.
Источник