Независимо от способа получения вещества его состав остается постоянным
Закон сохранения массы теоретически был описан в 1748 г, а экспериментально подтверждён в 1756 г. русским учёным М.В. Ломоносовым. М.В. Ломоносов определил, что если сосуд с металлом взвесить до и после нагревания, не вскрывая его, то масса останется неизменной. В 1789 г. французский учёный Антуан Лавуазье подтвердил выводы М.В. Ломоносова.
Формулировка закона сохранения массы:
масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Атомно-молекулярное учение объясняет этот закон так: при химической реакции общее количество участвующих атомов не изменяется, а происходит лишь их перегруппировка. Так как число атомов до и после реакции не изменяется, то их общая масса тоже не изменяется.
С точки зрения атомно-молекулярного учения при химических реакциях атомы не образуются из ничего и не исчезают, поэтому число атомов всех видов в ходе химической реакции остается неизменным. А так как масса данного атома постоянна, то и общая масса исходных веществ, состоящих из этих атомов, равна массе продуктов реакции, которые состоят из того же набора атомов.
Например, для реакции
`2″H»_2 + «O»_2 → 2″H»_2″O»`
в соответствии с законом сохранения массы должно выполняться соотношение
называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Уравнение химической реакции даёт качественную и количественную информацию о химической реакции, реагентах и продуктах реакции; его составление основывается на законах стехиометрии, в первую очередь, законе сохранения массы веществ в химических реакциях. Кроме уравнений используются полные и краткие схемы химических реакций — условные записи, дающие представление о природе реагентов и продуктов, то есть качественную информацию о химической реакции.
Для составления уравнений химических реакций, кроме знания формул реагентов и продуктов реакции, необходимо верно подобрать коэффициенты. Это можно сделать, используя несложные правила. В левой части уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяя их знаком «плюс». В правой части уравнения записывают формулы (формулу) образовавшихся веществ, также соединённых знаком «плюс». Между частями уравнения ставят знак равенства или стрелку. Затем находят коэффициенты — числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения было равным.
Зная закон сохранения массы, можно сформулировать правила составления химических уравнений:
1) необходимо знать формулы веществ, вступивших в реакцию (реагентов) и веществ, полученных в результате реакции (продуктов);
2) число атомов каждого элемента в левой части уравнения должно быть равно числу атомов этих же элементов в правой части уравнения;
3) нельзя переносить формулы веществ из одной части уравнения в другую.
Закон постоянства состава впервые сформулировал в 1808 г. французский учёный-химик Жозеф Луи Пруст.
Формулировка закона постоянства состава:
вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав.
Вещества с постоянным составом названы дальтонидами в честь английского химика Джона Дальтона.
Состав дальтонидов описывается химическими формулами с целыми стехиометрическими индексами, например `»H»_2″O»`, `»HCl»`, `»CH»_4`, `»CO»_2`, `»C»_2″H»_5″OH»`.
Из закона постоянства состава следует, что при образовании сложного вещества элементы простых веществ соединяются друг с другом в строго определенных массовых долях.
`omega_»э»` показывает, какую часть составляет масса данного элемента от массы всего вещества
где `n` – число атомов элемента в веществе;
`A_r` – относительная атомная масса элемента;
`M_r` – относительная молекулярная масса вещества.
Развитие химии показало, что наряду с веществами, имеющими постоянный состав, существуют вещества с переменным составом, который зависит от способа получения. Такие вещества назвали в честь французского химика Клода Бертолле – бертоллидами.
Бертоллиды не подчиняются законам стехиометрии. Примеры бертоллидов есть в классах оксидов, сульфидов, карбидов, гидридов.
Исходя из вышеизложенного, уточним формулировку закона постоянства состава: состав соединений с молекулярной структурой является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Источник
Урок №11. Закон постоянства состава веществ
I. НОВЫЙ МАТЕРИАЛ
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г
Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь».
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Чтобы получить сульфид железа(II), мы смешивали железо и серу в соотношении 7:4. Посмотрите видео-эксперимент . Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа(II) на каждый один атом железа приходится один атом серы (демонстрация кристаллической решетки, рис.). Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс A r (Fe), A r (S) совпадают, можно записать:A r (Fe): A r (S) = 56:32 = 7:4.
Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.
Рис. Кристаллическая решетка сульфида железа(II)
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые — бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н 2 О, НCl, ССl 4 , СO 2 . Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
II. На основе закона постоянства состава можно производить различные расчёты.
Задача №1
В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H 2 SO 4 ?
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Определим массовые отношения этих элементов в формуле H 2 SO 4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г — Н, 16 г — S и 32 г — О.
Задача №2
Водород соединяется с серой в массовых отношениях 1 : 16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Обозначим количество атомов водорода в формуле — х, а серы — у: Н х S у
m(H) : m(S) = хAr(H) : уAr(S)= х1 : у32 = (2*1) : (1*32) = 2 : 32 = 1 : 16
Следовательно, формула сероводорода Н 2 S
Задача №3
Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле — х, серы — у, а кислорода — z: Cu x S y O z
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64 : y32 : z16 = (1*64) : (1*32) : (4*16) = 64:32:64 = 2:1:2
III. РЕШИТЕ ЗАДАЧИ
№1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H 2 CO 3 .
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1 : 8?
№3. Углерод и кислород в углекислом газе соединяются в массовых отношениях 3 : 8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
Источник
Закон постоянства состава вещества.
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г
 | Он писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь». |
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Чтобы получить сульфид железа(II), мы смешивали железо и серу в соотношении 7:4.
Если смешать их в другой пропорции, например 10:4, то химическая реакция произойдет, но 3 г железа в реакцию не вступит. Почему наблюдается такая закономерность? Известно, что в сульфиде железа (II) на каждый один атом железа приходится один атом серы. Следовательно, для реакции нужно брать вещества в таких массовых соотношениях, чтобы сохранялось соотношение атомов железа и серы (1:1). Поскольку численные значения атомных масс Fe, S и их относительных атомных масс Ar(Fe), Ar(S) совпадают, можно записать:Ar(Fe):Ar(S) = 56:32 = 7:4. Отношение 7:4 сохраняется постоянно, в каких бы единицах массы ни выражать массу веществ (г, кг, т, а.е.м.). Большинство химических веществ обладает постоянным составом.
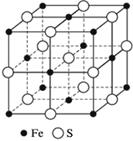
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые – бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
Дальтониды – вещества постоянного качественного и количественного состава, которые не зависят от способа их получения.
Бертоллиды – соединения переменного состава, не подчиняющиеся законам постоянства состава вещества и закону кратных отношений
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Cостав соединений молекулярной структуры, т.е. состоящих из молекул, — является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
На основе закона постоянства состава вещества можно производить различные расчеты.
Задача №1. В каких массовых отношениях соединяются химические элементы в серной кислоте, химическая формула которой H2SO4?
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(H)=1, Ar(S)=32, Ar(O)=16.
Определим массовые отношения этих элементов в формуле H2SO4
m(H) : m(S) : m(O) = 2Ar(H) : Ar(S) : 4Ar(O) = 2 : 32 : 64 = 1 : 16 : 32
Таким образом, чтобы получить 49 г серной кислоты (1+16+32=49), необходимо взять 1 г — Н, 16 г — S и 32 г — О.
Задача №2. Водород соединяется с серой в массовых отношениях 1:16. Используя данные об относительных атомных массах этих элементов, выведите химическую формулу сероводорода.
Используя ПСХЭ найдём относительные атомные массы химических элементов: Ar(H)=1, Ar(S)=32.
Обозначим количество атомов водорода в формуле — х, а серы — у: НхSу
m(H) : m(S) = хAr(H) : уAr(S)= х1 : у32 = (2х1) : (1х32) = 2 : 32 = 1 : 16
Следовательно, формула сероводорода Н2S
Задача №3. Выведите формулу сульфата меди, если массовые отношения в нём меди, серы и кислорода соответственно равны 2:1:2?
Используя ПСХЭ найдём относительные атомные массы химических элементов:
Ar(Cu)=64, Ar(S)=32, Ar(O)=16.
Обозначим количество атомов меди в формуле — х, серы — у, а кислорода — z: CuxSyOz
m(Cu) : m(S) : m(O) = хAr(Cu) : уAr(S) : zAr(O) = x64 : y32 : z16 = (1х64) : (1х32) : (4*16) = 64:32:64 = 2:1:2
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Решите задачи
№1. Применяя сведения об относительных атомных массах химических элементов, вычислите массовые отношения элементов в угольной кислоте, химическая формула которой H2CO3.
№2. Определите массу кислорода, реагирующего без остатка с 3 г водорода, если водород и кислород в данном случае соединяются соответственно в соотношении 1:8?
№3. Углерод и кислород в углекислом газе соединяются в массовых отношениях 3:8.
Выведите химическую формулу углекислого газа
№4. Определите массу водорода, реагирующего без остатка с 48 г кислорода, если водород и кислород в данном случае соединяются в соотношеннии 1:8.
Источник




