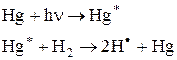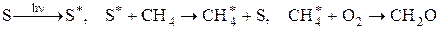Методы активации химических реакций
Известно, что для увеличения скорости химической реакции необходимо создать в веществе высокие концентрации химически активных частиц, обладающих повышенной реакционной способностью. Появление активных частиц является результатом различных физических воздействий на вещество. Любое воздействие заключается в передаче энергии. Ранее рассмотренную термоактивацию химических систем относят стандартным способам активации. Повышение температуры приводит к увеличению кинетической энергии движения молекул; передача энергии в этом случае осуществляется путем столкновений молекул и атомов. Существуют также нестандартные методы активации химических реакций, в основу которых положены взаимодействия молекул вещества с элементарными частицами или полями высоких энергий. Природа этих взаимодействий определяется тем физическим процессом, с помощью которого к системе подводится тот или иной вид энергии.
В промышленной практике наиболее часто используют воздействие тех физических процессов, для которых достаточно хорошо разработаны теоретические основы и созданы технические средства их реализации.
Рассмотрим некоторые из них.
В основе метода лежит взаимодействие вещества со светом, результатом которого является превращение световой энергии в химическую. Энергия фотонов при длине волны 760 – 200 нм равна 17- — 580 кдж/моль, что сопоставимо с энергиями связей в молекулах. Поэтому при поглощении фотонов происходит разрыв связи или ее ионизация, либо возникают возбужденные молекулы. Система при этом остается «холодной».
В промышленности реализован целый ряд фотохимических процессов, среди которых можно назвать хлорирование и сульфохлорирование предельных углеводородов, получение витамина D из эргостерона, фотонитрозирование циклогексана в производстве капролактама, некоторые процессы полимеризации и изомеризации. В качестве примера можно привести процесс получения хлорпроизводных метана, в котором первой стадией является фотохимическое инициирование распада молекулы хлора на активные радикалы: 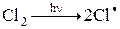
Иногда при фотохимической активации процессов используют специальные вещества – фотосенсибилизаторы, которые избирательно поглощают УФ- и ИК-излучение и передают затем энергию возбуждения оптически непрозрачным реагентам.
В качестве источников УФ-излучения в промышленности используют ртутные лампы большой мощности (60 кВт), излучающие в области 200 – 400 нм.
Вариантом фотохимической активации является флеш-фотолиз, в котором в качестве источника излучения используют электрический разряд большой силы. В результате появляется интенсивное свечение, достаточное для возбуждения молекул.
Наиболее успешно развивается еще один метод фотохимической активации – лазерный. Лазеры – это оптические квантовые генераторы; их действие основано на квантовых переходах при поглощении фотона с образованием колебательно-возбужденных молекул.
СО2 –лазеры, излучающие в ИК-диапазоне на частоте 943 см -1 , средней мощностью не более 100 Вт используют в процессах:
— бескаталитического окисления этилена до формальдегида;
— прямого окисления метана в формальдегид с использованием сенсибилизатора – серы.
При стандартном методе получения формальдегида (600 0 С, катализатор – оксиды азота) выход целевого продукта составляет 38%. При лазерной активации процесса β = 20% при селективности 90%.
Основным достоинством фотохимической активации является высокая селективность процесса, так как процесс протекает при низких температурах и излучение поглощается определенным веществом в реакционной смеси или отдельным типом связи.
Активация системы происходит под действием электрического поля, которое возникает при электрическом разряде в плазмотроне. Для производственных целей разработаны электродуговые мощностью около 1 мВт и сверхвысокочастотные мощностью до 50 – 100 кВт плазмотроны. В качестве плазмообразующего газа применяют гелий, азот, водяной пар и др.
В России работают 40 промышленных установок с плазмохимической активацией; они производят ацетилен, сажу, водород, синтез-газ, тугоплавкие соединения металлов (оксиды, карбиды, нитриды), волокнистые световоды.
При плазмохимических реакциях достигаются очень высокие температуры (от 10 3 до 2 10 5 К). Эти реакции необратимы и малоселективны. Однако они позволяют перерабатывать сырье самого широкого состава и в любом агрегатном состоянии. Технологии, основанные на плазмохимической активации, экономически целесообразны при низкой стоимости электрической энергии.
— это активация системы под воздействием поглощения упругой энергии в процессе механической обработки твердого тела. При механическом воздействии в отдельных участках твердого тела создается поле напряжений. В зависимости от свойств тела, типа и режима обработки релаксация такого поля может иметь ряд последствий: выделение тепла, образование новых поверхностей, дефектов в кристаллах, появление короткоживущих активных центров. Помимо этих эффектов, трение, раскалывание, разрушение поверхностей вызывает статическую электризацию с такой концентрацией заряда, что в материале создается электрическое поле с напряженностью, достигающей 10 7 В /см. При ударе возникают также локальные градиенты температур (600 – 800 0 С) и давлений (2 – 3 гПа).
Эффективность механического воздействия возрастает при сокращении длительности импульсов и увеличения частоты их следования. СС практической точки зрения эти требования реализуются при условии высокоскоростного удара и вибрационной обработки. Такие режимы осуществляются в планетарных и дифференциальных центробежных мельницах, в вибромельницах.
Эффекты механохимической активации легли в основу разработки механохимического синтеза карбидов, силицидов, сульфидов, нитридов металлов, интерметаллидов. Обычно эти соединения получают при температуре 1700 – 2100 0 С.
Звукохимическая активация (сонохимическая)
— активация системы под воздействием ультразвукового поля. При действии ультразвука может изменяться не только скорость, но и направление реакции. Известен целый ряд реакций, которые в отсутствии ультразвука вообще не протекают. Ультразвуковое излучение позволяет вести синтез в одну стадию с высокой селективностью.
Химическое действие ультразвуковых волн связано с явлением кавитации. Кавитация – разрыв сплошности жидкости, выражающийся в образовании и исчезновении полостей (кавитационных пузырьков) внутри жидкости под воздействием акустических полей. На поверхности кавитационного пузырька существует некомпенсированный электрический заряд. При схлопывании пузырька образуется поле напряженностью порядка 10 11 В/м. Возникающие электрические микроразряды способствуют ионизации и диссоциации молекул. Кроме того, в момент схлопывания локально повышается давление до 10 4 – 10 5 мПа и происходит мгновенный разогрев пограничных слоев жидкости, за которым следует такое же мгновенное охлаждение. В целом температура системы не повышается, поэтому процессы с ультразвуковой активацией высокоселективны.
Технически ультразвуковая активация осуществляется через пластины с излучающей поверхностью, опущенные в водную или неводную жидкую фазу и соединенные с преобразователями различного вида (гидродинамическими, электродинамическими, пьезоэлектрическими, магнитострикционными), работающими в ультразвуковом диапазоне.
— активация системы под воздействием ионизирующего излучения.
Существует два типа ионизирующего излучения:
1) коротковолновое электромагнитное (рентгеновское и γ-излучение);
2) корпускулярное (ускоренные электроны и нейтроны, протоны, α-частицы и др.).
При радиолизе в системе возникают локальные зоны с повышенным содержанием разнообразных активных частиц: ионов, свободных радикалов, фотонов, вторичных электронов и т.п.). Химические реакции под воздействием этих частиц протекают даже при очень низких температурах и с низкими энергиями активации. Однако метод активации ионизирующим излучением не всегда селективен.
Источниками излучения служат ускорители электронов с энергией 25 – 150 кВт и силой тока в пучке 20 – 200 μА, радиационные контуры ядерных реакторов, а также γ-излучение изотопов 60 Co, 137 Cs, 90 Sr. Наиболее предпочтительными являются ускорители электронов из-за радиационной безопасности, автономности и формирования пучка заданной геометрии.
Основная область применения радиационной активации – процессы полимеризации, теломеризации, модификации (сшивки) полиолефинов, эластомеров. К числу преимуществ методы можно отнести низкие температуры процесса, возможность использования реагентов в любом агрегатном состоянии, равномерное облучение вещества по всему объему и на достаточно большом расстоянии.
Активация с использованием ударных волн
Источником энергии в этом способе активации является детонация взрывчатого вещества. Взрывчатое вещество смешивают с реагентами и заряд подрывают. В зоне фронта ударной волны резко (за 10 -12 – 10 -9 с) увеличивается давление и температура, возникают деформационные напряжения в системе. В результате создается высокая концентрация точечных дефектов в исходном твердом реагенте, которая позволяет осуществить химическое превращение в течение 10 -6 с.
Метод используется в технологии производства таких материалов, как алмазы, нитрид бора.
Низкотемпературная (криохимическая) активация
— активация системы под воздействием очень низких температур (от –78 до –196 0 С). Установлено, что целый ряд реакций протекает при низких температурах с высокими скоростями. Это связывают с участием в таких реакциях молекулярных комплексов, легко образующихся при максимально возможном сближении молекул реагентов в условиях низких температур. Иногда система активизируется за счет взаимодействия электрона с дефектами кристаллической решетки, возникающими при быстрой кристаллизации.
Этот метод активации очень селективен. В технологических процессах чаще применяют комбинированное воздействие двух факторов: низкой температуры и проникающей радиации. Чаще всего метод используют в процессах полимеризации и теломеризации.
Источник
Статья по теме: Химическое инициирование
Предметная область: полимеры, синтетические волокна, каучук, резина
Химическое инициирование осуществляется под воздействием специальных веществ (инициаторов), легко распадающихся на свободные радикалы при нагревании, фотохимическом действии и т.д. К таким веществам относятся различные пероксиды, гидропероксиды, азо- и диа-зосоединения, а также окислительно-восстановительные системы.[3, С.22]
Химическое инициирование осуществляется введением в среду мономера низкомолекулярных нестойких веществ — инициаторов, легко распадающихся на свободные радикалы под влиянием теплоты или света. Наиболее распространенными инициаторами радикальной полимеризации являются перекиси и гидроперекиси (перекись водорода, перекись бензоила, гидроперекиси трет-бу-тила и изопропил-бензола и др.), азо- и диазосоединения (динит-рил азобисизомасляной кислоты, диазоаминобензол и др.), персульфаты калия и аммония. Ниже представлены реакции распада некоторых инициаторов.[4, С.42]
Инициирование цепи. Химическое инициирование является первой стадией реакции полимеризации. Оно может проводиться либо за счет подвода энергии к мономерным молекулам, либо при действии свободных радикалов, возникающих вследствие распада некоторых неустойчивых соединений. Образовавшийся свободный радикал может обладать, в зависимости от происхождения и условий образования, различным запасом энергии, что оказывает влияние на скорость процесса инициирования.[9, С.137]
В главе II переработаны и дополнены^новым [материалом разделы: «Термическое инициирование» и «Фотохимическое инициирование». Большой интерес к радиационной полимеризации со стороны многих специалистов в области макромолекулярной химии побудил автора значительно увеличить раздел «Радиационно-химическое инициирование». Этот раздел фактически написан заново. В этой же главе появился новый раздел, в котором сообщается о некоторых новых методах инициирования радикальной полимеризации.[5, С.5]
Термический, фото- и радиационный способы инициирования цепной реакции полимеризации либо мало эффективны, либо сопровождаются протеканием различных побочных явлений (разветвление, деструкция цепей и т. д.). Поэтому на практике чаще всего применяется химическое инициирование, которое осуществляется специально вводимыми в систему легко распадающимися на радикалы веществами — инициаторами. Наиболее распространены среди них перекиси, азо- и диазосоединения. Распад этих соединений на радикалы может быть осуществлен различными путями, включая нагревание, фотохимическое разложение и др. Например, при легком нагревании перекись бензоила распадается по схеме[7, С.14]
Термический, фото- и радиационный способы инициирования цепной реакции полимеризации либо мало эффективны, либо сопровождаются протеканием различных побочных явлений (разветвление, деструкция цепей и т. д.). Поэтому на практике чаще всего применяется химическое инициирование, которое осуществляется специально вводимыми в систему легко распадающимися на радикалы веществами — инициаторами. Наиболее распространены среди них перекиси, азо- и диазосоединения. Распад этих соединений на радикалы может быть осуществлен различными путями, включая нагревание, фотохимическое разложение и др. Например, при легком нагревании перекись бензоила распадается по схеме[8, С.14]
Процесс инициирования заключается в образовании первичного активного свободного радикала из молекулы мономера. Свободные радикалы могут возникать под действием различных факторов: тепла — термическое инициирование, света — фотоинициирование, частиц с высокой энергией — радиационное инициирование, специальных химических веществ (инициаторов) — химическое инициирование. Термическое инициирование как таковое применяется крайне редко, т.к. вызывает протекание различных побочных процессов (разветвление, деструкция, сшивание цепей и др.). На практике чаще всего используется химическое или смешанное термохимическое инициирование.[3, С.21]
Таким образом, несмотря на наличие некоторых общих черт у радикальной и ионной полимеризации как цепных реакций синтеза полимеров, где кинетическая цепь реакций активных растущих частиц с молекулами мономера воплощается в материальную цепь макромолекул, между ними имеются существенные различия. Прежде всего в ионной полимеризации в качестве растущей частицы действуют заряженные ионы, а в свободиорадикалыюй полимеризации— свободные радикалы с неспаренным электроном на атоме углерода. Ионы более активны и реакционпоспособны. В связи с этим требуются более тщательно контролируемые условия их образования и существования. Инициирующие системы в ионной полимеризации в основном являются каталитическими, т. е. восстанавливают свою исходную структуру, а не расходуются необратимо, как в случае радикальных инициаторов. Во многих случаях катализаторы ионной полимеризации осуществляют не только химическое инициирование полимеризации, но и координируют молекулы мономера около растущих частиц. Это позволяет получать строго регулярное пространственное (стерическое) расположение звеньев мономера в цепи полимера (стереорегулярные полимеры).[2, С.36]
Источник