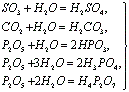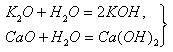- Методы получения основных классов неорганических соединений
- Оксиды
- Кислоты
- Нерастворимые гидроксиды
- Щелочи
- Лабораторные способы получения неорганических веществ
- Получение углекислого газа в лаборатории
- Получение угарного газа в лаборатории
- Получение сероводорода в лаборатории
- Получение аммиака в лаборатории
- Получение азотной кислоты в лаборатории
- Получение ортофосфорной кислоты в лаборатории
- Получение кремния в лаборатории
- Получение кислорода в лаборатории
- Получение водорода в лаборатории
- Получение хлора в лаборатории
- Получение хлороводорода в лаборатории
- Добавить комментарий Отменить ответ
- Неорганические вещества способы получения
- Классификация и номенклатура
- Получение. Свойства
- Номенклатура. Получение
- Свойства оснований
- Амфотерные гидрооксиды
- Номенклатура
- Получение. Свойства
- Классификация и номенклатура
Методы получения основных классов неорганических соединений
Оксиды
Простое вещество + кислород = оксид
S + O 2 = SO 2
4P + 5O 2 = 2P 2 O 5
2Zn + O 2 = 2ZnO
Разложение некоторых солей, кислот и нерастворимых оснований
MgCO 3 = MgO + CO 2
2Cu(NO 3 ) 2 = 2CuO + 4NO 2 + O 2
2Fe(OH) 3 = Fe 2 O 3 + 3H 2 O
H 2 SiO 3 = H 2 O + SiO 2
Кислоты
Кислотный оксид + H 2 O = кислота (SiO 2 с водой не реагирует)
Cl 2 O 7 + H 2 O = 2HClO 4
SO 3 + H 2 O = H 2 SO 4
H 2 + простое вещество-неметалл = летучее водородное соединение
(растворы HF, HCl, HBr, HI, H 2 S, H 2 Se, H 2 Te в воде являются кислотами)
H 2 + Cl 2 = 2HCl (на свету)
H 2 + S = H 2 S (при нагревании)
Сильная кислота + соль слабой кислоты = слабая кислота + соль сильной кислоты
2HNO 3 + Na 2 SiO 3 = H 2 SiO 3 + 2NaNO 3
H 2 SO 4 + MgSO 3 = H 2 SO 3 (H 2 O + SO 2 ) + MgSO 4
Нерастворимые гидроксиды
Растворимая соль + щелочь = соль + нерастворимое основание
Ni(NO 3 ) 2 + 2KOH = 2KNO 3 + Ni(OH) 2
FeCl 2 + Ca(OH) 2 = CaCl 2 + Fe(OH) 2
Щелочи
Основный оксид + вода = щелочь (в реакцию вступают оксиды щелочных и щелочноземельных металлов)
BaO + H 2 O = Ba(OH) 2
K 2 O + H 2 O = 2KOH
Активный металл + вода = щелочь + H 2
2Na + 2H 2 O = 2NaOH + H 2
Ca + 2H 2 O = Ca(OH) 2 + H 2
Кислотный оксид + основный оксид = соль
SO 3 + CaO = CaSO 4
N 2 O 5 + K 2 O = 2KNO 3
Кислотный оксид + щелочь = соль + вода
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O
Cl 2 O 7 + 2KOH = 2KClO 4 + H 2 O
Основный оксид + кислота = соль + вода
CuO + H 2 SO 4 = CuSO 4 + H 2 O
Fe 2 O 3 + 6HBr = 2FeBr 3 + 3H 2 O
Кислота + основание = соль + вода
H 3 PO 4 + 3KOH = K 3 PO 4 + 3H 2 O
3H 2 SO 4 + 2Fe(OH) 3 = Fe 2 (SO 4 ) 3 + 6H 2 O
Соль слабой кислоты + сильная кислота = соль сильной кислоты + слабая кислота
K 2 SO 3 + 2HCl = 2KCl + H 2 O + SO 2 (H 2 SO 3 )
NaCl + H 2 SO 4 = NaHSO 4 + HCl
Растворимая соль + растворимая соль = нерастворимая соль + соль
CuCl 2 + Na 2 S = CuS + 2NaCl
Ba(NO 3 ) 2 + K 2 SO 4 = BaSO 4 + 2KNO 3
Растворимая соль + щелочь = соль + нерастворимое основание
Fe(NO 3 ) 3 + 3NaOH = 3NaNO 3 + Fe(OH) 3
MnCl 2 + Ca(OH) 2 = CaCl 2 + Mn(OH) 2
Кислота + металл (находящийся в ряду напряжений левее водорода) = соль + водород
2HCl + Fe = FeCl 2 + H 2
2H 3 PO 4 + 6K = 2K 3 PO 4 + 3H 2
Важно: кислоты-окислители (HNO 3 , конц. H 2 SO 4 ) реагируют с металлами по-другому.
Растворимая соль металла (*) + металл (**) = соль металла (**) + металл (*)
Fe + CuCl 2 = FeCl 2 + Cu
Ni + 2AgNO 3 = Ni(NO 3 ) 2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Металл + неметалл = соль
2Fe + 3Cl 2 = 2FeCl 3
Ca + Se = CaSe
Возможно, вам также будут интересны другие разделы справочника по химии:
Источник
Лабораторные способы получения неорганических веществ
Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений.
Лабораторные способы получения веществ отличаются от промышленных:
| Лабораторные способы получения веществ | Промышленные способы получения веществ |
| Реагенты могут быть редкими и дорогими | Реагенты распространенные в природе и дешевые |
| Условия реакции мягкие, без высоких давлений и сильного нагревания | Условия реакции могут быть довольно жесткими, допустимы высокие давления и температуры |
| Как правило, реагенты — жидкости или твердые вещества | Реагенты — газы или жидкости, реже твердые вещества |
Получение углекислого газа в лаборатории
Углекислый газ CO2 в лаборатории получают при помощи аппарата Киппа при взаимодействии соляной кислоты с мелом или мрамором:
Получение угарного газа в лаборатории
В лаборатории угарный газ проще всего получить, действуя концентрированной серной кислотой на муравьиную кислоту:
HCOOH → H2O + CO
Получение сероводорода в лаборатории
Сероводород в лаборатории легко получить действием разбавленной серной кислоты на сульфиды металлов, например, сульфид железа (II):
Эта реакция также проводится в аппарате Киппа.
Получение аммиака в лаборатории
Аммиак в лаборатории получают при нагревании смеси солей аммония с щелочами.
Например , при нагревании смеси хлорида аммония с гашеной известью:
Эти вещества тщательно перемешивают, помещают в колбу и нагревают.
Получение азотной кислоты в лаборатории
Азотную кислоту в лаборатории получают действием концентрированной серной кислоты на кристаллический нитрат натрия и калия при небольшом нагревании:
При этом менее летучая кислота вытесняет более летучую кислоту из соли.
При более сильном нагревании образуется сульфат натрия, но и образующаяся азотная кислота разлагается.
Получение ортофосфорной кислоты в лаборатории
При взаимодействии ортофосфата кальция с серной кислотой при нагревании образуется ортофосфорная кислота:
Получение кремния в лаборатории
В лаборатории кремний получают при взаимодействии смеси чистого песка с порошком магния:
2Mg + SiO2→ 3MgO + Si
Получение кислорода в лаборатории
Кислорода в лаборатории можно получить при разложении целого ряда неорганических веществ.
Чаще всего в лаборатории кислород получают разложением перманганата калия:
Выделяющийся кислород можно собрать вытеснением воздуха:
Также кислород можно собирать методом вытеснения воды:
Обнаружить кислород можно очень просто: тлеющая лучинка вспыхивает в атмосфере кислорода.
Кислород можно получить также разложением пероксида водорода:
Реакция катализируется оксидом марганца (IV) MnO2.
Разложение бертолетовой соли KClO3 — еще один способ получения кислорода в лаборатории:
2KClO3 → 2KCl + 3O2
Реакция также протекает в присутствии катализатора, оксида марганца (IV) MnO2.
Получение водорода в лаборатории
Водород в лаборатории можно получить различными методами.
Под действием электрического тока вода разлагается на водород и кислород:
При взаимодействии минеральных кислот (не сильных окислителей) с активными металлами и металлами средней активности также образуется водород.
Например , соляная кислота реагирует с цинком с образованием водорода:
Zn + 2HCl → ZnCl2 + H2
Собирать водород можно методом вытеснения воздуха, так как водород — гораздо более легкий газ, чем воздух.
Также для собирания водорода подходит метод вытеснения воды, так как водород плохо растворим в воде:
Водород выделяется также при взаимодействии активных металлов (расположенных в ряду активности до магния) с водой.
Например , натрий активно реагирует с водой с образованием водорода:
2Na + 2H2O → 2NaOH + H2
Получение хлора в лаборатории
Стр. 162в лаборатории можно получить различными методами.
Под действием электрического тока вода разлагается на водород и кислород:
При взаимодействии минеральных кислот (не сильных окислителей) с активными металлами и металлами средней активности также образуется водород.
Получение хлороводорода в лаборатории
Стр. 162в лаборатории можно получить различными методами.
Под действием электрического тока вода разлагается на водород и кислород:
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Источник
Неорганические вещества способы получения
1. Окисление простых веществ кислородом:
2. Окисление сложных веществ кислородом:
2CuS + 3O2 = 2CuO + 2SO2↑.
3. Разложение гидроксидов тяжелых металлов или кислот:
4. Разложение солей при нагревании:
Гидроксиды
1. Взаимодействие активных металлов или их оксидов с водой:
2. Труднорастворимые основания получают по реакциям обмена:
3. Гидроксиды щелочных и щелочноземельных металлов получают электролизом водных растворов солей:
H2O 
(+) 2Cl — — 2e → Cl2
(-) 2H + + 2e → H2
электролиз
2KCl + 2H2O → 2KOH + H2^ + Cl2↑.
Кислоты
1. Растворение кислотных оксидов в воде:
CO2 + H2O 
2. Кислоты можно получить по реакции обмена, если в результате идет процесс образования малодиссоциированного соединения:
HCl + AgNO3 
1. Взаимодействие активных металлов с кислотами:
2. Взаимодействие основных или амфотерных оксидов с кислотами:
3. Взаимодействие кислот с основаниями (реакция нейтрализации):
Источник
Классификация и номенклатура
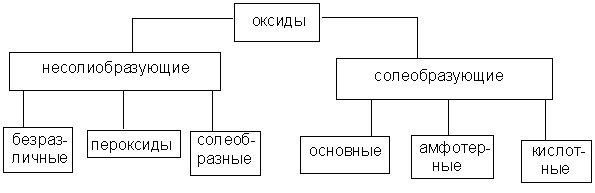
Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород.
Оксиды делят на две группы: солеобразующие и несолеобразующие , а каждую из групп, в свою очередь, подразделяют на несколько подгрупп
Многие элементы проявляют переменную валентность и дают оксиды различного состава, поэтому прежде всего следует рассмотреть номенклатуру оксидов.
Согласно современной международной номенклатуре любой оксид называется оксидом с указанием римскими цифрами степени окисления элемента, например: S О2 — оксид серы ( IV ), SO 3 — оксид серы ( VI ), CrO — оксид хрома ( II ), С r 2О3 — оксид хрома ( III ), С r О3 — оксид хрома ( VI ).
Солеобразующие оксиды принято делить на три группы (основные, амфотерные , кислотные).
Получение. Свойства
Основные оксиды . К основным относятся оксиды типичных металлов, им соответствуют гидроксиды , обладающие свойствами оснований.
Получение основных оксидов:
1. Окисление металлов при нагревании в атмосфере кислорода:
2 Mg + О 2 = 2М g О,
2С u + О 2 = 2С u О.
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды , поэтому оксиды Na 2О, К2О крайне труднодоступны.
2. Обжиг сульфидов:
2 CuS + ЗО 2 = 2С u О + 2 S О2,
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
3. Разложение гидроксидов:
| t o | ||
| Cu(OH)2 | = | CuO + H2O |
Этим методом нельзя получить оксиды щелочных металлов.
4. Разложение солей кислородсодержащих кислот:
| t o | ||
| BaCO3 | = | BaO + CO2 |
| t o | ||
| 2Р b ( N О3)2 | = | 2 Pb О + 4 NO 2+O2 |
| t o | ||
| 4FеSО4 | = | 2Fe2O3 + 4SO4 + O2 |
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
| t o | ||
| [ZnOH]2 | = | 2ZnO + CO2 + H2 O |
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О 2 — , поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
| t o | ||
| 2HgO | = | 2Hg + O2 |
| t o | ||
| 2Ag2O | = | 4Ag + O2 |
Основные оксиды при нагревании могут вступать в реакции кислотными и амфотерными оксидами, с кислотами:
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
| t o | ||
| Fe2O3+2Al | = | Al 2O3 + 2Fe |
| t o | ||
| 3CuO+2NH3 | = | 3Cu + N2+3H2O |
| t o | ||
| 4FeO+O2 | = | 2Fe2 + O3 |
Кислотные оксиды. Кислотные оксиды представляют ее оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:
| t o | ||
| 4P+5O2 | = | 2P2 + O5 |
| t o | ||
| 2ZnS+3O2 | = | 2ZnO + 2SO2 |
| t o | ||
| K2Cr2O7+H2SO4 | = | 2CrO3↓+ K2So4+H2O |
| Nа2SiO3 + 2НСl | = | 2NаСl + SiO2↓ + Н2О |
Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:
Наиболее типичными для кислотных оксидов являются их реакции с основными и амфотерными оксидами, с щелочами:
| t o | ||
| P2O5+Al2O3 | = | 2AlPO4 |
Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:
| t o | ||
| CO2+C | = | 2CO |
| 2SO2+O2 | t o | 2SO3 |
 |
Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
К числу амфотерных оксидов относятся оксид алюминия А l 2О3, оксид хрома ( III ) С r 2О3, оксид бериллия ВеО , оксид цинка Zn О , оксид железа ( III ) Fe 2О3 и ряд других.
Идеально амфотерным оксидом является вода Н2О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:
С u 2+ + Н2О 
СО3 2- + Н2О 
Номенклатура. Получение
Диссоциацию оснований более точно, с учетом гидратац ии ио нов, сле дует писать так:
КО Н( к.) 
NH3 . H 2O 1 
1. Это соединение часто записывают как NH4OH и называют гидроксидом аммония.
Основания в воде диссоциируют на ионы металла (аммония в случае гидрата аммиака) и гидроксид-ионы. Никаких других анионов, кроме гидроксид-ионов,основания не образуют.
Согласно международной номенклатуре названия оснований составляются из слова гидроксид и названия металла. Например, КаОН — гидроксид натрия, КОН — гидроксид калия,С а ( ОН)2 — гидроксид кальция. Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках: Fe (ОН )2 -гидроксид железа ( II ), Fe (ОН)3 — гидроксид железа ( III ).
Помимо этих названий, для некоторых наиболее важных оснований применяются и другие. Например, гидроксид натрия Na ОН называют едкий натр; гидроксид калия КОН -едкое кали; гидроксид кальция С а ( ОН)2 — гашеная известь; гидроксид бария Ва(ОН)2 — едкий барит.
Получение . Растворимые в воде основания, т.е. щелочи, получаются при взаимодействии металлов или их оксидов с водой:
2 Na + 2Н2О = 2 Na ОН + Н 2
Малорастворимые в воде основания получаются косвенным путем, а именно: действием щелочей на водные растворы соответствующих солей.
А l Сl3 + З Na ОН = А l (ОН)3↓+ З Na Сl
Свойства оснований
Растворы щелочей мыльные на ощупь. Изменяют окраску индикаторов: красного лакмуса — в синий цвет, бесцветного фенолфталеина — в малиновый цвет.
Щелочи Na ОН и КОН очень устойчивы к нагреванию. Например, Na ОН кипит при температуре 1400 o С без разложения.Однако большинство оснований при нагревании разлагается. Например:
Важнейшие химические свойства оснований обусловливаются их отношением к кислотам, кислотным оксидам и солям.
1. При взаимодействии оснований с кислотами в эквивалентных количествах образуются соль и вода:
КОН + НС l = КСl + Н2O
Взаимодействие оснований с кислотами называется реакцией нейтрализации . Любая реакция нейтрализации сводится к взаимодействию ионов О Н — и Н + с образованием малодиссоциированного электролита — воды.
2. Щелочи взаимодействуют с кислотными оксидами:
Последняя реакция протекает лишь при нагревании.
3. Щелочи взаимодействуют с растворами различных солей. Например:
С точки зрения теории электролитической диссоциации все общие щелочные свойства растворов (мыльность на ощупь, изменение цвета индикаторов,взаимодействие с кислотами, кислотными оксидами, солями) обусловлены гидроксид-ионами ОН — .
Амфотерные гидрооксиды
Амфотерными называются такие гидроксиды , которые при диссоциации образуют одновременно и катионы водорода Н + и гидроксид-ионы О Н — . Такими являются А l (ОН)3, Zn (ОН)2, Cr (ОН)3, Ве (ОН)2, G е(ОН)2, Sn (ОН)4, Pb (ОН)2 и др.
Амфотерные гидроксиды взаимодействуют как с растворами кислот, так и с растворами щелочей. Например;
В настоящее время растворение амфотерных гидроксидов в щелочных растворах обычно рассматривается как процесс образования гидроксосолей ( гидроксокомплексов ). Экспериментально доказано существование гидроксокомплексов многих металлов:
и т.д. Наиболее прочны гидроксокомплексы алюминия, а из них — [Аl(ОН)4(Н2О)2] — .
Такой подход не меняет сделанных выводов: у амфотерного гидроксида , например у А l (ОН)3 и ему подобных, в кислой среде равновесие смещается в сторону образования солей алюминия, в щелочной — в сторону образования гидроксокомплексов . Очевидно, в водном растворе существует равновесие,которое более точно описывается уравнением
Номенклатура
Уравнения диссоциации кислот можно записать более точно, с учетом гидратации ионов
НCl (газ.) 
СН3СОО Н( водн .) 
Как видно, кислоты в воде диссоциируют на ионы водорода и кислотные остатки — анионы. Никаких других катионов, кроме ионов водорода, кислоты не образуют. Механизм диссоциации кислот : вокруг полярных молекул ориентируются диполи воды и в результате взаимодействия полярные молекулы превращаются в ионные, а последние — в гидратированн ые ионы.
Числом ионов водорода, образуемых каждой молекулой кислоты при диссоциации, определяется заряд кислотного остатка (аниона). Соляная и азотная кислоты образуют только однозарядные кислотные остатки (Cl — , NO3 — ); молекула серной кислоты (Н2SО4) может образовать два кислотных остатка: однозарядный (НSO4 — ) и двухзарядный (SO4 2- ); молекула фосфорной кислоты может дать три кислотных остатка: однозарядный, двухзарядный и трехзарядный (Н2РO4 — , НРО4 2- и PO4 3- ).
Различают кислородные и бескислородные кислоты. Как показывает само название, первые содержат кислород (например, Н2SО4, НNО3, Н3РО4), вторые его не содержат (например, НСl, НВ r , НI, Н2S).
Названия кислородных кислот производятся от названия неметалла с прибавлением окончаний –ная , -вая , если степень окисления его соответствует номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке: -оватая , -истая , -оватистая :
|
|
Если элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот, то к названию кислоты с меньшим содержанием кислородных атомов добавляется префикс «мета» , при наибольшем числе — префикс « орто» :
| НВО2 — метаборная кислота | Н2n(SiO3)n— полиметакремниевая кислота |
| Н3ВО3— ортоборная кислота | H4SiO4 — ортокремниевая кислота |
Названия бескислородных кислот производятся от названия неметалла с окончанием о и прибавлением слова водородная :
Н F — фтороводородная, или плавиковая, кислота
Н Cl — хлороводородная , или соляная, кислота
Н Br — бромоводородная кислота
Н I — йодоводородная кислота
Н2S — сероводородная кислота
Получение. Свойства
Большинство кислородных кислот получают при взаимодействии оксидов неметаллов (в высокой степени окисления) с водой. Например:
Если такие оксиды нерастворимы в воде, то соответствующие им кислоты получают косвенным путем, а именно, действием другой кислоты (чаще всего серной)на соответствующую соль. Например:
Бескислородные кислоты получают путем соединения водорода с неметаллом с последующим растворением водородного соединения в воде. Таковы Н F , НС l , НВ r , Н I , H 2 S .
Свойства . Кислоты представляют собой жидкости (Н2 SO 4, Н NO 3 и др.) или твердые вещества (Н3 PO 4 и др.). Многие кислоты хорошо растворимы в воде.Растворы их имеют кислый вкус, разъедают растительные и животные ткани, изменяют синий цвет лакмуса на красный.
Ниже перечислены важнейшие химические свойства кислот:
1 . Взаимодействие с металлами (с образованием соли и выделением водорода). Например:
2НС l + F е = F еС l 2 + Н 2 ↑
При этом атомы металлов окисляются, а ионы водорода восстанавливаются. Металлы, стоящие в ряду стандартных электродных потенциалов правее водорода,из кислот его не вытесняют. Не выделяется водород и при взаимодействии металлов с концентрированными азотной и серной кислотами. В этом случае восстанавливаются(понижают степень окисления) азот и сера .
2 . Взаимодействие с основными оксидами, основаниями и солями:
С точки зрения теории электролитической диссоциации, все общие характерные свойства кислот (кислый вкус, изменение цвета индикатора, взаимодействие с основаниями,основными оксидами, солями) обусловлены ионами водорода Н + , точнее ионами гидроксония Н3 O + .
Классификация и номенклатура
Соли принято делить на три группы: средние , кислые и основные . В средних солях все атомы водорода соответствующей кислоты замещены на металла, в кислых солях они замещенытолько частично, в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки.
Существуют также некоторые другие типы солей, например: двойные соли, в которых содержатся два разных катиона и один анион: СаСО3 . МgСО3 (доломит), КСl . NaСl (сильвинит), КАl(SО4 )2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: СаОСl2 (или Са(ОС l)Сl); комплексные соли, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами: K 4[Fе(СN)6] (желтая кровяная соль), К3[Fе(СN)6] (красная кровяная соль), [N аАl(ОН)4], [Ag(NН3)2]Сl; гидратные соли, в которых содержатся молекулы кристаллизационной воды: СuSО>4 . 5Н2О (медный купорос), Na2SO4 . 10Н2О (глауберова соль).
Название солей образуется из названия аниона, за которым следует название катиона.
Для солей бескислородных кислот к названию неметалла добавляется суффикс-ид, например хлорид натрия N аСl, сульфид железа (II) FеS и др.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляется окончание –ат . Для высших степеней окисления, — ит для более низких (для некоторых кислот используется приставка гипо — для низких степеней окисления неметалла; для солей хлорной и марганцовой кислот используется приставка пер- ): карбонат кальция СаСО3, сульфат железа (III) Fе2(SО4)3, сульфит железа (II) FеSО3, гипохлорит калия КОСl, хлорит калия КСlО 2, хлорат калия К ClO 3, перхлорат калия К ClO 4, перманганат калия К MnО 4, дихромат калия К2Сr2O7.
Кислые и основные соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначается приставкой гидро- а группа ОН — приставкой гидрокси -: N аНS — гидросульфид натрия, N аНSО3 — гидросульфит натрия, Mg(ОН)Сl— гидроксихлоридмагния, Аl(ОН)2Сl — дигидроксихлорид алюминия.
В названиях комплексных ионов сначала указываются лиганды. Название комплексного иона завершается названием металла с указанием соответствующей степени окисления (римскими цифрами в скобках).
В названиях комплексных катионов используются русские названия металлов, например: [Cu(NН3)4]Сl2— хлорид тетраамминмеди (II), (Аg(NH3)2)2SO4 —сульфат диамминсеребра (I).
Названия гидратных солей образуются двумя способами. Можно воспользоваться системой наименования комплексных катионов, описанной выше; например, медный купорос [Сu(Н 2О)4]SО4 . Н2O (или С uSО4 . 5Н 2O) в таком случае будет называться сульфат тетраакво меди(II). Однако для наиболее известных гидратных солей чаще всего степень гидратации указывают численной приставкой к слову «гидрат», например: С uSO 4 . 5Н2O — пентагидрат сульфата меди (II), Na 2SО4 . 10Н2O — декагидрат сульфата натрия, СаСl 2 . 2Н2O— дигидрат хлорида кальция.
В названиях комплексных анионов используются латинские названия металлов с суффиксом -ат , например: К[Аl(ОН)4] — тетрагидроксиалюминат калия, Nа[Сr(ОН)4] — тетрагидроксихромат натрия, К 4 [Fе(СN)6] — гексацианоферрат (II) калия.
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса .
Соли бескислородных кислот , кроме того , могут быть получены при непосредственном взаимодействии металлов и неметаллов ( С l , S и т . д .).
Многие соли устойчивы при нагревании . Однако , соли аммония , а также некоторые соли малоактивных металлов , слабых кислот и кислот , в которых элементы проявляют высшие или низшие степени окисления , при нагревании разлагаются :
4 KClO 3 = ЗК ClO 4 + КС l .
При химических реакциях солей проявляются особенности как катионов , так и анионов , входящих в их состав . Ионы металлов , находящиеся в растворах , могут вступать в реакции с другими анионами с образованием нерастворимых соединений или ж е в окислительно — восстановительные реакции :
Zn + Cu 2+ = Zn 2+ + Cu,
Cu + 2Ag + = Cu 2+ + 2Ag,
Первые две реакции показывают , что соли могут реагировать с кислотами , солями или основаниями , а последние три указывают на окислительные и восстановительные свойства солей .
С другой стороны , анионы , входящие в состав солей , могут соединяться с катионами с образованием осадков или малодиссоциированных соединений , а также участвовать в окислительно — восстановительных реакциях :
S 2- + 2 H + = H 2 S ↑,
Таким образом , соли могут реагировать с солями , кислотами ( по типу обмена ), металлами и неметаллами .
Задача 1 . Приведите три примера реакций между оксидом элемента 2-го периода и оксидом элемента 4-го периода.
Решение. Один из оксидов должен быть основным (или амфотерным ), а другой — кислотным (или амфотерным ). Во II периоде Li 2О — основной оксид, ВеО — амфотерный , СО 2 и N 2О5 — кислотные. В IV периоде К2О, СаО , F еО — основные оксиды, С r 2О3 — амфотерный , А s 2О5, Cr О3, S еО3 — кислотные оксиды. Уравнения реакций:
Задача 2 . Приведите примеры образования соли: а) из двух простых веществ; б) из двух сложных веществ; в) из простого и сложного вещества.
а) Железо при нагревании с серой образует сульфид железа (II):
б) Соли вступают друг с другом в обменные реакции в водном растворе, если один из продуктов реакции выпадает в осадок:
А gN О3 + N аС l = А g С l ↓ + N а N О3 .
в) Соли образуются при растворении металлов в кислотах:
Задача 3 . Приведите примеры реакций образования основания: а) из двух простых веществ; б) из двух сложных веществ; в) из простого и сложного вещества.
а) Из двух простых веществ можно получить единственное основание — аммиак (основание Льюиса):
Реакция протекает при высоких давлении и температуре в присутствии катализаторов.
б) Два сложных вещества, образующих основание, это, например, — оксид щелочного металла и вода:
в) Щелочные и щелочноземельные металлы активно реагируют с водой, образуя щелочь и водород:
Задача 4 . Приведите уравнения реакций одной и той же средней соли а) с кислотой, б) с основанием.
Решение. Реагировать как с кислотой, так и с основанием могут соли аммония и слабых кислот, например карбонат аммония:
Последняя реакция протекает при нагревании.
Задача 5 . Приведите уравнение реакции, в которой из трех сложных веществ образуется кислая соль.
Решение. Пример — образование гидрокарбоната аммония при пропускании избытка углекислого газа через водный раствор аммиака:
Источник