Методы получения коллоидных растворов



Методы получения и исследования дисперсных систем
Лекция 8
Для получения коллоидных растворов необходимо: 1) достичь коллоидной степени дисперсности; 2) подобрать дисперсионную среду, в которой нерастворимо вещество дисперсной фазы; 3) подобрать третий компонент — стабилизатор, сообщающий коллоидной системе устойчивость.
Образовывать коллоидные растворы в воде могут металлы, малорастворимые в ней оксиды, гидроксиды, кислоты, соли. Хорошо растворимые в воде вещества, но малорастворимые в неполярных органических растворителях не способны образовывать гидрозоли, но могут образовывать органозоли. Так, например, не возможно получить гидрозоль натрия хлорид, но возможно получение его коллоидного раствора в бензоле. И наоборот, можно легко получить гидрозоль камфоры, практически нерастворимой в воде, но невозможно получить ее коллоид в спирте, поскольку камфора хорошо растворима в этом растворителе.
В качестве стабилизаторов используют вещества, препятствующие агрегации коллоидных частиц в более крупные и выпадению их в осадок. Таким действием обладают: небольшой избыток одного из реагентов, из которых получается вещество дисперсной фазы, ПАВ, белки, полисахариды и др.
По размеру частиц дисперсной фазы коллоидные системы (d ≈10 -7 — 10 -9 м ) занимают промежуточное положение между микрогетерогенными (грубодисперсными) системами (d >10 -7 м ) и истинными растворами, (размер растворенных частиц d -9 м ) низкомолекулярных веществ. По способу достижения коллоидной степени дисперсности различают методы (рис. 12.1): диспергационные (от лат.disper-
| Грубодисперсная система | Коллоидно-дисперсная система | Истинный раствор |
| d>l(r 7 M | 10- 7 M10- 9 | d 9 M |
| ДИСПЕРГИРОВАНИЕ | КОНДЕНСИРОВАНИЕ |
Увеличение степени измельчения
Рис.12.1 Способы достижения коллоидной степени дисперсности gire — измельчать) — получение частиц дисперсной фазы путем дробления более крупных частиц и конденсационные (от лат. condensire — укрупнять) — получение частиц дисперсной фазы путем объединения атомов, молекул, ионов
Методы диспергирования. Для измельчения жидкостей и твердых тел необходимо совершить работу. Эта работа тем больше, чем меньше размер частиц дисперсной фазы. Энергия, расходуемая при диспергировании, идет на преодоление молекулярных сил притяжения и на увеличение межфазной поверхности
Для достижения требуемой степени дисперсности применяют механическое дробление, ультразвуковое, электрическое и химическое диспергирование.
Механическое дробление осуществляют с помощью шаровых и коллоидных мельниц в присутствии жидкой дисперсионной среды и стабилизатора. Схема шаровой мельницы представлена на рис. 12.2, а. Шары измельчают материал дисперсной фазы при вращении за счет раздавливания, раскалывания и истирания.
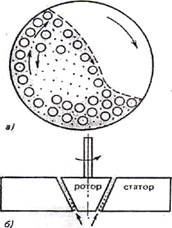
Измельчение с помощью ультразвука происходит под действием источника ультразвуковых колебаний на смесь нерастворимых друг в друге жидкостей или твердого тела с жидкостью.
Электрическое диспергирование используют для получения золей металлов. К электродам, изготовленным из диспергируемого металла и опущенным в подщелоченную воду, подводят постоянный электрический ток и сближают электроды до образования электрической дуги. Металл, из которого изготовлены электроды, при этом превращается в пар, конденсирующийся в жидкой среде в золь. При получении органозолей (дисперсионная среда органический растворитель) применяют высокочастотный искровой заряд.
Химическое диспергирование, или пептизация, заключается в химическом воздействии на осадок.
Конденсационные методы. Взаимодействие ионов и молекул с образованием частиц коллоидных размеров может быть достигнута физическими и химическими методами.
Физическая конденсация имеет в своей основе физические методы воздействия. Чаще всего для получения золей используют метод замены растворителя. Вначале готовят истинный раствор вещества в летучем растворителе (например, канифоли в спирте) и добавляют к жидкости, в которой вещество нерастворимо (например, к воде). Летучий растворитель удаляют нагреванием. В результате происходит резкое понижение растворимости. Молекулы вещества конденсируются в частицы коллоидных размеров и образуется коллоидный раствор.

При химической конденсации для получения коллоидных растворов используют любые реакции, в результате которых образуются труднорастворимые соединения:
Источник
Методы получения коллоидных растворов
Коллоидные растворы по размерам частиц занимают промежуточное положение между грубодисперсными и истинными. Поэтому выделяют две группы методов их получения:
1) дисперсионные (дробление грубодисперсных частиц до частиц коллоидной степени дисперсности);
2) конденсационные (укрупнение частиц истинных растворов в агрегаты коллоидных систем).
Эти группы методов, в свою очередь, делятся на физические и химические.
Самым распространённым из дисперсных химических методов получения золей является метод пептизации (процесс перевода осадка (гидроксида металла) в коллоидный раствор под действием диспергирующих средств).
В качестве пептизатора используют хорошо растворимую соль соответствующего металла. Например, мицелла золя гидроксида железа (III) Fe(OH)3 получается в присутствии пептизатора FeCl3 –сильного электролита:
nFeCl3 ↔ n Fe 3+ + 3nCl —
ядро адсорбционный слой диффузионный слой
гранула
мицелла
К конденсационным химическим методам относят:
1) метод обменной реакции, в ходе которой получается нерастворимое вещество, причём одно исходное вещество должно быть в избытке:
AgNО3 + KI → AgI ↓ + KNО3
nAgNО3 ↔ nAg + + n NO3‾
ядро адсорбционный слой дифф. слой
2) метод гидролиза, в результате которого получается нерастворимое соединение.
Fe(OH)3 + HCl → FeОCl + 2H2O
Продукт этой реакции – хлорокись железа(III) может диссоциировать и стабилизировать мицеллообразование.
FeOCl ↔ FeO + +Сl‾
3) метод окислительно-восстановительных реакций
5.4.Свойства коллоидных растворов
1. Молекулярно-кинетические свойства, общие для истинных и коллоидных растворов: осмос, осмотическое давление, диффузия, броуновское движение.
Но в коллоидных растворах эти процессы идут медленнее.
2. Оптические свойства – это специфические свойства, присущие только коллоидным растворам.
a) опалесценция — это явление рассеяния проходящего через коллоидный раствор света с изменением окраски золя.
b) эффект Фарадея-Тиндаля — явление изменения формы пучка проходящего через раствор света на конусовидную.
3. Электрические свойства
a) электрофорез — явление перемещения частиц дисперсной фазы в электрическом поле;
b) электроосмос — это явление перемещения частиц дисперсионной среды (растворителя) относительно неподвижной дисперсной фазы. Например, течение жидкости через капиллярные системы под влиянием разности потенциалов.
На этих свойствах основаны методы введения лекарственных препаратов через кожу.
4. Электрокинетические свойства характеризуют возникающие в мицелле потенциалы.
a) электротермодинамический (Е) потенциал — возникает на границе ядра и слоя потенциалопределяющих ионов. Величина этого потенциала постоянна и зависит от числа потенциалопределяющих ионов, у многих коллоидных растворов она достигает 1В.
b) электрокинетический ζ, (дзетта) потенциал — возникает на границе адсорбционного и диффузионного слоев. Величина ζ — потенциала пропорциональна числу ионов диффузионного слоя и ионной силе раствора.
Концентрация противоионов в диффузионном слое убывает от центра к периферии, ζ-потенциалв этом направлениитак же падает до нуля. Если все противоионы перейдут в адсорбционный слой, то ζ-потенциал станет равен 0.
Состояние системы, когда общий заряд её равен нулю, называется изоэлектрическим состоянием.
Коллоидные растворы являются термодинамически неустойчивыми.
Источник
Получение и способы очистки коллоидных систем
Получение коллоидных систем
Для получения коллоидных систем, применяют, в основном, 2 метода:
- Дисперсионный метод – используют дробление твердого вещества до частиц, размером, соответствующих коллоидам. Измельчение производят:
- механически при помощи шаровых мельниц, гомогенизаторов или ультразвуковых дезинтеграторов;
- с помощью физико-химических способов, таких как пептизация, добавление поверхностно–активных веществ.
- Конденсационный метод — укрупнение частиц путем агрегации молекул или ионов, до размеров, соответствующих коллоидам. Это можно реализовать следующими способами:
- испарение растворителя;
- замена растворителя;
- осуществление реакций, в результате которых образуются малорастворимые или нерастворимые вещества – реакции окисления – восстановления, разложения, гидролиза и др.
Способы очистки коллоидных систем
Коллоидные растворы могут содержать примеси, снижающие их стабильность, вследствие чего производят их очистку. Для этого используют такие методы, как диализ, электродиализ, фильтрация и ультрафильтрация.
- Диализ — удаление низкомолекулярных соединений с помощью мембран, способных задерживать коллоидные частицы и пропускать частицы меньшего размера. Прибор, используемый в этих целях, называют диализатором:
Диализатор
Коллоидный раствор наливают в сосуд, в нижней части которого находится мембрана и помещенный в емкость с водой. В растворитель проникают лишь ионы и молекулы низкомолекулярных примесей.
Процесс диализа протекает медленно и для его ускорения используют электрическое поле.
- Электродиализ – используется для увеличения скорости диализа посредством электрического поля. Прибор, используемый для проведения электродиализа, называют электродиализатором. Он состоит из трех частей: средняя часть отделена полупроницаемыми мембранами от соседних частей, соединенных с электродами. Коллоидный раствор помещается в среднюю часть электродиализатора. При создании электрического поля, находящиеся в коллоидном растворе катионы, начинают движение через мембрану к катоду, а анионы – к аноду.
Электродиализатор
- Фильтрация и Ультрафильтрация – это процесс отделения примесей от коллоидных частиц путем фильтрования коллоидного раствора через полупроницаемые мембраны под давлением.
Ультрафильтрация
Источник
Лекция по химии на тему «Коллоидные растворы»
Тема: Изучение коллоидных растворов.
Составила : Поливанова Т.В., преподаватель химии, первой квалификационной категории
Мотивация темы ………………… …..стр.4
Цели и задачи..………………………. .стр. 4
Информационный блок ……………. стр.5
Контролирующий блок ……………….стр. 18
Коллоидные системы широко распространены в природе. Белки, кровь, лимфа, углеводы, пектины находятся в коллоидном состоянии. Многие отрасли производства (пищевая, текстильная, резиновая, кожевенная, лакокрасочная, керамическая промышленности, технология искусственного волокна, пластмасс, смазочных материалов) связаны с коллоидными системами. Производство строительных материалов (цемент, бетон, вяжущие растворы) основано на знании свойств коллоидов. Угольная, торфяная, горнорудная и нефтяная промышленность имеют дело с дисперсными материалами (пылью, суспензиями, пенами). Особое значение коллоидная химия приобретает в процессах обогащения полезных ископаемых, дробления, флотации и мокрого обогащения руд. Фото- и кинематографические процессы также связаны с применением коллоидно-дисперсных систем.
К объектам коллоидной химии следует отнести все многообразие форм растительного и животного мира, в частности, типичными коллоидными образованиями являются мышечные и нервные клетки, клеточные мембраны, волокна, гены, вирусы, протоплазма, кровь. Поэтому ученый-коллоидник И.И.Жуков констатировал, что «человек по существу – ходячий коллоид». В свете этого, технологию лекарственных средств (мазей, эмульсий, суспензий, аэрозолей, порошков), действие различных лекарств на организм невозможно представить без знаний коллоидной химии.
Цель: приобретение системных знаний о коллоидно-дисперсных системах в зависимости от признаков классификации, о методах получения, очистки и об устойчивости дисперсных систем и умение применять эти знания к конкретным системам, встречающиеся в биологических объектах.
ознакомить студентов с понятием дисперсные системы, коллоидные растворы.
ознакомить студентов с методами получения коллоидных растворов.
разъяснить студентам способы очистки коллоидных растворов, строение мицеллы.
ознакомить студентов со свойствами коллоидных растворов.
продолжить и расширить познавательную деятельность студентов, а также их представления о способах получения коллоидных растворов.
продолжить развивать и расширить представления студентов о диализе, электродиализе, ультрафильтрации, о составных частях коллоидной частицы, и их практическом значении в повседневной жизни.
продолжить воспитывать внимательность, наблюдательность, эстетические чувства, навыки работы с техникой.
Дисперсные системы – гетерогенные системы, в которых одно вещество (дисперсная фаза) равномерно распределено в другом (дисперсионная среда) . Свойства вещества в раздробленном ( дисперсном ) состоянии значительно отличаются от свойств того же вещества, находящегося в виде твердого тела или некоторого объема жидкости.
Существует несколько различных классификаций дисперсных частиц: по размеру частиц, по агрегатному состоянию дисперсной фазы и дисперсионной среды, по характеру взаимодействия частиц дисперсной фазы с молекулами дисперсионной среды, по термодинамической и кинетической устойчивости.
В зависимости от размеров частиц дисперсной фазы а выделяют следующие дисперсные системы
Классификация дисперсных систем по агрегатным состояниям дисперсной фазы и дисперсионной среды приведена в таблице
Классификация дисперсных систем
Суспензия и золь
Коллоидное состояние характерно для многих веществ, если их частицы имеют размер от 10ˉ 7 до 10ˉ 5 см. Суммарная их поверхность огромна, и она обладает поверхностной энергией, за счет которой может адсорбировать частицы из раствора. Образующаяся коллоидная частица называется мицеллой . Она имеет сложное строение и состоит из ядра, адсорбированных ионов, противоионов.
Если растворитель взаимодействует с ядром частицы, то образуются лиофильные коллоиды, если не взаимодействует – то лиофобные коллоиды.
Обычно считают, что основателем коллоидной химии является английский ученый Томас Грэм(1805-1869), который в 50-60-е годы позапрошлого столетия ввел в обращение основные коллоидно-химические понятия. Однако не следует забывать, что у него имелись предшественники, и прежде всего – Яков Берцелиус, итальянский химик Франческо Сельми. В 30-е годы XIX века Берцелиус описал ряд осадков, проходящих при промывании через фильтр (кремниевая и ванадиевая кислоты, хлористое серебро, берлинская лазурь и др.). Эти проходящие через фильтр осадки Берцелиус назвал «растворами», но в то же время он указал на их близкое сродство с эмульсиями и суспензиями, со свойствами которых он был хорошо знаком. Франческо Сельми в 50-е годы XIX века продолжил работы в этом направлении, ища физико-химические различия между системами, образованными осадками, проходящими через фильтр (он назвал их «псевдорастворами») и обычными истинными растворами.
Английский ученый Майкл Фарадей (*) в 1857 г. синтезировал коллоидные растворы золота – взвесь Au в воде размерами частиц от 1 до 10 нм. и разработал методы их стабилизации.
Эти «псевдорастворы» рассеивают свет, растворенные в них вещества выпадают в осадок при добавлении небольших количеств солей, переход вещества в раствор и осаждение из него не сопровождаются изменением температуры и объема системы, что обычно наблюдается при растворении кристаллических веществ.
Томас Грэм развил эти представления о различии между «псевдорастворами» и истинными растворами и ввел понятие «коллоид». Грэм обнаружил, что вещества, способные к образованию студнеобразных аморфных осадков, такие как гидроокись алюминия, альбумин, желатина, диффундируют в воде с малой скоростью по сравнению с кристаллическими веществами ( NaCl , сахароза). В то же время кристаллические вещества легко проходят в растворе через пергаментные оболочки («диализируют»), а студнеобразные вещества не проходят через эти оболочки. Принимая клей за типичный представитель студнеобразных не диффундирующих и не диализирующих веществ, Грэм дал им общее название «коллоид», т.е. клееобразный (от греческого слова колла – клей). Кристаллические вещества и вещества, хороши диффундирующие и диализирующие он назвал «кристаллоидами».
Мицелла и её строение
Коллоидная частица представляет собой ядро из малорастворимого вещества коллоидной дисперсности, на поверхности которого адсорбируются ионы электролита раствора. Ионы электролита обеспечивают устойчивость золя, поэтому данный электролит называют ионным стабилизатором. Значит, коллоидная частица представляет собой комплекс, состоящий из ядра, вместе с адсорбционным слоем противоионов. Агрегат частицы или ядро представляет собой вещество кристаллического строения, состоящий из сотен или тысячи атомов, ионов или молекул, окружённый ионами. Ядро вместе с адсорбированными ионами называется гранулой. Так гранула имеет определённый заряд. Вокруг неё собираются противоположно заряженные ионы, придающие ей в целом электронейтральность. Вся система, состоящая из гранулы и окружающих её ионов называется мицеллой и является электронейтральной. Жидкая фаза, окружающая мицеллу, называется интермицелярной жидкостью. Это можно представить в виде следующей краткой схемы:
гранула, т.е. коллоидная частица = ядро + адсорбционный слой + противоионный слой + диффузный слой
мицелла = гранула + противоионы
золь = мицеллы + интермицеллярная жидкость.
Рассмотрим в качестве примера золь As 2 S 3 (рис 7). Для получения данного золя на мышьяковую кислоту нужно подействовать сероводородом. Протекающую реакцию можно написать следующим образом:
Избыток H 2 S в данной системе играет роль ионного стабилизатора. H 2 S частично диссоциирует на ионы:
Из этих ионов HS — ионы адсорбируются на поверхности ядра мицеллы As 2 S 3 , поэтому в этой системе:
Ядра мицелл имеют кристаллическое строение. Процесс образования коллоидных частиц был подробно исследован В.А. Каргиным и З.Я. Берестневой в 1953 году при помощи электронного микроскопа и создана новая теория. Согласно этой теории механизм образования коллоидной частицы происходит в два этапа: сначала образуются шарообразные частицы, находящиеся в аморфном состоянии, в дальнейшем же внутри аморфных частиц возникают мелкие кристаллы. Благодаря возникновению кристаллических структур внутри аморфных частиц создаётся напряжение и согласно минимуму внутренней энергии системы при соблюдении условий (∆Н |Т∆S|, ∆G
Методы получения коллоидных растворов
Коллоидные растворы могут быть получены:
1. Дисперсионными методами , основанными на дроблении, или диспергировании крупных частиц вещества до коллоидных размеров. Диспергирование можно проводить механическим измельчением, электрическим распылением и так далее.
К дисперсным методам относятся – процесс образования золей из гелей или рыхлых осадков при действии на них пептизаторов (в большинстве случаев электролитов), адсорбирующихся на поверхности коллоидных ядер и способствующих их взаимодействию с дисперсионной средой.
2. Конденсационными методами , основанными на агрегации молекул или ионов более крупные частицы. Агрегацию частиц можно осуществлять различными способами.
При конденсационном методе рост частиц прекращается задолго до образования термординамически устойчивой поверхности раздела. Поэтому коллоидные системы, независимо от способа получения, являются термодинамически неустойчивыми . Со временем, в результате стремления к термодинамически более выгодному состоянию, коллоидные системы прекращают существование вследствие коагуляции – процесса укрупнения частиц.
К физико-химической конденсации относится метод замены растворителя, который сводится к тому, что вещество, из которого предполагается получить золь, растворяют в соответствующем растворителе в присутствии стабилизатора (или без него) и затем раствор смешивают с избытком другой жидкости, в которой вещество нерастворимо. В результате образуется золь. Так получают золи серы, канифоли. За счет чего в данном случае возникает пресыщение.
Химический метод конденсации основан на реакциях, приводящих к возникновению твердого продукта.
а) Реакции восстановления.
Например, получение золей золота и серебра при взаимодействии солей этих металлов с восстановителями:
2KAuO2 + 3HCHO + K2CO3 → 2Au + 3HCOOK + KHCO3 + H2O.
б) Реакции окисления.
Например, получение золя серы:
2Н2S + O2 → 2S + 2H2O.
Строение мицеллы полученного золя можно представить следующей формулой:
в) Реакции обмена. Например, получение золя сульфата бария.
При использовании реакций обмена состав мицелл зависит от того, в каком порядке сливают растворы реагентов!
г) Реакции гидролиза.
Например, красно-бурый золь гидроксида железа (III) получается, если в кипящую воду добавить небольшое количество хлорида железа (III): FeCl3 + H2O → Fe(OH)3 + 3HCl.
Строение мицеллы золя Fe(OH)3 в зависимости от того, какой ион является стабилизатором, может быть выражено формулами:
Примером получения коллоидных систем кристаллизацией является кристаллизация из пересыщенного раствора сахарозы в производстве сахара. Процесс десублимации имеет место при образовании облаков, когда в условиях переохлажденного состояния из водяных паров образуются сразу кристаллики, а не капли воды.
Свойства коллоидных систем:
рассеивание света (опалесценция) (указывает на неоднородность, многофазность системы).
Опалесценция становится особенно заметной, если, как это делал Тиндаль ( через коллоидный раствор пропускать пучок сходящихся лучей, поставив между источником света и кюветой с раствором линзу. При этом растворы, прозрачные в проходящем свете, в боковом освещении проявляют все свойства мутных сред. В коллоидной жидкости, наблюдаемой сбоку, образуется яркий светящийся конус (конус Тиндаля).
малое осмотическое давление
коллоидные растворы способны к диализу, т.е. с помощью мембраны могут быть отделены от примесей
способны к коагуляции (разрушению) системы при: добавлении примесей, изменении Т, перемешивании и т.д.
иногда обнаруживают явление электрофореза, т.е. частицы в системе могут обладать зарядом.
Устойчивость коллоидных растворов
Различают кинетическую и агрегатную устойчивость коллоидных систем. Кинетическая устойчивость связана со способностью частиц дисперсной фазы к самопроизвольному тепловому движению в растворе, которое известно под названием броуновского движения. Такое хаотичное движение частиц препятствует их соединению. Обычно коллоидные растворы кинетически устойчивы, и разрушение их наступает только после того, как нарушается агрегатная устойчивость раствора.
Агрегатная устойчивость обусловлена тем, что на поверхности коллоидных частиц имеет место адсорбции ионов (молекул) из окружающей среды.
Вещество, адсорбирующееся на ядрах частиц и повышающее устойчивость коллоидных растворов, называется стабилизатором. При ионном стабилизаторе вокруг ядер мицелл возникают двойные электрические слои, затрудняющие их объединение. При молекулярном стабилизаторе на адсорбированных молекулах за счет межмолекулярных сил взаимодействия возникают сольватные оболочки (слои) из молекул дисперсионной среды, мешающие объединению частиц.
Разрушение коллоидных растворов
Процесс укрупнения коллоидных частиц, приводящий к уменьшению степени дисперсности диспергированного вещества, называется коагуляцией . Коагуляция, или слипание частиц, приводит к осаждению (седиментации) крупных агрегатов в виде осадка.
Снижение устойчивости коллоидных систем вызывают введением электролитов, которые изменяют структуру диффузного слоя ионов. Причем коагулирующим действием в электролите обладают только те ионы, (коагуляторы), которые несут заряд, по закону одноименной с зарядом противоиона коллоидной частицы. Коагулирующее действие иона коагулятора тем больше, чем больше его заряд.
Коагуляция – самопроизвольный процесс, возникающий из-за стремления системы перейти в состояние с более низкой поверхностной энергией и более низким значением изобарного потенциала. Процесс седиментации скоагулированного вещества также протекает самопроизвольно. Коагуляция может быть обусловлена различными причинами, наиболее эффективно действие электролитов. Минимальная концентрация электролита в растворе, вызывающая коагуляцию, называется порогом коагуляции. Коагуляция также возникает при смещении двух золей с различными знаками зарядов частиц. Это явление называется взаимной коагуляцией.
Способ очистки коллоидных растворов
При получении коллоидных систем в их составе кроме дисперсной фазы в большом количестве присутствуют кислоты, основания и соли. Для обеспечения устойчивости коллоидного раствора должно содержатся некоторое количество электролита в растворе, однако лишнее количество электролита следует удалить. Удаление лишнего количества электролита из коллоидного раствора называется очисткой коллоидного раствора от электролита. При очистке коллоидных растворов используются методы диализа, ультрафильтрации, электродиализа.
Особенность диализа состоит в том, что коллоидный раствор и присутствующие в нём электролиты отделяются от чистого растворителя (воды) при помощи полупроницаемой мембраны (рис. 4). Молекулы и ионы, способные проходить через такую мембрану будут переходить в раствор, пока не установится равновесие между концентрациями молекул и ионов по обе стороны мембраны. Периодически меняя растворитель можно до определённой степени очистить золь от примесей. Для диализа обычно используют плёнки из коллодия, также перегородки, изготовленные из ацетилцеллюлозы, целлофана и других материалов. Наряду с этим используются и природные плёнки, например, стенки мочевого пузыря.
В сосуд, затянутый мембраной (В) наливают коллоидный раствор (А), после чего он погружается в сосуд, наполненный чистой водой (С). Вода в наружном сосуде перио-дически меняется, т.е. используется проточный диализатор с непрерывной сменой воды. Стенки мочевого пузыря или других мембран имеют очень мелкие отверстия (диаметр их 20-30 мкм). Сквозь эти отверстия могут проходить молекулы или ионы, но не коллоидные частицы. Электролиты, содержащиеся в золе диффундируя в воду, вымываются из коллоидного раствора через мембрану. Сменяя воду можно очистить до определённой степени коллоидный раствор.
При электродиализе диализ ускоряется действием электрического тока. Между двумя мембранами М 1 и М 2 помещают коллоидный раствор, который нужно очистить от электролитов (рис. 5). В боковых частях сосуда, в которых непрерывно пропускается чистая вода (растворитель), находятся электроды. При пропускании электрического тока, положительно заряженные ионы направляются к катоду, а отрицательно заряженные к аноду. Ионы электролита, пройдя через мембрану, собираются в той части сосуда, где установлены электроды. Очищенный золь остаётся в средней части сосуда между двумя мембранами. Этот метод используется в основном при очистке органических коллоидов. В промышленности он широко применяется для получения в чистом виде желатина, клея.
Коллоидные растворы можно очистить путём фильтрации их через полупроницаемые мембраны. Ультрафильтр состоит из воронки Бюхнера (1), мембраны (2), колбы Бюнзена (3) и насоса (4) (рис .6). Для ускорения ультрафильтрацию проводят под давлением. Используя определённую мембрану можно очистить фильтрацией коллоидный раствор от электролита, а также золи друг от друга. Для этого диаметры отверстия мембраны должны быть крупнее частиц одного золя, и меньше частиц другого золя.
Использование в медицине
В медицине коллоидные растворы применяются повсеместно. Вот несколько примеров их использования. Коллоидное серебро, представляющее собой мелкие частицы металла, диспергированные в воде, применяется при лечении ожогов, язвенных болезней желудка и двенадцатиперстной кишки, для промывания слизистой носа в целях предотвращения распространения вирусных инфекций.
Фармацевтическая промышленность предлагает большой выбор коллоидных растворов для различных целей. Среди них встречают универсальные средства, которые можно применять как ранозаживляющие при ожогах, геморрое; противовоспалительные – при насморке, ангине, гайморите; анальгетики – для снятия зубной боли и не только. К таковым относится коллоидный раствор «Миллениум». В состав геля входит алоэ, белок пшеницы, женьшень, витамин Е и прочие полезные добавки. Многие фармацевтические средства для наружного применения на самом деле являют собой коллоидный раствор. Для суставов, например, используется «Артро Комплекс», содержащий такой полезный компонент, как акулий хрящ.
Применение в быту и промышленности
Коллоидные растворы составляют основу моющих и чистящих ПАВов. Загрязнения проникают внутрь мицеллы и таким образом удаляются с поверхности.
Другой важный аспект применения мицеллообразующих ПАВов – производство полимеров, в частности латексов, поливинилового спирта, клеев растительного происхождения. Различные пластмассы, кожзаменители получены на основе эмульсии. ПАВы применяются также при очистке сточных вод и питьевой воды.
Преимущества косметики на основе коллоидных растворов заключаются в проникновении действующих веществ через кожные покровы человека и структуру волос. Такие средства эффективно используются против старения. К ним относится, в частности, гель «Миллениум Нео». Коллоидный раствор помогает содержащимся в нем компонентам достичь глубоких слоев кожи, минуя эпидермис.
Пустовалова Л.М., Никанорова И.Е. Общая химия. – Ростов н/Д: Феникс, 2006. – 478 с.
Стромберг А.Г., Семченко Д.П. Физическая химия. – М.: Высшая школа, 2003. – 527 с.
Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. – М.: Высшая школа, 1990. – 487 с.
Болдырев А.И. Демонстрационные опыты по физической и коллоидной химии. – М.: Высшая школа, 1976. – 256 с.
Источник




















