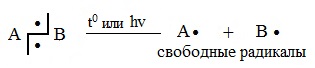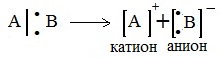- Назовите основные способы разрыва ковалентной связи
- Назовите основные способы разрыва ковалентной связи
- Таблица Менделеева
- Универсальная таблица растворимости
- Коллекция таблиц к урокам по химии
- Электронная природа химических связей в органических соединениях. Способы разрыва ковалентной связи
- Способы образования и разрыва ковалентной связи. Типы реакционных частиц в органической химии
Назовите основные способы разрыва ковалентной связи
По способу разрыва ковалентных связей органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
1. Свободнорадикальный (гомолитический) разрыв связей
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
Такому разрыву подвергаются неполярные и малополярные ковалентные связи под действием света или высокой температуры. Образующиеся частицы содержат неспаренные электроны и называются свободными радикалами. Эти частицы обладают большой энергией и очень активны.
2. Ионный (гетеролитический) разрыв связей
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион — карбанионом.
Устойчивы более разветвлённые катионы.
Такому разрыву подвергаются полярные ковалентные связи.
Образующиеся органические ионные частицы отличаются от неорганических тем, что они возникают в момент реакции.
Источник
Назовите основные способы разрыва ковалентной связи
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Электронная природа химических связей в органических соединениях. Способы разрыва ковалентной связи
Данный урок поможет вам получить представление о теме «Ковалентная связь в органических соединениях». Вы вспомните природу химических связей. Узнаете о том, за счет чего образуется ковалентная связь, что является основой этой связи. На этом уроке также рассматривается принцип построения формул Льюиса, рассказывается о характеристиках ковалентной связи (полярности, длине и прочности), объясняется теория А. Бутлерова
I. Электронная природа химических связей в органических соединениях
1. Все органические вещества содержат углерод. В молекулах органических веществ углерод переходит в возбуждённое состояние:
2. Органическим соединениям свойственны ковалентные связи. Ковалентная связь в молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной направленностью.
а) Из курса химии 8 класса вы знаете, что ковалентная связь образуется за счёт перекрывания электронных облаков, при этом выделяется энергия, чем больше перекрывание, тем больше выделяется энергии и тем прочнее связь.
Типы перекрываний электронных облаков в порядке возрастания их прочности и энергии выделяемой при образовании:
σ(s – s)
б) Длина связи определяется расстоянием между центрами ядер связывающихся атомов и измеряется в нанометрах (1 нм = 10 -9 м). С повышением кратности связи (одинарная, двойная, тройная) длина становится меньше, а энергия выше:
в) Под насыщаемостью связи понимают способность образовывать строго определённое количество ковалентных связей.
г) Направленность ковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов.
Вы уже знаете, что атом углерода содержит на внешнем уровне четыре валентных электрона:
1 электрон на s – орбитали сферической формы
3 электрона на трёх p – орбиталях, орбитали имеют форму гантели и расположены под углом 90˚.
Таким образом можно предположить, что в молекуле метана CH4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на s – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`.
В 1931 г. американский учёный Л. Полинг доказал, что в молекуле метана в момент образования молекулы электронные облака смешиваются и образуют гибридные электронные облака, происходит процесс гибридизации.
II. Гибридизация атомных орбиталей
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном их трёх состояний гибридизации: sp 3 , sp 2 , sp.
1) sp 3 – гибридизация
Происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
Рис. Строение молекулы метана СН4 (тетраэдрическое)
2) sp 2 – гибридизация:
Происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные σ – связи.
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ – связей и участвует в образовании П — связи.
Рис. Строение молекулы этилена С2Н4 (плоское тригональное)
3) sp – гибридизация
Происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные σ – связи.
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две П — связи.
Рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве, а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей.
III. Степень окисления атома углерода
Для атома углерода в органических соединениях характерны степени окисления от -4 до +4.
Укажите степени окисления всех элементов в CH3CH2OH
Решение. Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы (СН3 –) . Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность углерода превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН2ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3C -1 H +1 2O -2 H +1 .
IV. Простая и кратная ковалентные связи
Способность атома углерода иметь разные степени окисления и лёгкость гибридизации позволяет атому углерода образовывать одинарные, и кратные (двойные и тройные связи) не только с другими атомами углерода, но и с атомами других элементов-органогенов:
СН3 – СН3 (1 σ – сигма связь С-С)
CH2=CH2 (1 σ – сигма связь С-С и 1 П – пи связь С-С)
CH ≡ CH (1 σ – сигма связь С-С и 2 П – пи связи С-С)
V. Способы разрыва связей в молекулах органических веществ и механизмы органических реакций
Разрыв ковалентной связи может происходить двумя способами.
1. Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Радикал – свободный атом или частица с неспаренными электронами, неустойчив и способный быстро вступать в химическую реакцию.
Гомолитический разрыв сопровождает процессы, осуществляемые при высоких температурах; на свету; при радиоактивном облучении в отсутствие растворителя (в газовой фазе) или неполярных растворителях. Гомолитическому разрыву подвергаются малополярные или неполярные связи C—C, C—H, Cl—Cl и др.
2. Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
А + — электрофильная частица,
:В — — нуклеофильная частица
В результате образуются разноименно заряженные ионы — катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион — карбанионом.
Устойчивы более разветвлённые катионы!
Ионный тип разрыва связи характерен для П- связей и полярных σ – связей; при наличии полярного растворителя или катализатора.
Источник
Способы образования и разрыва ковалентной связи. Типы реакционных частиц в органической химии
Тема: «Способы образования и разрыва ковалентной связи. Типы реакционноспособных частиц в органической химии»
Тип занятия: лекция
Цель:1. Рассмотреть способы образования и разрыва ковалентной связи. Познакомить учащихся с типами реакционноспособных частиц в органической химии.
2. Продолжить развитие понятий о типах химических реакций.
3. Воспитывать творческий интерес к предмету.
Оборудование и реактивы
Опрос опорных знаний
Изучение нового материала:
Обменный механизм образования ковалентной связи. Гомолитический разрыв связи;
Донорно – акцепторный механизм образования ковалентной связи. Гетеролитический разрыв связи;
Дайте определение реакций отщепления.
Какие реакции называют реакциями дегидрирования, дегидротации?
Какая разница между реакциями дегалогенирования и дегидрогалагенирования?
Сформулируйте определение реакций полимеризации.
Какой процесс называют окислением (восстановлением) в органической химии? Что при этом происходит?
Как соотносятся между собой реакции гидрирования и восстановления?
Работа по карточкам.
Ответы в-1 задание 1 а) полимеризация, б)замещение,в) отщепление, г)окисление. Зад 2. В. Зад 3 – отщепление, присоединение, замещение
В-2 зад 1 а) отщепление,б) замещение, в) изомеризации, г) присоединение. Зад 2 – г. зад 3 отщепление, присоединение,окисление, окисление
2. Изучение нового материала
1 . Способы разрыва ковалентной связи в органических соединениях
Для органических соединений наиболее характерна ковалентная связь и молекулярное строение. Существует два способа образования ковалентной связи: обменный и донорно-акцепторный. Первый предполагает обобществление по одному неспаренному электрону каждого атома. По второму способу один атом (донор) представляет для образования связи неподеленную пару электронов, а второй (акцептор) – свободную (вакантную) орбиталь. В обоих случаях между атомами возникает ковалентная связь за счет образования общей электронной пары.
Сущность любой химической реакции заключается в образовании новых молекул, из тех же самых атомов, из которых были образованны исходные вещества. Следовательно, одни химические связи должны разорваться, другие – образоваться. Формально разрыв ковалентной химической связи – это процесс, обратный ее образованию:
На доске: А:В↔А∙+В∙ и А:В↔А + □+В — :
В результате разрыва (схема) химической связи могут образовываться как частицы с неспаренным электроном (атомы или радикалы), так и заряженные частицы – ионы(катионы и анионы). В первом случае первая пара электронов «поровну» делиться между связанными атомами. Такой разрыв называется ГОМОЛИТИЧЕСКИМ. Во втором случае оба электрона ковалентной связи остаются у одного атома, атома более электроотрицательного элемента. Это гетеролитический разрыв связи.
2 . Типы реакционноспособных частиц в органической химии
Как правило осколки молекулы(радикалы и ионы), образующиеся после разрыва связи, живут очень короткое время. Они стабилизируются, образуя связи с другими атомами и группами, т.е. проявляют ВЫСОКУЮ РЕАКЦИОННУЮ СПОСОБНОСТЬ. Однако эти реакционноспособные частицы в прямом смысле разборчивы в своих связях. Для стабилизации радикала ему нужна частица с неспаренным электроном. Анион или атом с неподеленной парой электронов ищет для образования связи атом с вакантной орбиталью. Катиону необходим «партнер» с избытком электронной плотности. Поэтому все реагенты в органической химии делятся на три группы: R∙ радикальный реагент (радикал); А + электрофильный реагент (электрофил те же катионы или молекулы, имеющие пустую орбиталь, атакующие в молекуле субстрата места с повышенной электронной плотностью), электро + фил= любящий электрон, отрицательный заряд; В — : — нуклеофильный реагент (нуклеофил он же анион или молекулы, имеющие неподеленную электронную пару и взаимодействующие с участками молекулы субстрата на которых сосредоточен частичный положительный заряд ), нуклеос+фил=любящий протон, положительный заряд. Пример СН3→ОН+:Br — →
3 . Взаимное влияние атомов в молекулах органических соединений
Назовите основные положения теории строения органических соединений А.М. Бутлерова( Атомы в молекулах соединяются в определенной последовательности согласно их валентности.
Химические свойства веществ определяются не только их составом, но и строением (структурой). Строение вещества можно отобразить структурной формулой, которая для него будет единственной. Если у веществ с одинаковым составом разное строение возникает явление изомерии.
По химическим свойствам соединения можно предположить его строение, и наоборот – по строению — химические свойства.) .
На этом занятии мы детально рассмотрим 3-е положение – о взаимном влиянии атомов в молекуле. В одной из научных статей в 1863г А.М Бутлеров писал: «Атомы водорода, соединенные с углеродом, ведут себя относительно реагентов…иначе, чем соединенные с кислородом». Пример : молекулярная формула метилового спирта СН4О. Три атома водорода в молекуле этого вещества связанны с углеродом, а один – с атомом кислорода, что наглядно демонстрирует структурная формула:Н-С(Н2)-О-Н
Очевидно, что три атома водорода метильной группы в химических реакциях будут вести себя иначе, чем водород гидроксильной группы. Вопрос : какой тип связи между атомами в молекуле метанола?(ковалентный полярный) какой из трех элементов наиболее электроотрицателен, а какой – наименее?(О2 И Н2). Какая связь в молекуле является самой полярной? (связь О-Н, т.к разность электроотрицательностей этих элементов максимальна. Смещение электронной палотности вдоль линии сигма связей в молекуле называют индуктивным эффектом и часто изображают стрелками: схема на доскеН → С → О ← Н.
Рассмотрим молекулу метилового спирта как сочетание двух групп: метильной и гидроксильной. Обе группы оказывают друг на друга определенное влияние за счет полярности связи между ними. Гидроксильная группа притягивает к секбе электронную плотность ковалентной связи. Такое влияние называют отрицательным индуктивным эффектом и обозначают (- I ). Метильная группа подает электронную пару более электроотрицательному кислороду, т.е обладает положительным индуктивным эффектом (+ I ). В результате на атоме кислорода образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный.
В метане по сравнению с метанолом атом углерода не имеет заряда ᵟ+, т.к атом водорода не обладает отрицательным индуктивным эффектом. Величина заряда ᵟ- на атоме кислорода в воде меньше, чем в метиловом спирте, т.к. отсутствует + I эффект метильной группы.
Индуктивный эффект быстро затухает в цепочке атомов. Вместе с тем существуют электронные эффекты, распространяющиеся на большое число атомов в цепочке. Такие эффекты называются мезомерными, они связанны со смещением электронной плотности кратных связей или неподеленных пар электронов. Объясняю понятие положительного мезомерного эффекта на примере хлорэтена. Атом хлора более электроотрицателен, чем атом углерода, он обладает отрицательным индуктивным эффектом. Вместе с тем у хлора имеется неподеленная пара электронов на р-орбитали. В непосредственной близости с атомом хлора расположена двойная связь.в результате отталкивания от р-электронов галогена электронная плотность двойной связи смещается к дальнему углеродному атому. Такой эффект атома хлора называется положительным мезомерным. Схема:
В результате положительного мезомерного эффекта хлора двойная связь поляризуется, что определяет ее реакционную способность, например в реакциях присоединения. Существуют также функциональные группы обладающие отрицательным мезомерным эффектом но с ним мы познакомимся немного позже.
4. Понятие о механизме химической реакции
Рассмотрение механизмов реакций в органической химии начинаю с повторения вопроса о реакционных частицах и типах реакций. Учащиеся вспоминают понятия реакций замещения, присоединения, элиминирования, классифицируют реакционные частицы на радикальные, нуклеофильные и электрофильные.юбой химической реакции происходит разрыв одних химических связей и образование других. Связь в исходном соединении (субстрате) может разрываться под действием:
В зависимости от того, какие реакционные частицы участвуют в процессе и что происходит с субстратом, различают несколько основных механизмов реакций в органической химии, они перечислены в учебнике.
Механизм – это последовательность отдельных стадий с указанием промежуточных частиц, образующихся на каждой из этих стадий. При изучении отдельных классов веществ некоторые из названных механизмов будут рассмотрены подробно. На данном этапе поясняю, что реакции радикального замещения или присоединения происходят под действием свободных радикалов, нуклеофильные реакции – с участием нуклеофильных реагентов, а электрофильные предполагают начальную атаку субстрата электрофилом.
Источник