- § 21. Способы изображения органических соединений
- 1. Какую информацию можно получить из молекулярной формулы органического соединения?
- 2. Приведены названия и формулы различных веществ: а) оксид углерода(IV) $\mathrm;$ б) дихлорметан $\mathrm;$ в) метан $\mathrm;$ г) карбонат натрия $\mathrm.$ Какие из них относятся к органическим веществам? К органическим веществам относят: б) дихлорметан $\mathrm;$ в) метан $\mathrm;$ к неорганическим — а) оксид углерода(IV) $\mathrm;$ г) карбонат натрия $\mathrm.$ 3. Назовите различия между шаростержневыми и масштабными моделями органических соединений. В шаростержневых моделях атомы изображают в виде трубок из пластмассы и отражают взаимное расположение атомов в пространстве. В масштабных моделях атомы изображают в виде сферы с размерами, пропорциональными их радиусу. 4. Раскройте сущность понятия «химическое строение вещества». Химическое строение — последовательность соединения атомов в молекулах органических соединений; в молекуле этана, например: атомы углерода соединены друг с другом, а атомы водорода связаны с атомами углерода. 5. Химическую связь между какими атомами указывает черточка в сокращенной структурной формуле этана $\mathrm<СН_3 - СН_3>?$ В сокращённой структурной формуле этана чёрточка показывает связь между атомами углерода. 6. Укажите общее число атомов в молекуле метана: а) 2; б) 3; в) 4; г) 5. Общее число атомов в молекуле метана $\mathrm$ равно 5 (г). 7. Попытайтесь написать структурную формулу органического соединения c молекулярной формулой $\mathrm,$ являющегося производным углеводорода этана. Структурная формула соединения $\mathrm$ 8. Изобразите соединение, показанное на рисунке 88, в виде структурной формулы. Структурная формула отображает порядок (последовательность) соединения атомов в молекулах. 9. На основании пространственного изображения молекулы этана на рисунке 86 попытайтесь изобразить пространственное строение молекулы с молекулярной формулой $\mathrm.$ Пространственное строение молекулы $\mathrm:$ Источник Способы отображения строения молекул. Формулы. Модели Теория строения органических соединений М.И. Бутлерова Основные положения теории химического строения В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений. Согласно этой теории: атомы в органических молекулах соединены друг с другом в соответствии с валентностью, при этом углерод всегда четырехвалентен; порядок соединения атомов в молекуле называется химическим строением; свойства веществ определяются не только их составом, но и химическим строением; атомы в молекулах оказывают взаимное влияние друг на друга; исходя из строения молекулы можно предсказать свойства вещества, и, наоборот, на основании химических свойств можно предсказать строение вещества. Углеводородные цепи могут быть как открытыми (алициклическими), так и замкнутыми (циклическими), как прямыми, так и разветвленными. Определение Гомологи — органические соединения, принадлежащие к одному классу веществ, обладающие сходным строением и свойствами, но отличающиеся друг от друга по составу на одну или несколько групп СНСН2 и отвечающие одной общей формуле. Способы отображения строения молекул. Формулы. Модели Структуру вещества, то есть порядок соединения атомов в молекуле, отображает структурная формула, в которой связи между атомами (или группами атомов) изображаются в виде черточек: одна черточка означает одну связь или одну общую электронную пару. Поскольку углерод в органических соединениях всегда четырехвалентен, то каждый атом углерода может образовывать четыре связи (четыре черточки). По количеству соседних углеродных атомов, атомы углерода в молекуле подразделяются на первичные(один «сосед»), вторичные (два «соседа»), третичные (три «соседа») и четвертичные (четыре «соседа»). Так, концевые атомы в молекуле углеводородов всегда первичные, в линейных молекулах промежуточные атомы — вторичные, а в разветвленных могут появляться третичные и (или) четвертичные атомы углерода. Для отображения органических молекул используют молекулярные или брутто-формулы, которые представляют собой сокращенную форму записи количественного и качественного состава. Например, запись СНС2Н6 означает, что молекула вещества состоит из 2 атомов углерода и 6 атомов водорода. Для каждого класса органических соединений можно вывести общую формулу,отвечающую количественному составу всех гомологов. Эту формулу называют общей формулой гомологического ряда.Вещества, принадлежащие к одному классу, отвечают одной общей формуле. Сравним структурные формулы простейших углеводородов: метана, этана и пропана. Молекулярная формула метана СН4, этана С2Н6, пропана С3Н8. Видно, что формула этана отличается от формулы метана на одну группу СН2. Аналогично, состав молекул пропана и этана также отличается на одну группу СН2. Следовательно, все эти вещества являются гомологами и относятся к гомологическому ряду метана. Прибавив к формуле пропана указанную гомологическую разницу СН2, получим формулу следующего представителя этого гомологического ряда — С4Н10 (бутан): Для состава С4Н10 можно изобразить еще одну структурную формулу: Следовательно, веществ состава С4Н10 должно быть два, каждому из этих веществ соответствует своя структурная формула. Если первое вещество называется бутаном или н-бутаном, то второе — изобутаном. Бутан и изобутан — изомеры, так как у них одинаковый количественный состав, но разный порядок соединения атомов. Подробно с явлением изомерии и изомерами можно познакомиться в теме «Виды изомерии». Для пространственного отображения структуры молекул органических веществ используют стереохимические формулы. Стереохимическая формула показывает пространственное расположение атомов в молекулах органических веществ. Например, пространственное строение этана можно отобразить стереохимической формулой или с помощью проекций Ньюмена, отображающих конформации этана, то есть расположение (поворот) метильных радикалов относительно одинарной С–С-связи: Более подробно проекции Ньюмена будут рассмотрены в теме «Виды изомерии». Для наглядности отображения пространственного строения органических молекул используют также разные модели. Наиболее распространенными являются шаростержневые модели, в которых атомы имеют форму шаров, а связи представлены в виде палочек. Одинарная связь — одна палочка, двойная связь — две палочки. Более достоверно истинную структуру молекул отображаютмасштабные (полусферические) модели: Источник Способы изображения органических молекул. Органическая химия. 2.1.Тема: «Теория строения органических соединений» 2.1.1. Основные положения теории строения органических соединений и классификация органических соединений. 1. Природные и синтетические органические вещества. Немного из истории органической химии. Общие свойства органических веществ (состав, тип химической связи, кристаллическое строение, растворимость, отношение к нагреванию в присутствии кислорода и без него). 2. Теория строения органических соединений А.М.Бутлерова. Развитие теории и ее значение. 3. Классификация органических веществ. Свое название органические вещества получили потому, что первые из изученных веществ этой группы входили в состав живых организмов. Большинство известных сейчас органических веществ не встречаются в живых организмах, они получены (синтезированы) в лаборатории. Поэтому различают природные (натуральные) органические вещества (хотя большинство из них может быть сейчас получено в лаборатории), а органические вещества, не существующие в природе – синтетические органические веществами. Т.е. название «органические вещества» историческое и особого смысла не имеет. Все органические соединения являются соединениями углерода. К органическим веществам относятся соединения углерода, кроме изучаемых в курсе неорганической химии простых веществ, образованных Карбоном, его оксидов, угольной кислоты и ее солей. Другими словами: органическая химия – это химия соединений углерода. Краткая история развития орг.химии: Берцелиус, 1827, первый учебник органической химии. Виталисты. Учение о «жизненной силе». Первые органические синтезы. Велер, 1824, синтез щавелевой кислоты и мочевины. Кольбе,1845, уксусная кислота. Бертло,1845, жир. Бутлеров,1861, сахаристое вещество. Но как наука органическая химия началась с создания теории строения органических соединений. Существенный вклад в нее внесли немецкий ученый Ф.А.Кекуле и шотландец А.С.Купер. Но решающий вклад несомненно принадлежит русскому химику А.М.Бутлерову. Среди всех элементов углерод выделяется своей способностью образовывать устойчивые соединения, в которых его атомы связаны друг с другом в длинные цепи различной конфигурации (линейные, разветвленные, замкнутые). Причина этой способности: примерно одинаковая энергия связи С-С и С-О (для других элементов энергия второй – намного больше). Кроме того, атом углерода может находиться в одном из трех видов гибридизации, образуя соответственно одинарные, двойные или тройные связи, причем не только между собой, но и с атомами кислорода или азота. Правда, гораздо чаще (практически всегда) атомы углерода соединены с атомами водорода. Если в состав органического соединения входит только углерод и водород, то соединения называются углеводородами. Все остальные соединения можно рассматривать как производные углеводородов, в которых некоторые атомы водорода замещены на другие атомы или группы атомов. Поэтому более точное определение: Органические соединения – это углеводороды и их производные. Органических соединений очень много — более 10 млн. (неорганических около 500 тыс.). Состав, строение и свойства всех органических веществ имеют много общего. Органические вещества имеют ограниченный качественный состав. Обязательно С и Н, часто О или N, реже галогены, фосфор, сера. Другие элементы входят в состав очень редко. А вот число атомов в молекуле может достигать млн, и молекулярная масса может быть очень большая. Строение органических соединений. Т.к. состав – неметаллы. => Химическая связь: ковалентная. Неполярная и полярная. Ионная очень редко. => Кристаллическая решетка чаще всего молекулярная. Общие физические свойства: невысокая температура кипения и плавления. Среди органических веществ есть газы, жидкости и легкоплавкие твердые вещества. Часто летучи, могут иметь запах. Обычно бесцветные. Большинство органических веществ нерастворимо в воде. Общие химические свойства: 1) при нагревании без доступа воздуха все органические вещества «обугливаются», т.е. при этом образуется уголь (точнее сажа) и некоторые другие неорганические вещества. Происходит разрыв ковалентных связей, сначала полярных, потом и неполярных. 2) При нагревании в присутствии кислорода все органические вещества легко окисляются, и при этом конечными продуктами окисления являются углекислый газ и вода. Особенности протекания органических реакций. В органических реакциях участвуют молекулы, в процессе реакции должны разорваться одни ковалентные связи и образуются другие. Поэтому химические реакции с участием органических соединений идут обычно очень медленно, для их проведения необходимо применять повышенную температуру, давление и катализаторы.В неорганических реакциях обычно участвуют ионы, реакции протекают очень быстро, иногда мгновенно, при нормальной температуре. Органические реакции редко приводят к высокому выходу продукции (обычно менее 50%). Они часто являются обратимыми, кроме того, может протекать не одна, а несколько реакций, конкурирующих между собой, а значит продуктами реакции будет смесь различных соединений. Поэтому и форма записи органических реакций тоже несколько другая. Т.е. используют не химические уравнения, а схемы химических реакций, в которых нет коэффициентов, но зато подробно указаны условия реакции. Принято также под уравнением записывать названия орг. веществ и тип реакции. Но в целом органические вещества и реакции подчиняются общим законам химии, а органические вещества превращаются в неорганические или могут образовываться из неорганических. Что еще раз подчеркивает единство окружающего нас мира. Основные принципы теории химического строения, изложенные молодым А.М.Бутлеровым на международном съезде естествоиспытателей в 1861 г. 1). Атомы в молекулах соединены между собой в определенном порядке, в соответствии с их валентностью. Последовательность соединения атомов называют химическим строением. Валентность — это способность атомов образовывать определенное количество связей (ковалентных). Валентность зависит от числа неспаренных электронов в атоме элемента, потому что ковалентные связи образуются за счет общих электронных пар при спаривании электронов. Углерод во всех органических веществах четырехвалентен. Водород — 1, Кислород -П, азот – Ш, сера – П, хлор – 1. Способы изображения органических молекул. Молекулярная формула – условное изображение состава вещества. Н2СО3 — угольная кислота, С12Н22О11 – сахароза. Такие формулы удобны для расчетов. Но они не дают информацию о строении и свойствах вещества. Поэтому даже молекулярные формулы в органике пишут особым образом: СН3ОН. Но гораздо чаще пользуются структурными формулами. Структурная формула отражает порядок соединения атомов в молекуле (т.е. химическое строение).И в основе любой органической молекулы лежит углеродный скелет – это цепочка связанных между собой ковалентными связями атомы углерода. Электронные формулы молекул – связи между атомами показаны парами электронов. Полная структурная формула показаны все связи черточками. Химическая связь, образованная одной парой электронов, называется одинарной и в структурной формуле изображается одной черточкой. Двойная связь ( =) образована двумя парами электронов. Тройная (≡ ) образована тремя парами электронов. И общее количество этих связей должно соответствовать валентности элемента. В сжатой структурной формуле опускаются черточки одинарных связей, а атомы, связанные с тем или иным атомом углерода, пишутся сразу после него (иногда в скобках). Еще более сокращенными являются скелетные формулы. Но они используются реже. Например: Структурные формулы отражают только порядок соединения атомов. Но молекулы органических соединений редко имеют плоское строение. Объемный образ молекулы важен для понимания многих химических реакций. Образ молекулы описывают с помощью таких понятий как длина связи и валентный угол. Кроме того, возможно свободное вращение вокруг одинарных связей. Наглядное представление дают молекулярные модели. Источник
- 3. Назовите различия между шаростержневыми и масштабными моделями органических соединений.
- 4. Раскройте сущность понятия «химическое строение вещества».
- 5. Химическую связь между какими атомами указывает черточка в сокращенной структурной формуле этана $\mathrm<СН_3 - СН_3>?$
- 6. Укажите общее число атомов в молекуле метана: а) 2; б) 3; в) 4; г) 5.
- 7. Попытайтесь написать структурную формулу органического соединения c молекулярной формулой $\mathrm,$ являющегося производным углеводорода этана.
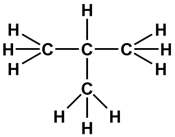
- 8. Изобразите соединение, показанное на рисунке 88, в виде структурной формулы.
- 9. На основании пространственного изображения молекулы этана на рисунке 86 попытайтесь изобразить пространственное строение молекулы с молекулярной формулой $\mathrm.$
- Способы отображения строения молекул. Формулы. Модели
- Способы изображения органических молекул.
§ 21. Способы изображения органических соединений
1. Какую информацию можно получить из молекулярной формулы органического соединения?
Молекулярная формула органического соединения показывает, какие атомы и каком количестве присутствуют в данном органическом соединении.
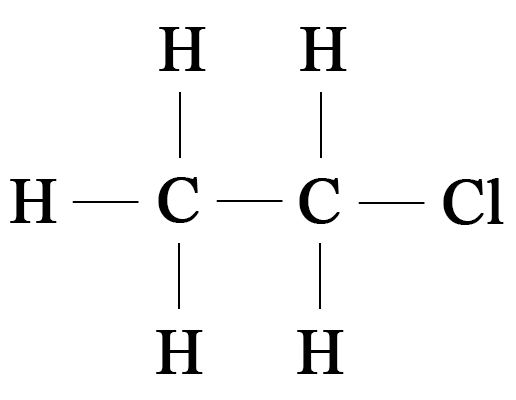
2. Приведены названия и формулы различных веществ: а) оксид углерода(IV) $\mathrm;$ б) дихлорметан $\mathrm;$ в) метан $\mathrm;$ г) карбонат натрия $\mathrm.$ Какие из них относятся к органическим веществам?
К органическим веществам относят: б) дихлорметан $\mathrm
3. Назовите различия между шаростержневыми и масштабными моделями органических соединений.
В шаростержневых моделях атомы изображают в виде трубок из пластмассы и отражают взаимное расположение атомов в пространстве. В масштабных моделях атомы изображают в виде сферы с размерами, пропорциональными их радиусу.
4. Раскройте сущность понятия «химическое строение вещества».
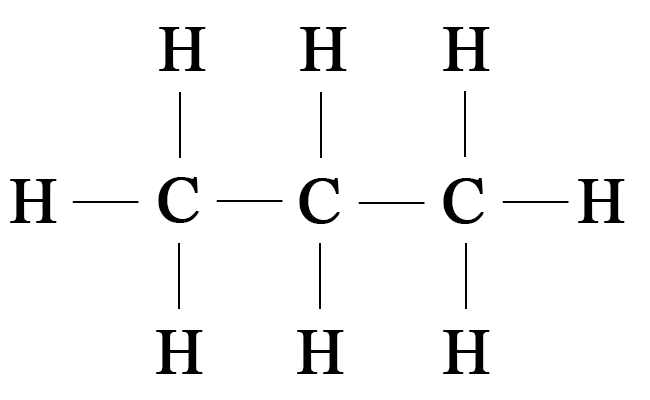
Химическое строение — последовательность соединения атомов в молекулах органических соединений; в молекуле этана, например:
атомы углерода соединены друг с другом, а атомы водорода связаны с атомами углерода.
5. Химическую связь между какими атомами указывает черточка в сокращенной структурной формуле этана $\mathrm<СН_3 - СН_3>?$
В сокращённой структурной формуле этана чёрточка показывает связь между атомами углерода.
6. Укажите общее число атомов в молекуле метана: а) 2; б) 3; в) 4; г) 5.
Общее число атомов в молекуле метана $\mathrm
7. Попытайтесь написать структурную формулу органического соединения c молекулярной формулой $\mathrm,$ являющегося производным углеводорода этана.
Структурная формула соединения $\mathrm
8. Изобразите соединение, показанное на рисунке 88, в виде структурной формулы.
Структурная формула отображает порядок (последовательность) соединения атомов в молекулах.
9. На основании пространственного изображения молекулы этана на рисунке 86 попытайтесь изобразить пространственное строение молекулы с молекулярной формулой $\mathrm.$
Пространственное строение молекулы $\mathrm
Источник
Способы отображения строения молекул. Формулы. Модели



Теория строения органических соединений М.И. Бутлерова
Основные положения теории химического строения
В 1860-х гг. А. М. Бутлеров сформулировал основные положения, ставшие впоследствии фундаментом теории строения органических соединений. Согласно этой теории:
- атомы в органических молекулах соединены друг с другом в соответствии с валентностью, при этом углерод всегда четырехвалентен;
- порядок соединения атомов в молекуле называется химическим строением;
- свойства веществ определяются не только их составом, но и химическим строением;
- атомы в молекулах оказывают взаимное влияние друг на друга;
- исходя из строения молекулы можно предсказать свойства вещества, и, наоборот, на основании химических свойств можно предсказать строение вещества.
Углеводородные цепи могут быть как открытыми (алициклическими), так и замкнутыми (циклическими), как прямыми, так и разветвленными.
Определение
Гомологи — органические соединения, принадлежащие к одному классу веществ, обладающие сходным строением и свойствами, но отличающиеся друг от друга по составу на одну или несколько групп СНСН2 и отвечающие одной общей формуле.
Способы отображения строения молекул. Формулы. Модели
Структуру вещества, то есть порядок соединения атомов в молекуле, отображает структурная формула, в которой связи между атомами (или группами атомов) изображаются в виде черточек: одна черточка означает одну связь или одну общую электронную пару. Поскольку углерод в органических соединениях всегда четырехвалентен, то каждый атом углерода может образовывать четыре связи (четыре черточки).
По количеству соседних углеродных атомов, атомы углерода в молекуле подразделяются на первичные(один «сосед»), вторичные (два «соседа»), третичные (три «соседа») и четвертичные (четыре «соседа»). Так, концевые атомы в молекуле углеводородов всегда первичные, в линейных молекулах промежуточные атомы — вторичные, а в разветвленных могут появляться третичные и (или) четвертичные атомы углерода.
Для отображения органических молекул используют молекулярные или брутто-формулы, которые представляют собой сокращенную форму записи количественного и качественного состава.
Например, запись СНС2Н6 означает, что молекула вещества состоит из 2 атомов углерода и 6 атомов водорода. Для каждого класса органических соединений можно вывести общую формулу,отвечающую количественному составу всех гомологов. Эту формулу называют общей формулой гомологического ряда.Вещества, принадлежащие к одному классу, отвечают одной общей формуле.
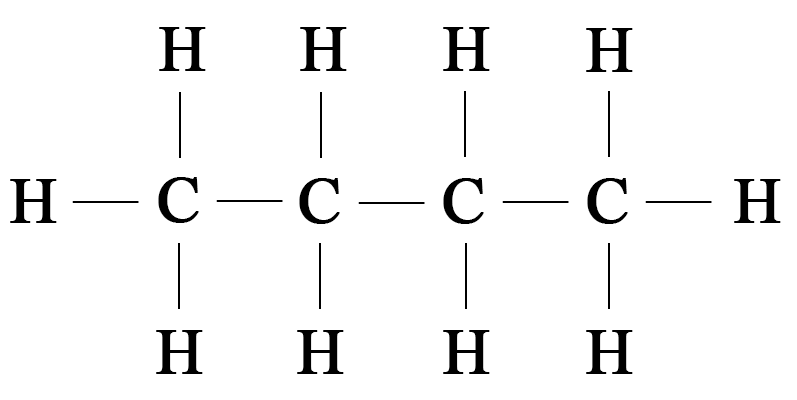
Сравним структурные формулы простейших углеводородов: метана, этана и пропана.
Молекулярная формула метана СН4, этана С2Н6, пропана С3Н8. Видно, что формула этана отличается от формулы метана на одну группу СН2. Аналогично, состав молекул пропана и этана также отличается на одну группу СН2. Следовательно, все эти вещества являются гомологами и относятся к гомологическому ряду метана. Прибавив к формуле пропана указанную гомологическую разницу СН2, получим формулу следующего представителя этого гомологического ряда — С4Н10 (бутан):
Для состава С4Н10 можно изобразить еще одну структурную формулу:
Следовательно, веществ состава С4Н10 должно быть два, каждому из этих веществ соответствует своя структурная формула. Если первое вещество называется бутаном или н-бутаном, то второе — изобутаном. Бутан и изобутан — изомеры, так как у них одинаковый количественный состав, но разный порядок соединения атомов. Подробно с явлением изомерии и изомерами можно познакомиться в теме «Виды изомерии».
Для пространственного отображения структуры молекул органических веществ используют стереохимические формулы.
Стереохимическая формула показывает пространственное расположение атомов в молекулах органических веществ.
Например, пространственное строение этана можно отобразить стереохимической формулой или с помощью проекций Ньюмена, отображающих конформации этана, то есть расположение (поворот) метильных радикалов относительно одинарной С–С-связи:
Более подробно проекции Ньюмена будут рассмотрены в теме «Виды изомерии».

Для наглядности отображения пространственного строения органических молекул используют также разные модели. Наиболее распространенными являются шаростержневые модели, в которых атомы имеют форму шаров, а связи представлены в виде палочек. Одинарная связь — одна палочка, двойная связь — две палочки. Более достоверно истинную структуру молекул отображаютмасштабные (полусферические) модели:
Источник
Способы изображения органических молекул.
Органическая химия.
2.1.Тема: «Теория строения органических соединений»
2.1.1. Основные положения теории строения органических соединений и классификация органических соединений.
1. Природные и синтетические органические вещества. Немного из истории органической химии. Общие свойства органических веществ (состав, тип химической связи, кристаллическое строение, растворимость, отношение к нагреванию в присутствии кислорода и без него).
2. Теория строения органических соединений А.М.Бутлерова. Развитие теории и ее значение.
3. Классификация органических веществ.
Свое название органические вещества получили потому, что первые из изученных веществ этой группы входили в состав живых организмов. Большинство известных сейчас органических веществ не встречаются в живых организмах, они получены (синтезированы) в лаборатории. Поэтому различают природные (натуральные) органические вещества (хотя большинство из них может быть сейчас получено в лаборатории), а органические вещества, не существующие в природе – синтетические органические веществами. Т.е. название «органические вещества» историческое и особого смысла не имеет. Все органические соединения являются соединениями углерода. К органическим веществам относятся соединения углерода, кроме изучаемых в курсе неорганической химии простых веществ, образованных Карбоном, его оксидов, угольной кислоты и ее солей. Другими словами: органическая химия – это химия соединений углерода.
Краткая история развития орг.химии:
Берцелиус, 1827, первый учебник органической химии. Виталисты. Учение о «жизненной силе».
Первые органические синтезы. Велер, 1824, синтез щавелевой кислоты и мочевины. Кольбе,1845, уксусная кислота. Бертло,1845, жир. Бутлеров,1861, сахаристое вещество.
Но как наука органическая химия началась с создания теории строения органических соединений. Существенный вклад в нее внесли немецкий ученый Ф.А.Кекуле и шотландец А.С.Купер. Но решающий вклад несомненно принадлежит русскому химику А.М.Бутлерову.
Среди всех элементов углерод выделяется своей способностью образовывать устойчивые соединения, в которых его атомы связаны друг с другом в длинные цепи различной конфигурации (линейные, разветвленные, замкнутые). Причина этой способности: примерно одинаковая энергия связи С-С и С-О (для других элементов энергия второй – намного больше). Кроме того, атом углерода может находиться в одном из трех видов гибридизации, образуя соответственно одинарные, двойные или тройные связи, причем не только между собой, но и с атомами кислорода или азота. Правда, гораздо чаще (практически всегда) атомы углерода соединены с атомами водорода. Если в состав органического соединения входит только углерод и водород, то соединения называются углеводородами. Все остальные соединения можно рассматривать как производные углеводородов, в которых некоторые атомы водорода замещены на другие атомы или группы атомов. Поэтому более точное определение: Органические соединения – это углеводороды и их производные.
Органических соединений очень много — более 10 млн. (неорганических около 500 тыс.). Состав, строение и свойства всех органических веществ имеют много общего.
Органические вещества имеют ограниченный качественный состав. Обязательно С и Н, часто О или N, реже галогены, фосфор, сера. Другие элементы входят в состав очень редко. А вот число атомов в молекуле может достигать млн, и молекулярная масса может быть очень большая.
Строение органических соединений. Т.к. состав – неметаллы. => Химическая связь: ковалентная. Неполярная и полярная. Ионная очень редко. => Кристаллическая решетка чаще всего молекулярная.
Общие физические свойства: невысокая температура кипения и плавления. Среди органических веществ есть газы, жидкости и легкоплавкие твердые вещества. Часто летучи, могут иметь запах. Обычно бесцветные. Большинство органических веществ нерастворимо в воде.
Общие химические свойства:
1) при нагревании без доступа воздуха все органические вещества «обугливаются», т.е. при этом образуется уголь (точнее сажа) и некоторые другие неорганические вещества. Происходит разрыв ковалентных связей, сначала полярных, потом и неполярных.
2) При нагревании в присутствии кислорода все органические вещества легко окисляются, и при этом конечными продуктами окисления являются углекислый газ и вода.
Особенности протекания органических реакций. В органических реакциях участвуют молекулы, в процессе реакции должны разорваться одни ковалентные связи и образуются другие. Поэтому химические реакции с участием органических соединений идут обычно очень медленно, для их проведения необходимо применять повышенную температуру, давление и катализаторы.В неорганических реакциях обычно участвуют ионы, реакции протекают очень быстро, иногда мгновенно, при нормальной температуре. Органические реакции редко приводят к высокому выходу продукции (обычно менее 50%). Они часто являются обратимыми, кроме того, может протекать не одна, а несколько реакций, конкурирующих между собой, а значит продуктами реакции будет смесь различных соединений. Поэтому и форма записи органических реакций тоже несколько другая. Т.е. используют не химические уравнения, а схемы химических реакций, в которых нет коэффициентов, но зато подробно указаны условия реакции. Принято также под уравнением записывать названия орг. веществ и тип реакции.
Но в целом органические вещества и реакции подчиняются общим законам химии, а органические вещества превращаются в неорганические или могут образовываться из неорганических. Что еще раз подчеркивает единство окружающего нас мира.
Основные принципы теории химического строения, изложенные молодым А.М.Бутлеровым на международном съезде естествоиспытателей в 1861 г.
1). Атомы в молекулах соединены между собой в определенном порядке, в соответствии с их валентностью. Последовательность соединения атомов называют химическим строением.
Валентность — это способность атомов образовывать определенное количество связей (ковалентных). Валентность зависит от числа неспаренных электронов в атоме элемента, потому что ковалентные связи образуются за счет общих электронных пар при спаривании электронов. Углерод во всех органических веществах четырехвалентен. Водород — 1, Кислород -П, азот – Ш, сера – П, хлор – 1.
Способы изображения органических молекул.
Молекулярная формула – условное изображение состава вещества. Н2СО3 — угольная кислота, С12Н22О11 – сахароза. Такие формулы удобны для расчетов. Но они не дают информацию о строении и свойствах вещества. Поэтому даже молекулярные формулы в органике пишут особым образом: СН3ОН. Но гораздо чаще пользуются структурными формулами. Структурная формула отражает порядок соединения атомов в молекуле (т.е. химическое строение).И в основе любой органической молекулы лежит углеродный скелет – это цепочка связанных между собой ковалентными связями атомы углерода.
Электронные формулы молекул – связи между атомами показаны парами электронов.



Структурные формулы отражают только порядок соединения атомов. Но молекулы органических соединений редко имеют плоское строение. Объемный образ молекулы важен для понимания многих химических реакций. Образ молекулы описывают с помощью таких понятий как длина связи и валентный угол. Кроме того, возможно свободное вращение вокруг одинарных связей. Наглядное представление дают молекулярные модели.
Источник