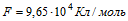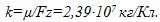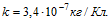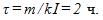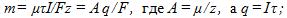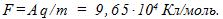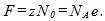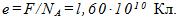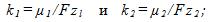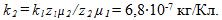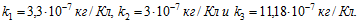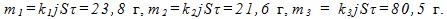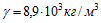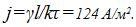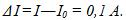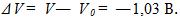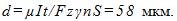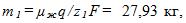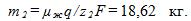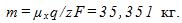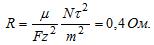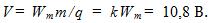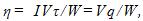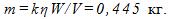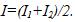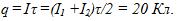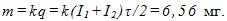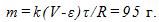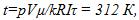- Электролиз. Законы Фарадея
- Дополнительно по теме
- Найдите массу выделившейся меди , если для ее получения электролитическим способом затрачено 5 кВтч электроэнергии?
- Определите силу тока, при котором происходил электролиз в растворе хлорной меди, если за 20 мин на катоде выделилось 4 г меди?
- Сколько меди выделится на катоде при электролизе раствора CuSO4, если через раствор протечёт электрический заряд в 100 Кл?
- Определите затраты электрической энергии на рафинирование 200 кг меди, если напряжение в электролитической ванне составляет 0, 4 В?
- В процессе электролиза масса медного катода за 1 ч увеличилась на 18 г?
- Сколько меди выделится на катоде при электролизе раствора CuSo4 если через раствор протечёт электрический разряд в 100 Кл Электрохимический эквивалет меди равен 0?
- Определите массу меди, выделившейся при электролизе?
- Медь выделяется при электролизе из раствора CuSO₄, при напряжении U = 12 B?
- Срочно помогите?
- Какая масса меди (мг) выделится на катоде при электролизе раствора CuSO4, если через электролит протечет 300 Кл электричества?
- Какое количество электроэнергии (в МДж) расходуется на получение 1 кг алюминия, если электролиз ведется при напряжении 9 B, а КПД установки 50%?
Электролиз. Законы Фарадея
Дополнительно по теме
2 Электрическое поле
3 Постоянный электрический ток
Электролиз. Законы Фарадея
1 Найти электрохимический эквивалент натрия. Молярная масса натрия m = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I=2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка
3 Найти постоянную Фарадея, если при прохож-дении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Согласно объединенному закону Фарадея
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит No=NA/z атомов или молекул.
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.
Следовательно, элементарный заряд
5 Молярная масса серебра m1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент 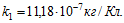
По второму закону Фарадея имеем
отсюда электрохимический эквивалент золота
Электролиз. Законы Фарадея
6 Найти массы веществ, выделившихся за время t=10ч на катодах трех электролитических ванн, вклю-ченных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiS04 и AgN03. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см . Электрохимические эквиваленты меди, никеля и серебра
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
7 При никелировании изделий в течение времени t = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля 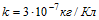
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток Io=1,5А. Какую поправку надо внести в показание амперметра, если за время t=10мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди 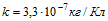
По первому закону Фарадея m = kIt, где I-ток в цепи; отсюда I=m/kt=1,6 А, т.е. в показание амперметра надо внести поправку
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время t=5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра 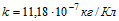
По первому закону Фарадея m = klt, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kt= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
10 Для серебрения ложек через раствор соли серебра в течение времени t=5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра m = 0,108 кг/моль, его валентность z=1 и плотность 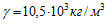
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда 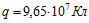
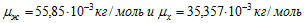
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
во второй ванне
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
12 При электролизе раствора серной кислоты (CuSO4) расходуется мощность N=37 Вт. Найти со-противление электролита, если за время t = 50 мин выделяется масса водорода m = 0,3 г. Молярная масса водорода m = 0,001 кг/моль, его валентность z=1.
13 При электролитическом способе получения никеля на единицу массы расходуется Wm= 10 кВтЧч/кг электроэнергии. Электрохимический эквивалент никеля 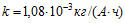
14 Найти массу выделившейся меди, если для ее получения электролитическим способом затрачено W= 5 кВтЧч электроэнергии. Электролиз проводится при напряжении V=10 В, к.п.д. установки h=75%. Электрохимический эквивалент меди 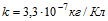
где q-заряд, прошедший через ванну. Масса выделившейся меди m=kq; отсюда
15 Какой заряд проходит через раствор серной кислоты (CuSO4) за время t=10с, если ток за это время равномерно возрастает от I1=0 до I2 = 4А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди 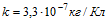
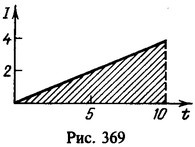
Заряд, протекший через раствор,
Нахождение заряда графическим путем показано на рис. 369. На графике зависимости тока от времени заштрихованная площадь численно равна заряду. Масса меди, выделившейся на катоде,
16 При рафинировании меди с помощью электролиза к последовательно включенным электролитическим ваннам, имеющим общее сопротивление R = 0,5 Ом, подведено напряжение V=10 В. Найти массу чистой меди, выделившейся на катодах ванны за время t=10ч. Э.д.с. поляризации e= 6 В. Электрохимический эквивалент меди 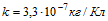
17 При электролизе воды через электролитическую ванну в течение времени t = 25 мин шел ток I=20 А. Какова температура t выделившегося кислорода, если он находится в объеме V= 1 л под давлением р = 0,2 МПа? Молярная масса воды m=0,018 кг/моль. Электрохимический эквивалент кислорода 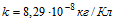
где R= 8,31 Дж/(молъ К)-газовая постоянная.
18 При электролитическом способе получения алюминия на единицу массы расходуется W1m = 50 кВтЧч/кг электроэнергии. Электролиз проводится при напряжении V1 = 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении V2 = 8,1 В?
Источник
Найдите массу выделившейся меди , если для ее получения электролитическим способом затрачено 5 кВтч электроэнергии?
Физика | 10 — 11 классы
Найдите массу выделившейся меди , если для ее получения электролитическим способом затрачено 5 кВтч электроэнергии.
Электролиз проводиться при напряжении 10В, К.
Электрохимический эквивалент меди равен 3, 3 * 10( В МИНУС седьмой) кг / Кл.
3 * 10 ^ — 7кг / Кл
M = I * t * k n = A / Q = A / I * U * t I = A / n * U * t m = A * k / n * U = 18000 000 * 3.
Определите силу тока, при котором происходил электролиз в растворе хлорной меди, если за 20 мин на катоде выделилось 4 г меди?
Определите силу тока, при котором происходил электролиз в растворе хлорной меди, если за 20 мин на катоде выделилось 4 г меди.
Электрохимический эквивалент меди 0, 329 * 10 ^ ( — 6) кг / Кл.
Сколько меди выделится на катоде при электролизе раствора CuSO4, если через раствор протечёт электрический заряд в 100 Кл?
Сколько меди выделится на катоде при электролизе раствора CuSO4, если через раствор протечёт электрический заряд в 100 Кл.
Электрохимический эквивалент меди равен 0, 33 мг / Кл.
Определите затраты электрической энергии на рафинирование 200 кг меди, если напряжение в электролитической ванне составляет 0, 4 В?
Определите затраты электрической энергии на рафинирование 200 кг меди, если напряжение в электролитической ванне составляет 0, 4 В.
Электрохимический эквивалент меди = 0, 33 * 10 ^ — 6 кг / Кл.
В процессе электролиза масса медного катода за 1 ч увеличилась на 18 г?
В процессе электролиза масса медного катода за 1 ч увеличилась на 18 г.
Электрохимический эквивалент меди (Cu 2 + ) равен 0.
33 * 10 ^ — 6 кг / Кл.
Какова сила тока, пропускаемого через электролитическую ванну?
(нужно решение, ответ : 15, 15 А).
Сколько меди выделится на катоде при электролизе раствора CuSo4 если через раствор протечёт электрический разряд в 100 Кл Электрохимический эквивалет меди равен 0?
Сколько меди выделится на катоде при электролизе раствора CuSo4 если через раствор протечёт электрический разряд в 100 Кл Электрохимический эквивалет меди равен 0.
Определите массу меди, выделившейся при электролизе?
Определите массу меди, выделившейся при электролизе.
Заряд прошедший через электролит равен 300Кл.
Электрохимический эквивалент меди 0, 33мг / Кл.
Медь выделяется при электролизе из раствора CuSO₄, при напряжении U = 12 B?
Медь выделяется при электролизе из раствора CuSO₄, при напряжении U = 12 B.
Определитеэнергию, необходимую для получения меди массой m = 1, 5 кг, если КПД установки η = 60%.
Электрохимический эквивалент меди k = 0, 33 * 10 ^ — 6Кл / кг.
Срочно помогите?
Найти расход электроэнергии для получения 80 кг меди, если напряжение на электролитической ванне 12 вольт.
Решите, а не просто напишите формулы.
Какая масса меди (мг) выделится на катоде при электролизе раствора CuSO4, если через электролит протечет 300 Кл электричества?
Какая масса меди (мг) выделится на катоде при электролизе раствора CuSO4, если через электролит протечет 300 Кл электричества?
Элетрохимический эквивалент меди 0, 329 мг / Кл.
Какое количество электроэнергии (в МДж) расходуется на получение 1 кг алюминия, если электролиз ведется при напряжении 9 B, а КПД установки 50%?
Какое количество электроэнергии (в МДж) расходуется на получение 1 кг алюминия, если электролиз ведется при напряжении 9 B, а КПД установки 50%?
Электрохимический эквивалент алюминия 9×10−8 кг / Кл.
Вопрос Найдите массу выделившейся меди , если для ее получения электролитическим способом затрачено 5 кВтч электроэнергии?, расположенный на этой странице сайта, относится к категории Физика и соответствует программе для 10 — 11 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Дано m1 = 0, 6 кг m2 = 0, 9 кг a1 = 0, 3м / с2 a2 — ? При взаимодействии m1 * a1 = m2 * a2 a2 = m1 * a1 / m2 = 0, 6 * 0, 3 / 0, 9 = 0, 2 м / с2 Ответ a2 = 0, 2 м / с2.
36 км / ч 10м / с 72 км / ч 20 м / с 100 км / ч 27, 7м / с 200 м / мин 3, 3м / с.
Ax = (Vx — Vox) \ t = (12 — 15) \ 3 = — 1 м \ с2.
Fa = pgV = 0, 006 * 800 * 10 = 48 Н.
Естенственно утонет если даже 24 кг утонет то меньше обязательно утонет.
30л, сил = 30 * 735, 5 = 22065Вт 45мин = 2700с А = Р * t = 22065 * 2700 = 59575500Дж.
18÷60 = 0, 3 (300 метров в 1 мин) 0, 3×5 = 1, 5 (1 км 500 метров) ответ : 1 км 500 м.
В конце прошлого века (1896 — 1898 гг. ) было обнаружено, что некоторые химические элементы (радий, уран, торий и др. ) создают невидимые излучения. Эти излучения, а также элементы, создающие их, были названы радиоактивными. Дальнейшие исследован..
Не хватает рисунка ! Соединение у проводников какое .
Φ1 иφ2 — потенциалы точек 1 и 2 Wп1 и Wп2 — потенциальная энергия точек 1 и 2 А1 — 2 — работа по перемещению пробного заряда из точки 1 в точку 2 = = = = = = = = = = = = = = = = = = = = = = = = = = = = =.
Источник