- Хлорид натрия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Хлорид натрия
- Характеристики и физические свойства хлорида натрия
- Получение хлорида натрия
- Химические свойства хлорида натрия
- Применение хлорида натрия
- Примеры решения задач
- Натрий хлорид
- Оглавление раздела
- Товар в наличии
- Оптовые поставки хлорида натрия
- Свойства хлорида натрия
- Транспортировка
- Получение
- Применение
- Применение
- Безопасность
- Производитель натрий хлорида
Хлорид натрия: способы получения и химические свойства
Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
5. Разбавленная хлороводородная кислота реагирует с гидроксидом натрия . Взаимодействие хлороводородной кислоты с гидроксидом натрия приводит к образованию хлорида натрия и воды:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид натрия образует нитрат натрия и осадок хлорид серебра:
NaCl + AgNO3 = NaNO3 + AgCl↓
Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.1. Твердый хлорид натрия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида натрия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, натрия, калия, газа хлора и воды:
2.2.2. Хлорид натрия взаимодействует с гидросульфатом натрия при температуре 450–800º C . При этом образуются сульфат натрия и хлороводородная кислота:
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Источник
Хлорид натрия
Характеристики и физические свойства хлорида натрия
Плавится и кипит без разложения. Умеренно растворяется в воде (не гидролизуется), растворимость не зависит от температуры, но сильно снижается в присутствии HCl, NaOH, хлоридов металла.
Рис. 1. Хлорид натрия. Внешний вид.
Основные характеристики хлорида натрия приведены в таблице ниже:
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура кипения, o С
Растворимость в воде (25 o С), г/100 мл
Получение хлорида натрия
Хлорид натрия в виде минерала галита образует залежи каменной соли среди пластов горных и осадочных пород, поэтому необходимости его получения в промышленных или лабораторных масштабах нет. Однако, иногда он образуется в качестве побочного продукта, например, в таких реакциях, как:
— взаимодействие натрия с хлором
— реакция нейтрализации между соляной кислотой и гидроксидом натрия
HCl + NaOH = NaCl + H2O.
Химические свойства хлорида натрия
В водном растворе хлорид натрия диссоциирует на ионы:
Хлорид натрия способен вступать в реакции обмена с кислотами (1) и другими солями (2, 3):
В окислительно-восстановительных реакциях хлорид натрия проявляет свойства слабого восстановителя:
При пропускании через насыщенный раствор хлорида натрия смесь газов, состоящую из аммиака и диоксида углерода можно получить гидрокарбонат натрия (выпадает в осадок):
Расплав и раствор хлорида натрия подвергаются электролизу:
Применение хлорида натрия
Хлорид натрия (поваренная соль) служит сырьем для получения хлора, соляной кислоты, едкого натра и карбоната натрия (соды), применяется в красильном деле, в мыловарении и во многих других производствах. Он служит также приправой к пище и применяется в качестве средства, предохраняющего пищевые продукты от порчи.
Примеры решения задач
| Задание | Какой объем хлора надо взять для реакции с 10 г натрия? |
| Решение | Запишем уравнение реакции взаимодействия хлора с натрием: |
Рассчитаем количество вещества натрия, вступившего в реакцию:
n (Na)= 10 / 23 = 0,43 моль.
Согласно уравнению, n (Na) :n(Cl2) = 2 : 1, значит,
n (Cl2) = ½ n (Na) = ½ ×0,43 = 0,215моль.
Тогда, объем хлора, вступившего в реакцию взаимодействия с натрием равен:
V (Cl2) = 0,215 × 22,4 = 4,816л.
| Задание | К 200-м граммам 5%-го раствора хлорида натрия добавили 15 г этой же соли и столько же граммов воды. Чему стала равна массовая доля хлорида натрия в получившемся растворе? |
| Решение | Решение задачи следует начать с записи формулы для вычисления массовой доли растворенного вещества: |
Найдем массу растворенного вещества хлорида натрия в изначальном растворе:
msolute (NaCl) = ω (NaCl) / 100% ×msolution;
msolute (NaCl) = 5 / 100% × 200 = 10 г.
Рассчитаем массу нового раствора:
msolution(new) = 200 + 15 + 15 = 230 г.
Найдем общую массу растворенного хлорида натрия и его массовую долю в новом растворе:
m(NaCl)sum = 10 + 15 = 25г.
ω (NaCl)new= 25 / 230 × 100% = 11%.
Источник
Натрий хлорид
Оглавление раздела
Товар в наличии
Оптовые поставки хлорида натрия
Наш завод по производству химических реагентов, производит хлорид натрия в любых объемах. Так же Вы можете заказать его доставку, в каком бы городе России Вы ни находились, товар дойдет в полной сохранности, т.к. мы используем только тару по ГОСТу.
Сделав заказ натрия хлорида партии любого объема, Вы получите продукт вовремя и должного качества, с отгрузкой прямо с нашего завода без посреднических наценок и других издержек. Чистое вещество напрямую от российского производителя.
Свойства хлорида натрия
Хлорид натрия с обозначением химической формулы как NaCl — представляет из себя натриевую соль соляной кислоты. Этот химический элемент называют еще как поваренная соль, или как обычная соль, которую используют широко в кулинарии и которая знакома каждой домохозяйке. Хлорид натрия в большом количестве содержится в морской воде, из которой ее активно добывают. А уже чистый хлорид натрия имеет вид бесцветных кристаллов.
Кристаллы хлорида натрия под микроскопом
Схема строения молекул вещества
Окраска раствора должна измениться от прибавления не более 0,5 мл 0,01 М раствора натрия гидроксида или не более 0,5 мл 0,01 М раствора хлористоводородной кислоты
| Показатели качества | |
| Наименование показателя | Требования ФСП |
| 1. Описание | Белый кристаллический порошок или крупинки, или бесцветные кристаллы |
| 2. Растворимость | Легко растворим в воде, мало растворим в спирте 96% |
| 3. Подлинность | Дает характерные реакции на натрий и хлориды |
| 4. Прозрачность раствора | Должен быть прозрачным |
| 5. Цветность раствора | Должен быть бесцветным |
| 6. Кислотность или щелочность | Окраска раствора должна измениться от прибавления не более 0,5 мл 0,01 М раствора натрия гидроксида или не более 0,5 мл 0,01 М раствора хлористоводородной кислоты |
| Щелочноземельные металлы и магний | Не более 0,01% в пересчете на кальций |
| 8. Барий | Мутность раствора субстанции не должна превышать мутность эталонного раствора |
| 9. Железо, %, не более | 0,0003 |
| 10. Тяжелые металлы, %, не более | 0,0005 |
| 11. Сульфаты, %, не более | 0,005 |
| 12. Калий, %, не более | 0,05 |
| 13. Соли аммония, %, не более | 0,004 |
| 14. Потеря в массе при высушивании, %, не более | 0,5 |
| 15. Мышьяк, %, не более | 0,00005 |
| 16. Фосфаты, %, не более | 0,0025 |
| 17. Бромиды, %, не более | 0,005 |
| 18. Иодиды | Раствор не должен окрашиваться в голубой цвет |
| 19. Ферроцианиды | Раствор не должен окрашиваться в голубой цвет |
| 20. Микробиологическая чистота | Категория 1.2.Б |
| 21. Количественное определение (NaCl), %, в пределах | Не менее 99,5% NaCl в пересчете на сухое вещество |
| 22. Бактериальные эндотоксины, предельное содержание не более | Не более 5 ЕЭ на 1 г субстанции |
| Упаковка | По 1 кг, 3 кг, 5 кг в полипропиленовые пакет из полиэтиленовой пленки, который термосваривают двумя швами, снабжая внутренней этикеткой. Пакеты укладывают в тканый полипропиленовый мешок с внутренним полиэтиленовым пакетом и прошивают вместе с этикеткой. По 25 кг – в тканый полипропиленовый мешок с внутренним полиэтиленовым пакетом Полиэтиленовый пакет термосваривают, полипропиленовый мешок прошивают. Каждая упаковка снабжена этикеткой. Этикетка из этикеточной бумаги, писчей, офсетной. |
| Маркировка | В соответствии с нормативной документацией |
| Хранение | В сухом месте при температуре не выше 250С |
| Срок годности | 5 лет |
Не более 5 ЕЭ на 1 г субстанции
| Общие свойства | |
|---|---|
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит |
| Хим. формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| Растворимость в метаноле | 1,49 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,544202 (589 нм) |
| Структура | |
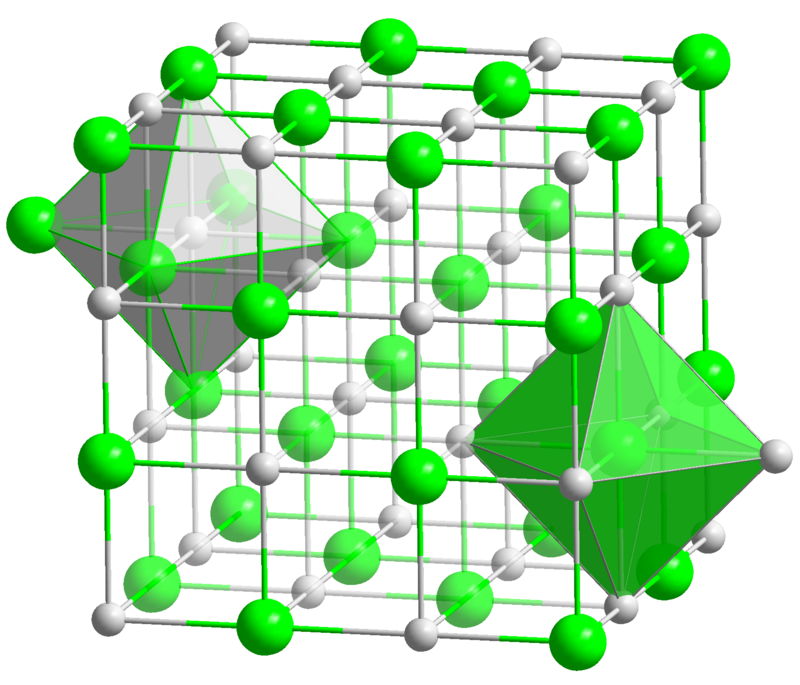
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | [Na+].[Cl-] |
| InChI | InChI=1S/ClH.Na/h1H;/q;+1/p-1 FAPWRFPIFSIZLT-UHFFFAOYSA-M |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 | |
Транспортировка
Наш завод предоставляет гарантию на хранение вещества при должном соответствии требований, предъявляемые при правильной транспортировке и хранении.
Так как хлорид натрия требует к себе особого внимания при транспортировке, то нужно отнестись к его упаковке с особой тщательностью. Вообще, разработаны ГОСТы по его упаковке, и мы конечно, стараемся их соблюдать. Поэтому на нашем химическом заводе готовое вещество упаковываются в прочные полиэтиленовые мешки, которые в свою очередь завязываются двойным узлом нитью (или запаиваются). После этого возможна дополнительная упаковка в в фанерные коробы или в картонные. Или, на выбор покупателя, так же возможна упаковка этого вещества в бумажные пяти-шести-слойные мешки.
Получение
Хлорид натрия добывается из естественных природных источников, обычно к ним относятся залежи галита, осадочной горной породы в виде каменной соли ну и конечно же он содержится в огромном количестве в морской воде, из которой ее просто выделяют методом выпаривания
Применение
В фармацевтике изотонический раствор хлорида натрия применяется как средство для дезинтоксикации, а так же в качестве растворителя каких либо других лекарственных средств. А так же при многих других ситуациях — как гипертонический раствор, вспомогательный осмотический диуретик, так же используется для поднятия давления при кровотечениях, при отравлении нитратом серебра, а так же для обработки гнойных ран и при отечностях в качестве наружного средства.
Как видно из описания, данный химический элемент довольно распространен в медицинской области. Но он так же активно применяется чуть ли не повсеместно и в промышленности и быту.
Применение

А так же имеем собственный автотранспорт, специально приспособленный для перевозки химических веществ на дальние расстояния.
При заключении долговременного на поставки продукции с нашего химического предприятия, для Вас начинают действовать особые цены, которые помогут сделать общение с нами еще более выгодным.
Хлорид калия оптом доступен для отгрузки с нашего склада , в любых количествах, в различных фасовках по самым выгодным ценам от Российского производителя. Предоставляем готовые ТУ, а также разрабатываем новые — под ваши конкретные запросы.
Безопасность
В помещениях где активно ведется работа с хлорид натрием, у рабочих должны быть маски (респираторы) и защитные очки. При попадании вещества в глаза, обильно промыть водой. При вдыхании большого количества пыли, выйти на свежий воздух, продышаться.
Среди экологических меры предосторожности есть рекомендации держать вещество подальше от канализации, поверхностных и грунтовых вод.
Производитель натрий хлорида

МЗХР обладает всем необходимым, что бы выполнить любой заказ точно по техническим условиям заказчика и, что не маловажно, в нужный временной интервал.
Вот какие преимущества позволяют нам этого добиться:
- собственный ж/д тупик, благодаря которому возможно отправить продукцию в любую точку Европы или Азии, а так же ближнего востока;
- контроль качества производства, имеется собственная лаборатория;
- Надежное и проверенное оборудование, которое позволяет произвести большие объемы за короткое время;
- наличие больших запасов сырья;
- собственные склады;
- свой автотранспорт.
Михайловский завод химических реагентов — российский производитель натрий хлорида, географически расположенный примерно по центру России — в Алтайском крае, нам удобно отправить продукцию как на запад, так и на восток страны.
Источник