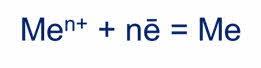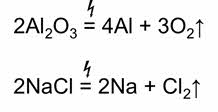- Натрий получают способом пирометаллургическим
- Пирометаллургия — определение и способы получения металлов
- Описание
- Пирометаллургические методы
- Металлы в природе. Способы получения металлов
- Урок 31. Химия 11 класс ФГОС
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Металлы в природе. Способы получения металлов»
- Тест по химии «Щелочные металлы»
- Дистанционное обучение как современный формат преподавания
- Методическая работа в онлайн-образовании
- Современные педтехнологии в деятельности учителя
- Оставьте свой комментарий
- Безлимитный доступ к занятиям с онлайн-репетиторами
- Подарочные сертификаты
Натрий получают способом пирометаллургическим
Козловой кран — это конструкция крана, размещенная на портальной или аналогичной платформе, при этом вся его конструкция предназначена для перемещения над пространством.
Автозаправочные станции – объекты, на которых всегда повышен риск пожаров, задымлений.
Наличие искусственных водоемов на приусадебных участках уже давно перестало быть редкостью. К настоящему времени они стали не только красивыми и функциональными, но и.
Скрытые петли – это фурнитура, которая позволяет сделать зазор между полотном и коробом минимальным, а эксплуатацию двери удобной, долговечной и надежной.
Если вы новичок в сварке и только начинаете свой путь, то сегодняшний огромный рыночный ассортимент продукции сварочных аппаратов, поначалу может привести в.
Из одного деревянного бруса сразу несколько досок выпиливаются с помощью многопильных деревообрабатывающих станков. Формы и размеры заготовок задаются заранее. По.
Долговечность и устойчивость строения зависит от качества и прочности фундамента. Специальные блоки нередко используют для того, чтобы создать надежное основание. Со.
Натяжной потолок — отличное решение для современного интерьера, имеющее целый ряд преимуществ.
Источник
Пирометаллургия — определение и способы получения металлов
Современная металлургия обладает большим количеством способов получения чистого металла. Одним из них является пирометаллургия. Она включает целую совокупность технологических процессов, которые протекают при высоких температурах. С его помощью получают различные металлы: чёрные (сталь, чугун) и цветные (медь, никель, титан и многие другие).

Описание
Основу технологического процесса пирометаллургии составляет плавка, которая протекает при достаточно высоких температурах. Необходимая величина температуры зависит от степени плавления элемента, который необходимо получить. Они делят на три большие категории:
- легкоплавкие (с температурой плавления до 600 °С);
- среднеплавкие (не более 1600 °С, к ним относятся: никель сурьма, кальций);
- тугоплавкие (их температура плавления превышает 1600 °С).
Сырьём в пирометаллургии служит: руда, содержащая необходимый металл, концентраты, различные добавки. При обработке первичного сырья получают два компонента: металл и шлак. В некоторых процессах получают так называемый штейн и шлак. Получение необходимой температуры обеспечивается за счёт применения естественного топлива (угля, газа, продуктов нефтепереработки), температуры химических реакций, электрического нагрева.
В черной пирометаллургии характерным примером получения стали служит доменная плавка. С её помощью получают сталь различных марок.
В цветной металлургии каждый металл обладает своими специфическими особенностями. Поэтому для получения используют свои специфические приёмы, которые подходят только для конкретного элемента. Например, для получения меди или никеля предварительно производят плавку на штейн. Потом из него получают черновой материал.
Современная пирометаллургия обладает большим количеством разнообразных конструкций плавильных печей. Они бывают вертикальные и горизонтальные, периодические и непрерывные, с различным способом нагрева, со специфическими процессами (ликвация, электроннолучевая плавка, зонная и другие)
Большую популярность такие процессы получили для получения многих тугоплавких металлов: молибдена, титана, ванадия.
На завершающем этапе пирометаллургии выделяют чистый материал различными приёмами. Получения алюминия осуществляется проведением электролиза. В качестве сырья применяется глинозём. Процесс протекает при температуре,более 1000 °С. Чистый элемент собирают на угольном катоде. Для этой технологической операции существует специальная ванна. Приведенный пример показывает, что у цветных металлов проведение электролиза необходимо для выделения чистой фракции.
Пирометаллургические методы
Основными методами (способам) такого извлечения металлов является восстановление. К ним относятся:
- металлотермия;
- силикатотермия;
- восстановление различными элементами или химическими соединениями.
Любой пирометаллургический метод предполагает высокотемпературное протекание процесса. Первый из перечисленных пирометаллургических способов предполагает ускорение реакции восстановления за счёт свойств более активных металлов. Например, алюминия, магния, натрия.
Второй метод пирометаллургии – это восстановление необходимого элемента с помощью кремния. Остальные способы реализовываются за счёт применения различных химических элементов (например, водорода,углерода) или соединениями (например, гидритами различных металлов, монооксидом углерода).
Применение углерода и его монооксида в пирометаллургии считается целесообразным, когда отсутствуют высокие требования к чистоте получаемого материала и не допускаются высокие затраты на проведение реакции.
Обычно углеродом восстанавливают следующие элементы:
- железо из двух его соединений с кислородом: оксид железа (III) и четырёхмерного оксида железа (магнетита);
- олова из касситерита;
- меди из куприта.
Методы с применением углерода объединяются одним термином – карбометрия. Кроме перечисленных технологий к современной пирометаллургии относят так называемую хлорную металлургию. Она обеспечивает выделение материала при хлорировании сырья с добавлением, так называемого восстановителя. На завершающем этапе производят переработку полученных хлоридов. Этот метод обладает определёнными преимуществами перед классической пирометаллургией. К ним относятся: практически полное извлечение необходимого содержимого, более высокая скорость реакции.
Источник
Металлы в природе. Способы получения металлов
Урок 31. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Металлы в природе. Способы получения металлов»
С металлами в свободном состоянии человек знаком с самой глубокой древности. Изначально человеку было известно только 7 металлов, так называемы «металлы древности».
За последние 250 лет открыто и получено в свободном виде 86 новых металлов.
Использовать металлы в свободном виде человек начал в древние века. Первыми металлами из них были золото, серебро, медь. Освоение выплавки железа в больших масштабах сделало огромный переворот в промышленности.
В природе металлы встречаются как в виде простых веществ (в свободном виде), а также в виде соединений. Малоактивные металлы: медь, золото, серебро, платина, палладий и др. в природе могут находиться как в свободном виде, так и в составе соединений. Активные металлы: натрий, калий, кальций, алюминий, магний и др. встречаются в природе только в виде соединений: оксидов, сульфидов, карбонатов и т.д.
Если металл в природных условиях находится в свободном состоянии, то для получения чистого металла нужно только избавиться от соответствующих смесей. Получение металлов из соединений – это задача металлургии.
Большинство металлов находится в природных условиях в виде соединений – руд. Руда – это природное минеральное образование, в котором атомы химических элементов находятся в окисленном состоянии. Для получения металла для этого необходимо провести процесс восстановления:
Для данного процесса используют восстановители, такие как, водород, более активные металлы, углерод (в виде кокса), оксид углерода (II), постоянный электрический ток.
Технологические процессы, лежащие в основе промышленных способов получения металлов из руд, можно разделить на пирометаллургические, гидрометаллургические, электрометаллургические.
Пирометаллургические способы получения металлов основаны на использовании различных восстановителей для получения металлов путем восстановления из руд при высокой температуре.
В гидрометаллургических методах процесс восстановления протекает в водном растворе.
В электрометаллургических процессах восстановителем является постоянный электрический ток.
Водород как восстановитель может использоваться для получения металлов со средней и малой химической активностью: например, меди, вольфрама, молибдена. В данном случае водород восстанавливает металл из его оксида при высокой температуре.
Восстановить металлы из их оксидов можно с помощью более активного металла, поэтому процесс восстановление металлами называется металлотермией. Если в роли восстановителя металла выступает алюминий, то данный процесс называется алюмотермией.
Так, алюминий используется для получения кальция из его оксида, а металлический кальций используют для получения цезия.
Ca + 2СsСl = CaCl2 + 2Cs
Углерод и оксид углерода (II) являются сильными восстановителями.
CuO + CO = Cu + CO2↑
Свободный углерод (в виде кокса) и оксид углерода (II) служат восстановителями при производстве железа в доменном процессе. В общем виде:
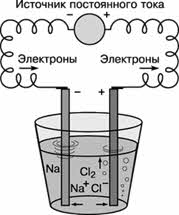
Постоянный электрический ток является самым сильным восстановителем. С помощью электрического тока получают многие активные металлы: натрий, калий, кальций и др. При этом процесс идёт не в водном растворе, а в расплаве при повышенной температуре.
Алюминий в промышленных масштабах получают путём электролиза раствора оксида алюминия в расплавленном криолите (Na3AlF6).
Таким образом, большинство металлов в природе находятся только в виде соединений, в самородном состоянии встречаются золото, медь, палладий и др. Получение металлов из соединений – это задача металлургии. В зависимости от способа получения металлов различают следующие методы: пирометаллургия, электрометаллургия и гидрометаллургия. В пирометаллургическом методе использую восстановители: водород, углерод, оксид углерода (II), более активные металлы.
Источник
Тест по химии «Щелочные металлы»
А 1. Щелочные металлы – это:
а) р-элементы б) f-элементы в) s-элементы
А 2. В ряду от лития к францию атомный радиус:
а) увеличивается б) уменьшается в) не изменяется
А 3. При сгорании лития пламя окрашивается в:
а) красный цвет б) желтый цвет в) фиолетовый цвет
А 4. Оксид калия обладает свойствами:
а) основными б) кислотными в) амфотерными
А 5. На внешнем энергетическом уровне атомы щелочных металлов имеют:
а) 1 электрон б) 2 электрона в) 3 электрона
А 6. В реакциях с неметаллами щелочные металлы являются:
а) окислителями б) восстановителями
А 7. Натрий получают способом:
а) пирометаллургическим б) гидрометаллургическим в) электролизом
А 8. При взаимодействии натрия с кислородом образуется:
а) оксид натрия б)гидроксид натрия в) пероксид натрия
А 9. Пищевая сода имеет формулу:
а) растворимые основания б) при нагревании разлагаются
в) окрашивают лакмус в синий цвет г) жидкости
А 11. Гидроксид натрия реагирует с каждым из двух веществ:
А 12. В уравнении реакции натрия с водой коэффициент перед формулой водорода:
а) 1 б) 2 в) 3 г) 4
В 1. Расположите вещества по увеличению основных свойств:
а) LiOH б) KOH в) NaOH г) RbOH
В 2. Практически возможными являются реакции между:
а) гидроксидом калия и нитратом цинка б) оксидом натрия и гидроксидом бария
в) карбонатом натрия и соляной кислотой г) хлоридом натрия и нитратом серебра
А 1. На внешнем энергетическом уровне щелочные металлы содержат
а) 1 электрон б) 2 электрона в) 3 электрона
А 2. В ряду от лития к францию восстановительные свойства:
а) увеличивается б) уменьшается в) не изменяется
А 3. При сгорании натрия пламя окрашивается в:
а) красный цвет б) желтый цвет в) фиолетовый цвет
А 4. Оксид натрия обладает свойствами:
а) основными б) кислотными в) амфотерными
А 5. Вид химической связи в молекуле хлорида натрия:
а) ковалентная полярная б) ковалентная неполярная
в) ионная г) металлическая
А 6. Верны ли суждения: 1) Соли щелочных металлов твердые кристаллические вещества ионного строения. 2) Гидроксиды щелочных металлов – твердые белые вещества, очень гигроскопичны.
а) верны оба суждения б) верно только 1 в) верно только 2
А 7. Калий получают способом:
а) пирометаллургическим б) гидрометаллургическим в) электролизом
А 8. При взаимодействии калия с кислородом образуется:
а) оксид калия б)гидроксид калия в) пероксид калия
А 9. Кислая соль имеет формулу:
А 10. Для щелочей не характерны реакции:
а) с кислотами б) с основными оксидами
в) с амфотерными гидроксидами г) с кислотными оксидами
А 11. Оксид натрия реагирует с каждым из двух веществ:
А 12. В уравнении реакции калия с водой коэффициент перед формулой водорода:
а) 1 б) 2 в) 3 г) 4
В 1. Расположите вещества по увеличению основных свойств:
а) LiOH б) KOH в) NaOH г) RbOH
В 2. Практически возможными являются реакции между:
а) гидроксидом натрия и нитратом алюминия б) оксидом калия и гидроксидом кальция
в) карбонатом калия и серной кислотой г) оксидом калия и водой
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 801 человек из 76 регионов
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
- Сейчас обучается 24 человека из 13 регионов
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
- Курс добавлен 23.09.2021
- Сейчас обучается 46 человек из 23 регионов
Ищем педагогов в команду «Инфоурок»
Номер материала: ДВ-548453
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Минпросвещения разрабатывает образовательный минимум для подготовки педагогов
Время чтения: 2 минуты
Минобрнауки учредит именные стипендии для студентов из малочисленных народов
Время чтения: 1 минута
Рособрнадзор откажется от ОС Windows при проведении ЕГЭ до конца 2024 года
Время чтения: 1 минута
Минпросвещения будет стремиться к унификации школьных учебников в России
Время чтения: 1 минута
Шойгу предложил включить географию в число вступительных экзаменов в вузы
Время чтения: 1 минута
Правительство предложило потратить до 1 млрд рублей на установку флагов РФ у школ
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Источник