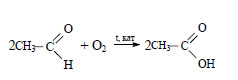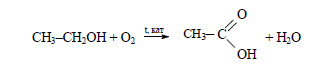Какие методы получения уксусной кислоты вам известны и которые из них являются более перспективными и почему? Подтвердите это уравнениями соответствующих реакций.
Уксусную кислоту можно получать следующими способами:
1) Из метана, являющегося основным компонентом природного газа, получают ацетилен:
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
При окислении уксусного альдегида образуется уксусная кислота:
2) При гидратации этилена, являющегося побочным продуктом крекинга нефти, получают этиловый спирт:
При окислении этилового спирта получают уксусную кислоту:
3) Уксусную кислоту можно получить при окислении бутана в присутствии катализатора:
Наиболее перспективным является последний метод, так как бутан является компонентом природного газа и попутных нефтяных газов, а уксусная кислота получается в одну стадию.

задача №12
к главе «Глава XIV. Обобщение знаний по курсу органической химии».
Источник
Технологические аспекты получения уксусной кислоты
Авторы: С.В. Афанасьев (Тольяттинский госуниверситет), В.Л. Гартман (ООО «НИАП-КАТАЛИЗАТОР»), Н.А. Мораш (Тольяттинский госуниверситет).
Опубликовано в журнале Химическая техника №9/2018
Современные крупнотоннажные производства уксусной кислоты являются достаточно высокорентабельным и включают несколько технологических стадий:
- очистку природного газа от сернистых соединений;
- пароуглекислотную конверсию природного газа;
- очистку конвертируемого газа от СО2 раствором моноэтаноламина;
- компрессию природного газа, диоксида углерода, конвертируемого газа и оксида углерода;
- выделение оксида углерода криогенным методом [1].
Это делает оправданным создание совмещенных производств по выпуску уксусной кислоты на базе существующих агрегатов аммиака..
Мощность установки СН3СООН в 150 000 т в год считается оптимальной. Это объясняется тем, что основное оборудование синтеза и ректификации изготавливается из дорогостоящих сплавов циркония и никеля, имеющих высокую стойкость против коррозии и обеспечивающих эффективную работу при высоких температурах и давлениях.
Процесс конверсии с целью получения оксида углерода осуществляется в печах риформинга под давлением 1,8 МПа. В качестве сырья используется природный газ и диоксид углерода. Для достижения требуемой производительности печей риформинга оправдано использование тонкостеннных реакционных труб с повышенным ресурсом работы [2].
Получаемый синтез-газ охлаждается в рекуперационных теплообменниках криогенной установки до температуры 283 К. После удаления следов Н2О и СО2 в адсорбере синтез-газ поступает в холодильный блок, где происходит его дальнейшее охлаждение и частичное ожижение. В дальнейшем осуществляется обработка потоков в специальной колонне, где СО вымывается жидким метаном, а в башенном охладителе протекает отпарка растворенного Н2.
Для захолаживания потоков до нужных параметров используется турбодетандер. Полученный сжиженный СО поступает в отделение синтеза уксусной кислоты, а водород выдается в производство аммиака.
Для производства ледяной уксусной кислоты используется процесс карбонилирования под низким давлением с использованием метанола и оксида углерода в качестве сырья.
Основные его стадии рассмотрены в работах [2–4].
Реакция протекает при температуре 200…270°С и давлении 20…70 МПа в присутствии карбонилов железа, кобальта или никеля. В качестве промоторов используют галогенсодержащие соединения.
Согласно многочисленным исследованиям, каталитическая активность карбонилов металлов уменьшается в следующим образом:
Ni > Co > Fe, а эффективность промоторов снижается от йода к хлору
Синтез уксусной кислоты из метанола впервые был разработан и осуществлен в промышленном масштабе немецкой фирмой BASF. Процесс проводят в присутствии кобальтового катализатора и йодсодержащего промотора при 200 °С и 70 МПа. Каталитически активным соединением является комплекс HCo(CO)4, образующийся при протекании следующих реакций:
Йодоводород, реагируя с метанолом, образует йодметан:
Далее в результате окислительного присоединения HCo(CO)4 к йодметану образуется метилкобальткарбонил:
Последующее присоединение CO и гидролиз комплекса приводят к образованию уксусной кислоты и регенерации катализатора:
Принципиальная технологическая схема процесса получения уксусной кислоты из метанола фирмы BASF приведена на рисунке.
Раствор катализатора в метаноле поступает сверху в колонну синтеза 1, а снизу подается оксид углерода. Синтез осуществляется при 250°С и 70 МПа. Реакционная смесь из колонны синтеза поступает вначале в сепаратор высокого давления 2, а затем в сепаратор низкого давления 3. Непрореагировавший оксид углерода из сепаратора 2 снова возвращается в процесс.

1 – колонна синтеза; 2, 3 – сепараторы высокого и низкого давлений; 4…6 – ректификационные колонны; I – метанол + + катализатор; II – оксид углерода; III – продукты синтеза; IV – отработанный газ; V – раствор катализатора; VI – метанол; VII – уксусная кислота-сырец; VIII – товарная уксусная кислота; IX – кубовый остаток на сжигание [4] Жидкие продукты далее отделяются в колонне 4 от катализатора и подаются в ректификационную колонну 5. Раствор катализатора возвращается в колонну синтеза 1. С верха колонны 5 отбирается непрореагировавший метанол, а кислота-сырец подается на ректификацию в колонну 6.
Кубовый остаток колонны 6 периодически отбирается на сжигание. Выход уксусной кислоты составляет 90 % в расчете на метанол.
Жесткие условия проведения процесса являются существенным недостатком, ограничивающим его широкое промышленное применение. Поэтому выявленная фирмой Monsanto способность родиевых соединений катализировать реакцию карбонилирования метанола при атмосферном давлении и температуре 100 °С имела важное практическое значение.
Синтез уксусной кислоты с использованием родиевого катализатора в промышленных условиях проводят при температуре
180 °С, давлении 3…4 МПа. Концентрация катализатора поддерживается на уровне 0,001 моля в расчете на 1 т реакционной смеси. Предшест-венником катализатора может служить почти любое соединение родия, но обычно используют RhCl3⋅3Н2О, а в качестве промотора – HI.
Как металлический родий, так и йодистый водород достаточно дороги, поэтому с экономической точки зрения необходимо организовать практически полный их возврат в цикл. Кроме того, в связи с высокой коррозионной активностью системы Rh/HI большая часть оборудования должна быть изготовлена из дорогих сплавов.
Механизм карбонилирования метанола в присутствии родиевого катализатора представлен ниже:
Каталитически активным соединением выступает[Rh(CO)2I2]–, к которому присоединяется йодметан. Анионный комплекс одновалентного родия обладает сильными нуклеофильными свойствами, и эта стадия протекает с необычайно высокой скоростью. Образующееся метильное производное трехвалентного родия (I) нестабильно и быстро изомеризуется в продукт (II). Последний, реагируя с CO, образует лабильный комплекс (III), который подвергается восстановительному элиминированию с регенерацией катализатора.
Каталитический цикл завершается реакциями, в результате протекания которых образуются уксусная кислота и регенерируется промотор – йодистый метил:
Таким образом, родиевая технология получения уксусной кислоты аналогична кобальтовой. Принципиальное отличие заключается в том, что при карбонилировании метанола с использованием комплексов родия применяется оборудование низкого давления. Процесс осуществляется при пониженных температурах [2].
Можно выделить два основных брутто-процесса:
- карбонилирование метанола окисью углерода с образованием уксусной кислоты;
- реакцию водогазовой конверсии, при которой из оксида углерода и воды образуются диоксид углерода и водород.
Обе реакционные системы приведены ниже.
оксид метанол уксусная углерода кислота
2) Реакция парогазовой конверсии является основной побочной реакцией:
Наряду с этим образуется незначительное количество пропионовой кислоты:
этанол оксид пропионовая углерода кислота
Важная роль отведена участку приготовления/регенерации катализатора и синтеза промотора:
- синтез свежих растворов катализатора для подачи в основную реакционную систему установки;
- приготовление йодистого метила;
- удаление продуктов коррозии из каталитической системы.
Йодид родия смешивают с водным раствором уксусной кислоты в осадителе-растворителе катализатора. Эту смесь подогревают и перемешивают, продувая через сосуд СО. После окончания приготовления катализатора раствор перекачивают в емкость.
Йодистый метил, играющий роль промотора, готовится в две стадии в отдельном реакторе. Первая стадия включает смешивание элементного йода с раствором йодистого водорода и воды, нагревание в присутствии родиевого катализатора и продувку СО.
Вторая стадия начинается с понижения температуры, уменьшения давления и введения метанола. Метанол быстро реагирует с НI. В процессе получения летучего МеI повышается давление в реакторе промотора.
Йодистый метил дистиллируется в верхнем погоне, конденсируется в конденсаторе промотора и охлаждается в переохладителе промотора. Продукт хранится в емкости для хранения промотора. Все отработанные газы направляются в испарительную емкость в зоне синтеза.
Регенерация катализатора предусматривает удаление продуктов коррозии из его раствора. Для решения этой задачи из испарительной емкости стадии синтеза он подается в осадитель-растворитель катализатора, где родий осаждается, а продукты коррозии остаются в растворе. Затем отстоявшуюся жидкость, содержащую продукты коррозии, сливают из осадителя-растворителя в концентратор остатка катализатора. Родий, оставшийся осажденным в осадителе-растворителе, повторно растворяют и перекачивают в катализаторную емкость или возвращают в испаритель в зоне реакции.
Многие из перечисленных катализаторов и материалов производятся в Российской Федерации и используются в отрасли. Определенный практический интерес представляют хлорированные отходы феррониобиевого производства, обладающие достаточно высокой каталитической активностью при карбонилировании метанола [7].
В условиях мирового роста производства аммиака становится актуальной задача создания на базе существующих в России аммиачных производств установок по выпуску уксусной кислоты, являющейся базовым продуктом многочисленных нефтехимических предприятий.
Источник
Курсовая работа: Производство уксусной кислоты
| Название: Производство уксусной кислоты Раздел: Рефераты по химии Тип: курсовая работа Добавлен 19:46:12 18 декабря 2010 Похожие работы Просмотров: 15641 Комментариев: 21 Оценило: 8 человек Средний балл: 4.6 Оценка: 5 Скачать | |||||||||||||||||||||||
| 1. Внешний вид | Бесцветная, прозрачная жидкость без механических примесей |
| 2. Растворимость в воде | Полная, раствор прозрачный |
| 3. Массовая доля уксусной кислоты, %, не менее | 99,5 |
| 4. Массовая доля уксусного альдегида, %, не более | 0,004 |
| 5. Массовая доля муравьиной кислоты, %, не более | 0,05 |
| 6. Массовая доля сульфатов (SO4), %, не более | 0,0003 |
| 7. Массовая доля хлоридов (Cl),%, не более | 0,0004 |
| 8. Массовая доля тяжелых металлов осаждаемых сероводородом (Pb), %, не более | 0,0004 |
| 9. Массовая доля железа (Fe), %, не более | 0,0004 |
| 10. Массовая доля нелетучего остатка, %, не более | 0,004 |
| 11. Устойчивость окраски раствора марганцовокислого калия, мин, не менее | 60 |
| 12. Массовая доля веществ, окисляемых двухромовокислым калием, cm3 раствора тиосульфата натрия, концентрация с (Na2 SO3 *5H2 O) = 0,1 моль/дм3 (0,1H), не более | 5,0 |
1.2 Применение уксусной кислоты Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов.Водный раствор уксусной кислоты используют в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).В состав уксуса входят такие кислоты, как яблочная, молочная, аскорбиновая, уксусная.Яблочный уксус ( 4% уксусной кислоты )Яблочный уксус содержит 20 важнейших минеральных веществ и микроэлементов, а также уксусную, пропионовую, молочную и лимонную кислоты, целый ряд ферментов и аминокислот, ценные балластные вещества, такие, как поташ, пектин. Яблочный уксус широко применяется при приготовлении различных блюд и консервировании. Он прекрасно сочетается со всевозможными салатами, как из свежих овощей, так и мясными и рыбными. В нем можно мариновать мясо, огурцы, капусту, каперсы, портулак, а также трюфели. Однако, на Западе яблочный уксус известен больше своими лечебными свойствами. Он применяется при повышенном кровяном давлении, мигренях, астме, головной боли, алкоголизме, головокружении, артрите, болезнях почек, высокой температуре, ожогах, пролежнях и др.Здоровым людям рекомендуется каждый день употреблять полезный и освежающий напиток: в стакане воды размешать ложку меда и добавить 1 ложку яблочного уксуса. Желающим похудеть, рекомендуем каждый раз во время еды выпивать стакан несладкой воды с двумя ложками яблочного уксуса.Уксус широко используется в домашнем консервировании для приготовления маринадов различной крепости. В народной медицине уксус используется как неспецифическое жаропонижающее средство (путем протирания кожи раствором воды и уксуса в пропорции 3:1), а также при головных болях методом примочек. Распространено применение уксуса при укусах насекомых посредством компрессов.Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска волосам после химической завивки и перманентной окраски. Для этого волосы рекомендуется ополаскивать теплой водой с добавлением спиртового уксуса (на 1 литр воды — 3-4 ложки уксуса).Уксус виноградный ( 4% уксусной кислоты )Виноградный уксус широко используется ведущими поварами не только Словении, но и всего мира. В Словении его традиционно используют при приготовлении различных овощных и сезонных салатов (2-3 ст. ложки на салатницу), т.к. он придает неповторимый и изысканный вкус блюду. Также виноградный уксус прекрасно сочетается с различными рыбными салатами и блюдами из морских продуктов. При приготовлении шашлыков из различных сортов мяса, но особенно из свинины, виноградный уксус просто незаменим.Уксусная кислота применяется также для производства лекарственных средств. Таблетки Аспирина (ЭС) содержат активный ингредиент ацетилсалициловую кислоту, которая представляет собой уксусный эфир салициловой кислоты. Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с безводной уксусной кислотой в присутствии небольшого количества серной кислоты (в качестве катализатора).При нагревании с гидроксидом натрия (NaOH) в водном растворе ацетилсалициловая кислота гидролизуется до салицилата натрия и ацетата натрия. При закислении среды салициловая кислота выпадает в осадок и может быть идентифицирована по температуре плавления (156-1600С). Другим методом идентификации салициловой кислоты, образующейся при гидролизе, является окрашивание её раствора в тёмно-фиолетовый цвет при добавлении хлорида железа (FeCl3). Уксусная кислота, присутствующая в фильтрате, превращается при нагревании с этанолом и серной кислотой в этоксиэтанол, который можно легко распознать по его характерному запаху. Кроме того, ацетилсалициловая кислота может быть идентифицирована при помощи различных хроматографических методов. Ацетилсалициловая кислота кристаллизуется с образованием бесцветных моноклинных многогранников или игл, немного кислых на вкус. Они стабильны в сухом воздухе, однако во влажной среде постепенно гидролизуются до салициловой кислоты и уксусной кислоты (Leeson и Mattocks, 1958; Stempel,1961). Чистое вещество представляет собой белый кристаллический порошок, почти не обладающий запахом. Запах уксусной кислоты свидетельствует о том, что вещество начало гидролизоваться. Ацетилсалициловая кислота подвергается эстерификации под действием щелочных гидроксидов, щелочных бикарбонатов, а также в кипящей воде.Ацетилсалициловая кислота оказывает противовоспалительное, жаропонижающее, а также болеутоляющее действие, и ее широко применяют при лихорадочных состояниях, головной боли, невралгиях и др. и в качестве противоревматического средства.Уксусная кислота используется в и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров), в производстве негорючих пленок, парфюмерных продуктов, растворителей, при синтезе красителей, лекарственных веществ, например, аспирина. Соли уксусной кислоты используют для борьбы с вредителями растений.
1.3 Основные способы получения уксусной кислоты
1.3.1 Получение уксусной кислоты окислением ацетальдегида
Процесс получения уксусной кислоты окислением ацетальдегида разработан фирмой Shawinigan (США). Окисление проводится кислородом в колоннах, футерованных алюминием, при 50—70°С и давлении до 0,7 МПа. В качестве растворителя используется уксусная кислота или ее водный раствор. Повышенное давление способствует поддержанию необходимой концентрации альдегида в жидкой фазе н увеличению надежности работы конденсационной системы. В качестве катализатора используется ацетат марганца. Окислительная колонна в нижней части снабжена перфорированной перегородкой для равномерного распределения кислорода по ее сечению. Процесс окисления протекает через стадию образования надуксусной кислоты, и катализатор играет активную роль в предотвращении ее накопления в значительных количествах.
Основными побочными продуктами окисления ацетальдегида являются ме-тилацетат, формальдегид, муравьиная кислота, ацетон, диацетил, этилиденди-ацетат. Это требует тщательной очистки товарного продукта от примесей.
В случае окисления ацетальдегида с использованием сложных катализаторов Со—Сu, Мn—Сu и в присутствии водоотводящих агентов (диизопропиловый эфир, этилацетат и т. д.) одновременно с уксусной кислотой образуется уксусный ангидрид.
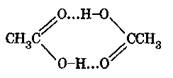
Окисление ацетальдегида молекулярным кислородом представляет гомогенную каталитическую реакцию, протекающую в жидкой фазе и выражаемую общим уравнением:
Реакция протекает по цепному механизму через стадию образования надуксусной кислоты (НУК):
Которая, являясь сильным окислителем, окисляет ацетальдегид до уксусного ангидрида:
Источник