- Урок №47. Нахождение металлов в природе и общие способы их получения
- Урок по теме: «Нахождение металлов в природе и общие способы их получения»
- Получение металлов. Нахождение их в природе
- Урок 9. Химия 9 класс ФГОС
- В данный момент вы не можете посмотреть или раздать видеоурок ученикам
- Получите невероятные возможности
- Конспект урока «Получение металлов. Нахождение их в природе»
Урок №47. Нахождение металлов в природе и общие способы их получения
Нахождение металлов в природе
Самый распространённый в земной коре металл – алюминий. Металлы встречаются как в соединениях, так и в свободном виде.
1. Активные – в виде солей (сульфаты, нитраты, хлориды, карбонаты)
2. Средней активности – в виде оксидов, сульфидов (Fe 3 O 4 , FeS 2 )
3. Благородные – в свободном виде (Au, Pt, Ag)
Получение металлов
1. Восстановление металлов из оксидов углем или угарным газом
Mе x O y + C = CO 2 + Me
Mе x O y + CO = CO 2 + Me
2. Обжиг сульфидов с последующим восстановлением
Mе x O y + C = CO 2 + Me
Mе x O y + CO = CO 2 + Me
3. Алюминотермия (восстановление более активным металлом)
Mе x O y + Al = Al 2 O 3 + Me
4. Водородотермия – для получения металлов особой чистоты
Mе x O y + H 2 = H 2 O + Me
5. Восстановление металлов электрическим током (электролиз)
1) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей (хлоридов):
2NaCl = расплав, электр. ток = 2 Na + Cl 2 ↑
CaCl 2 = расплав, электр. ток = Ca + Cl 2 ↑
4NaOH = расплав, электр. ток = 4Na + O 2 ↑ + 2H 2 O
2) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na 3 AlF 6 (из бокситов):
2Al 2 O 3 = расплав в криолите, электр. ток = 4Al + 3 O 2 ↑
3) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO 4 +2H 2 O = раствор, электр. ток = 2Cu + O 2 + 2H 2 SO 4
Источник
Урок по теме: «Нахождение металлов в природе и общие способы их получения»
« Нахождение металлов в природе и общие способы их получения»
Цели урока: создать условия учащимся для формировния представлений о металлургии, способах получения металлов разной степени активности из минералов, горных пород и руд, ознакомить учащихся с природными соединениями металлов; развивать умение составления уравнений химических реакций.
— образовательные: ; уметь устанавливать причинно-следственные связи смежду «составом», «химическими свойствами» и «получением металла»;
— развивающие: развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли; развитие логического мышления, внимания и умения работать в проблемной ситуации;
— воспитательные: формирование у учащихся познавательного интереса к химии; воспитание таких качеств характера, как настойчивость в достижении цели, интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
— научатся : составлять уравнения реакций, лежащих в основе получения металлов;
— получат возможность научиться: приводить примеры уравнений реакций, лежащих в основе промышленных способов получения чугуна и стали.
— регулятивные: у читывают правило в планировании и контроле способа действия;
— познавательные: используют поиск необходимой информации для выполнения учебных заданий с использованием учебной литературы;
— коммуникативные: учитывают разные мнения и стремятся к координации различных позиций в сотрудничестве.
Личностные: появляется гордость за российскую науку
Термины: металлургия, руды, минералы, гидрометаллургия, пирометаллургия, электрометаллургия.
Оборудование: таблицы «Руды металлов», коллекция «Минералы и горные породы».
Тип урока: урок формирования новых знаний.
1. Организационный момент ( мотивация учащихся к активной познавательной деятельности). Учитель Приветствует учащихся, отмечает отсутствующих.
2. Актуализация знаний .Проверка домашнего задания. Учитель просит учащихся собрать рабочие тетради для проверки домашнего задания за это время раздает им карточки с заданиями на 15-20 минут.
Проверочная работа: «Общие химические свойства металлов»
Учитель по истечению времени самостоятельной работы просит ребят собрать листочки и поставить их на его стол. Далее раздает им рабочие тетради и приступает к объяснению материала.
3. Объяснение материала ( формирование научного типа мышления, владения химической терминологией ). Учитель сообщает тему и цели урока. Учащиеся записывают тему урока в тетрадях.
Учитель: Как вы думаете, ребята, в каком виде встречаются металлы в природе?
Учащиеся: Металлы встречаются в природе в самородном и связанном виде.
Учитель: Оказывается, о нахождении металла в природе можно судить в зависимости от его расположения в ряду напряжений.
Для наглядности и легкого запоминания учитель предлагает схему «Металлы в природе»
Схема 2. Металлы в природе
Учитель: Обращает внимание учащихся на схему «Металлы в природе» и подводит итог: большинство металлов в природе существует в связанном состоянии, т.е. в виде различных природных соединений. Химические природные соединения металлов называют минералами. Минералы в основном встречаются в виде оксидов либо в виде сульфидов.

Схема 3. Минералы железаСхема 4. Сульфидные минералы
Минералы входят в состав горных пород и руд.
Природные образования, содержащие минералы металлов, пригодные для промышленного получения из них металлов, называют рудами. Наука о получении металлов из руд называется металлургией. В зависимости от способа извлечения металла из руды выделяют следующие виды металлургических процессов:
1.Пирометаллургия – это метод извлечения металлов из руд под действием высоких температур.
Сульфидные руды подвергают обжигу:
2 CuS + 3 O 2 → 2 CuO + 2 SO 2
Оксидные руды и оксиды восстанавливают водородом, углем, угарным газом, более активными металлами – алюминием (алюминотермия), магнием (магнийтермия).
2.Гидрометаллургия – это метод получения металлов, основанный на химических реакциях, происходящих в растворах. Гидрометаллургия включает 2 способа:
a ). Получение из различных руд растворимых солей металла
б). Восстановление металла из раствора соли с помощью различных восстановителей ( H 2 , C , CO , Me )
3.Электрометаллургия – это метод получения металлов из их солей, и оксидов под действием электрического тока.
2 NaCl (расплав) → 2 Na + Cl 2
Металлы, стоящие в ряду напряжений до алюминия включительно, можно получить электролизом только расплавов оксидов и солей. Менее активные металлы можно восстановить электрическим током из растворов солей.
4. Домашнее задание: записи в тетрадях и задания:
1). Предложите технологическую цепочку производства свинца из минерала галенита PbS . Запишите уравнения реакций.
2). Сколько килограммов меди получается из 120т обогащенной горной породы, содержащей 20% сульфида меди ( I ), если выход меди составляет 90% от теоретически возможного?
ü С какими трудностями вы столкнулись при изучении этой темы и как вы решили эту проблему?
ü Что вам было интересно на уроке?
ü Что не понравилось?
ü Что нового вы узнали для себя?
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Источник
Получение металлов. Нахождение их в природе
Урок 9. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Получение металлов. Нахождение их в природе»
Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными металлами, так и в виде соединений.
В самородном состоянии в природе встречаются золото, серебро, медь, платина и ртуть. Эти металлы обычно содержатся в небольших количествах в виде зёрен или вкраплений в горных породах. Изредка встречаются и довольно крупные куски металлов – самородки. Одним из самых больших месторождений чистого серебра был так называемый «серебряный тротуар» в Канаде. Он представлял собой глыбу почти чистого серебра длиной тридцать м, уходящую в землю на восемнадцать м. Выработка этого месторождения дала около двадцать т металла. А один из крупнейших самородков серебра весил почти сто девять кг. Самый крупный самородок меди весил четыреста двадцать т, а золота – сто двенадцать кг.
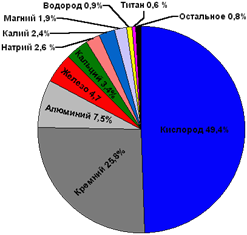
А вот распространённость химических элементов металлов в земной коре различна. К наиболее распространённым металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%), натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в земной коре может составлять тысячные доли процента и ниже.
Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
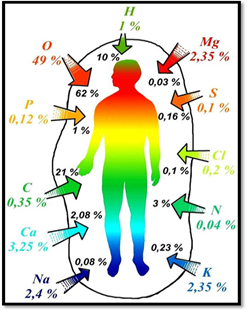
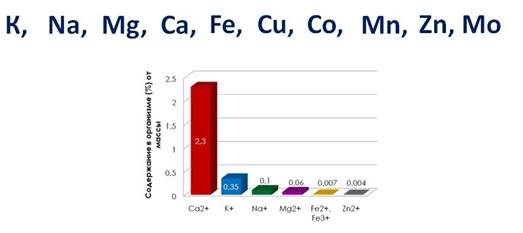
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na + , K + , Mg 2+ , Ca 2+ в организме человека приходится 99% всех ионов металлов.
В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды. Эти соединения входят в состав руд и минералов.
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
Красный железняк (гематит)
Магнитный железняк (магнетит)
Железный колчедан (пирит)
Медный колчедан (халькопирит)
Свинцовый блеск (галенит)
К наиболее известным минералам относится пирит, или железный колчедан (FeS2), киноварь (HgS), малахит ((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих металлов, то есть железа и ртути, а малахит, как поделочный камень.
А теперь представьте, что на дне водоёмов тоже есть соединения металлов, эти отложения – конкреции – представляют собой грозди, клубни или лепёшки, густо усеивающие дно. Плоские озёрные и болотные конкреции величиной с мелкую монету были известны ещё в средние века, поэтому их и называли «копеечной рудой». В настоящее время железомарганцевые конкреции, покрывающие огромные площади на дне океанов, называют полезными ископаемыми XXI века. Это богатейший источник не только железа и марганца, но и кобальта, никеля, меди и молибдена.
Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
Цвет красного железняка коричнево-красный, сам он прочный, плотный, если провести образцом руды по поверхности фарфоровой ступки, то он оставляет красно-коричневый след, не притягивается магнитом.
Бурый железяк имеет жёлто-коричневую окраску, сам прочный и плотный, не притягивается магнитом, оставляет на фарфоровой ступки жёлто-бурую полосу.
Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.
Здорово, получается, что минералы отличаются между собой окраской, магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике широко используют более 75 металлов и многочисленные сплавы на их основе. Поэтому большое значение придаётся промышленным способам получения металлов из руд. Обычно перед получением металлов из руды её измельчают, потом предварительно обогащают – отделяют пустую породу, примеси. В результате образуется концентрат, служащий сырьём для металлургического производства. Затем обогащённую руду превращают в оксид и только после этого восстанавливают металл.
Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.
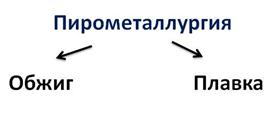
Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.
При обжиге сульфиды переводят в оксиды, а сера удаляется в виде оксида серы (IV). А затем из оксида восстанавливают металл. Полученный металл или сплав подвергают механической обработке, придают ему соответствующую форму. В процессе выделения металлов (плавке) из оксидов в качестве восстановителей используют углерод, оксид углерода (II), водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
В промышленных масштабах для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).
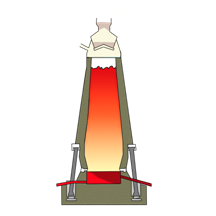
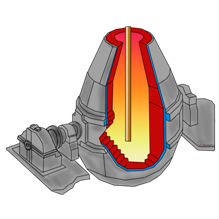
Сейчас мы посмотрим, как получают чугун и сталь. Восстановление железа проводят в специальных вертикальных печах, называемых доменными, высотой до нескольких десятков метров и внутренним объёмом до 5000 м 3 . Они имеют стальной корпус, а изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь – аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё – шихта, представляющая собой смесь железной руды, кокса (переработанного угля), известняка и других добавок, а снизу вдувается подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает в горячем воздухе, образуя углекислый газ.
Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
с образованием оксида углерода (II).
В результате реакций СО с оксидом железа (III) образуется железо.
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.
Для получения некоторых металлов в качестве восстановителя используют водород.
В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:
Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.
Этот метод получения металлов был предложен русским учёным
Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.
Большое значение имеет микробиологический метод получения металлов. В этом методе используется жизнедеятельность некоторых бактерий. Так, тионовые бактерии способны переводить нерастворимые сульфиды в растворимые сульфаты. Бактериальный метод применяют для извлечения меди из её сульфидных руд. А затем полученный раствор сульфата меди (II) подаётся на гидрометаллургическую переработку. Кроме этого, учёные обнаружили, что некоторые микроводоросли и бактерии накапливают на своей поверхности отдельные металлы (например, золото) или их оксиды. Микроорганизм постепенно обрастает «шубой» из минеральных частиц, увеличивается в размерах в десятки раз, что позволяет легко выделить частицы из раствора.
При промышленном производстве металлов большое значение имеют вопросы охраны окружающей среды от загрязнений отходами производства. Охрана окружающей среды предусматривает, прежде всего, дезактивацию выбросов, например отходящих газов при выплавке чугуна. Здесь главную опасность представляет образующийся при переработке сернистых руд оксид серы (IV), который, попадая в атмосферу, может вызывать «кислотные дожди». Наряду с комплексным использованием сырья, строительством очистных сооружений, устройством замкнутых циклов водопользования с целью охраны окружающей среды необходимы вывод промышленных предприятий за городскую черту, создание лесозащитных вокруг городов и промышленных центров.
Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
Источник