- Микроскопические методы исследования
- Микроскопические методы исследования способы изучения различных объектов с помощью микроскопа
- Глава 2. Микроскоп и микроскопические методы исследования — М. Я. Корн
- Фазово-контрастная микроскопия
- Темнопольная микроскопия
- Люминесцентная (флюоресцентная) микроскопия
- Электронная микроскопия
- Контрольные вопросы
Микроскопические методы исследования
Микроскопические методы исследования — способы изучения различных объектов с помощью микроскопа. В биологии и медицине этими методами изучают строение микроскопических объектов, размеры которых лежат за пределами разрешающей способности глаза человека. Основу микроскопических методов исследования составляют СМ и ЭМ. СМ имеет несколько разновидностей, каждая из которых использует различные свойства света: фазово-контрастная, интерференционная, люминесцентная, поляризационная, стереоскопическая, ультрафиолетовая, инфракрасная. В ЭМ изображение объектов исследования возникает в результате направленного потока электронов.
Световая микроскопия
СМ основывается на таких определяющих факторах, как разрешающая способность микроскопа, направленность светового луча, а также особенности изучаемого объекта, который может быть прозрачным и непрозрачным. В зависимости от свойств объекта изменяются физические свойства света — его цвет и яркость, связанные с длиной и амплитудой волны, фаза, плоскость и направление распространения волны. Для СМ биологические объекты обычно окрашивают для выявления тех или иных их свойств. При этом ткани должны быть фиксированы, так как окраска выявляет определённые структуры только погибших клеток. В живой клетке краситель обособляется в цитоплазме в виде вакуоли и не прокрашивает клеточные структуры. Тем не менее в СМ можно изучать и живые биологические объекты (витальная микроскопия). В этом случае применяют тёмнопольный конденсор.
Фазово-контрастная микроскопияприменяется для исследования живых и неокрашенных биологических объектов. Она основана на дифракции луча света в зависимости от особенностей объекта изучения, от которых зависит изменение длины и фазы световой волны. В патологии фазово-контрастная микроскопия находит применение при исследовании простейших, клеток растений и животных, при подсчёте и дифференцировке клеток костного мозга и периферической крови, при изучении клеток культуры тканей и др.
Поляризационная микроскопияпозволяет изучать биологические объекты в свете, образованном двумя лучами, поляризованными во взаимно перпендикулярных плоскостях, т.е. в поляризованном свете. Этого достигают с помощью плёнчатых поляроидов или призм Николя, которые помещают в микроскопе между источником света и препаратом. Поляризация меняется при прохождении (или отражении) лучей света через различные и оптически разнородные структуры. В так называемых изотропных структурах скорость распространения поляризованного света не зависит от плоскости поляризации, а в анизотропных структурах скорость его распространения меняется в зависимости от направления света по продольной или поперечной оси объекта. Если показатель преломления света вдоль структуры больше, чем в поперечном направлении, возникает положительное двойное лучепреломление, при обратных взаимоотношениях — отрицательное двойное лучепреломление. Многие биологические объекты имеют строгую молекулярную ориентацию, являются анизотропными и обладают положительным двойным лучепреломлением. Такими свойствами обладают миофибриллы, реснички мерцательного эпителия, коллагеновые волокна и др. Сопоставление характера лучепреломления поляризованного света и величины анизотропии объекта позволяет судить о молекулярной организации его структуры. Поляризационная микроскопия является одним из гистологических, а также цитологических методов исследования, способом микробиологической диагностики и др. Важно, что в поляризованном свете можно исследовать как окрашенные, так и неокрашенные и нефиксированные (нативные) срезы тканей.
Люминесцентная микроскопияоснована на свойстве многих веществ давать свечение — люминесценцию в УФ-лучах или в сине-фиолетовой части спектра света. Ряд биологических веществ, таких как простые белки, коферменты, некоторые витамины, лекарственные средства (ЛС) обладают собственной (первичной) люминесценцией. Другие вещества начинают светиться при добавлении к ним специальных красителей — флюорохромов (вторичная люминесценция). Флюорохромы могут распределяться в клетке диффузно, но могут избирательно окрашивать отдельные клеточные структуры или определённые химические соединения. На этом основано использование люминесцентной микроскопии в цитологических и гистохимических исследованиях. Иммунофлюоресценция в люминесцентном микроскопе позволяет выявлять различные Аг и их концентрацию в клетках, при этом возможна идентификация вирусов, определение AT и иммунных комплексов, гормонов, различных продуктов метаболизма и др.Люминесцентную микроскопию применяют для диагностики вирусных инфекций, с помощью вторичной люминесценции диагностируют злокачественные опухоли в гистологических и цитологических препаратах, определяют очаги ишемии мышцы сердца при ранних сроках инфаркта миокарда, выявляют амилоид в биоптатах тканей и т. д.
Ультрафиолетовая и инфракрасная микроскопияоснована на способности поглощения УФ- и инфракрасных лучей определённых длин волн некоторыми веществами, входящими в состав живых клеток, микроорганизмов или фиксированных, но не окрашенных тканей, прозрачных в видимом свете. Свойством поглощать УФ-лучи обладают высокомолекулярные соединения, такие как нуклеиновые кислоты, белки, ароматические аминокислоты (тирозин, триптофан, метилаланин), пуриновые и пиримидиновые основания и др. С помощью УФ-микроскопии изучают локализацию и количество таких веществ, а при исследовании живых объектов — их изменения в процессе жизнедеятельности. Инфракрасная микроскопия применяется в медицине преимущественно в нейроморфологии и офтальмологии.
Для специальных целей в патологии используются и другие микроскопические методы — интерференционная, стереоскопическая микроскопия и др.
Электронная микроскопия
ЭМ применяют для изучения структуры клеток, микроорганизмов и вирусов на субклеточном и макромолекулярном уровнях. Значительную разрешающую способность ЭМ обеспечивает поток электронов, проходящих в вакууме через электромагнитные поля, создаваемые электромагнитными линзами. При трансмиссионной ЭМ электроны проходят через структуры исследуемого объекта, а при сканирующей ЭМ они отражаются от этих структур, отклоняясь под разными углами. В результате возникает изображение на люминесцирующем экране микроскопа. При трансмиссионной (просвечивающей) ЭМ получают плоскостное изображение внутриклеточных структур, при сканирующей — объёмное. Весьма полезно сочетание ЭМ с другими методами — авторадиографией, гистохимическими, иммунологическими методами. Возникает возможность наблюдать течение биохимических и иммунологических процессов в клетке в сочетании с изменениями внутриклеточных структур. ЭМ требует специальной химической или физической фиксации тканей. Для исследования берут в основном биопсийный материал. Может быть использован и секционный материал, но в максимально короткие сроки после смерти, обычно исчисляемые минутами. После фиксации ткани обезвоживают, заливают в эпоксидные смолы, режут стеклянными или алмазными ножами на ультратомах. При этом получают ультратонкие срезы тканей толщиной 30—50 нм. Их контрастируют, переносят на специальные металлические сетки и затем изучают в ЭМ.
При ультратомировании препарата можно получить так называемые полутонкие срезы толщиной 1,5 мкм, которые после окраски метиленовым синим исследуют в СМ. Это позволяет получить представление о состоянии той ткани, клетки которой будут затем изучены в ЭМ. Метод может иметь и самостоятельное значение.
В сканирующем (растровом) ЭМ исследуют поверхность биологических и небиологических объектов, напыляя в вакуумной камере на их поверхность электроноплотные вещества и изучая эти реплики, повторяющие контуры объекта исследования.
Методы окрашивания
Микроскопические методы используют в медицине в сочетании с гистологическими методами исследования клеток и тканей. Для этого, как правило, фиксированные тканевые срезы должны быть окрашены с целью выявления различных клеточных структур. Последние воспринимают красители в зависимости от их физико-химических свойств. Поэтому красители подразделяют на основные, кислые и нейтральные.
Основные, или базофильные, красители являются красящими основаниями или их солями (гематоксилин, метиленовый синий, толуидиновый синий и др.). В цветовой гамме этих красителей преобладают оттенки синего цвета. Интенсивность окраски (базофилия) зависит от числа кислотных групп в структурах клетки, способных взаимодействовать с основными красителями. Кислые, или ацидофильные, красители — красящие кислоты или их соли, окрашивающие клеточные структуры в различные оттенки красного (эозин, эритрозин, Конго красный, оранж и др.). Нейтральные, красители содержат и базофильные, и ацидофильные вещества (например, смесь Романовского—Гимзы). Такие красители могут обладать способностью растворяться в определённых веществах, окрашивая их (судан III, шарлах и др.). Нередко для контрастирования структур клеток или тканей используют методы, основанные на способности этих тканей удерживать или восстанавливать соли тяжёлых металлов (серебра, золота, осмия, свинца и др.). Эти методы контрастирования называются импрегнацией, они используются как в СМ, так и в ЭМ.
С помощью различных красителей в повседневной и научной практике применяют обзорные окраски для составления общего представления о состоянии исследуемой ткани (гематоксилин и эозин, азур-фукселин и др.), а также специальные окраски для выявления особенностей процессов, протекающих в тканях и клетках. Так, используют окраску Суданом III для выявления жировой дистрофии клеток, Конго красным — для определения отложений амилоида, импрегнацию серебром — для исследования нервной ткани и т.п. Живые и неокрашенные объекты исследуют с помощью специальных микроскопических методов, описанных выше.
Гистохимические методы
Гистохимические и гистоферментохимические методы позволяют проследить и оценить обмен веществ в тканях и клетках в норме и вусловиях патологии; избирательно оценить метаболизм белков, липидов, углеводов и других метаболитов, локализацию и активность ферментов и гормонов, проанализировать особенности окислительно-восстановительных процессов, протекающих в клетках и тканях в условиях патологии, при приспособлении и компенсации. Диапазон применения гистохимических методов в патологии необычайно широк. Для гистохимических исследований используют срезы свежезамороженных тканей, приготовленные в криостате, что позволяет сохранить прижизненную локализацию того или иного химического соединения. Гистохимические методы часто сочетают с другими методами СМ и ЭМ. Для количественной оценки результатов гистохимических реакций применяют гистофотометрию, цитофотометрию, микрофлюорометрию и др.
Источник
Микроскопические методы исследования способы изучения различных объектов с помощью микроскопа
Глава 2. Микроскоп и микроскопические методы исследования — М. Я. Корн
Для обнаружения и исследования микроорганизмов применяют микроскопы. Световые микроскопы предназначены для изучения микроорганизмов, которые имеют размеры не менее 0,2 мкм (бактерии, простейшие и т. п.), а электронные — для изучения более мелких микроорганизмов (вирусы).
Различают простые и сложные световые микроскопы. Оптика простых микроскопов представлена одной линзой с большим увеличением. В сложных микроскопах оптическая система состоит из объектива для получения увеличенного изображения объекта и окуляра для дальнейшего увеличения полученного изображения и его рассматривания.
Современные световые микроскопы, позволяющие не только увидеть микроорганизмы, но и изучить их структуру, это сложные оптические приборы, обращение с которыми требует определенных знаний, навыков и большой аккуратности.
Биологические световые микроскопы, в зависимости от области применения, сложности устройства и комплектации различной оптикой, подразделяются на рабочие, лабораторные и исследовательские. Сейчас наша промышленность выпускает серию микроскопов «Биолам». Микроскопы этой серии имеют обозначения, указывающие, к какой группе они относятся (Р — рабочие, Л — лабораторные, И — исследовательские), комплектация обозначается цифрой, например рабочие от Р11 до Р17 (рис. 1).
Рис. 1. Микроскопы рабочие серии ‘Биолам’. а — ‘Биолам P16’; б — ‘Биолам Р11’
В микроскопе различают механическую и оптическую части.
К механической части относится штатив (состоящий из основания и тубусодержателя) и укрепленные на нем тубус с револьвером для крепления и смены объективов, предметный столик для препарата, приспособления для крепления конденсора и светофильтров, встроенные в штатив механизмы для грубого (макромеханизм, макровинт) и тонкого (микромеханизм, микровинт) перемещения предметного столика или тубусодержателя.
Оптическая часть микроскопа представлена объективами, окулярами и осветительной системой, которая в свою очередь состоит из расположенных под предметным столиком конденсора Аббе, зеркала, имеющего плоскую и вогнутую сторону, а также отдельного или встроенного осветителя с низковольтной лампой накаливания и трансформатором. Объективы ввинчиваются в револьвер, а соответствующий окуляр, через который наблюдают изображение, устанавливают с противоположной стороны тубуса.
Различают монокулярный (имеющий один окуляр) и бинокулярный (имеющий два одинаковых окуляра и дающий возможность наблюдения двумя глазами) тубусы. Кроме того, тубус микроскоп может быть прямой вертикальный (в основном для фотографирования) и наклонный.
Основную роль в получении четкого изображения играет объектив. Он строит увеличенное, действительное и перевернутое изображение объекта. Затем это изображение дополнительно увеличивается при рассматривании его через окуляр, который аналогично обычной лупе дает увеличенное мнимое изображение.
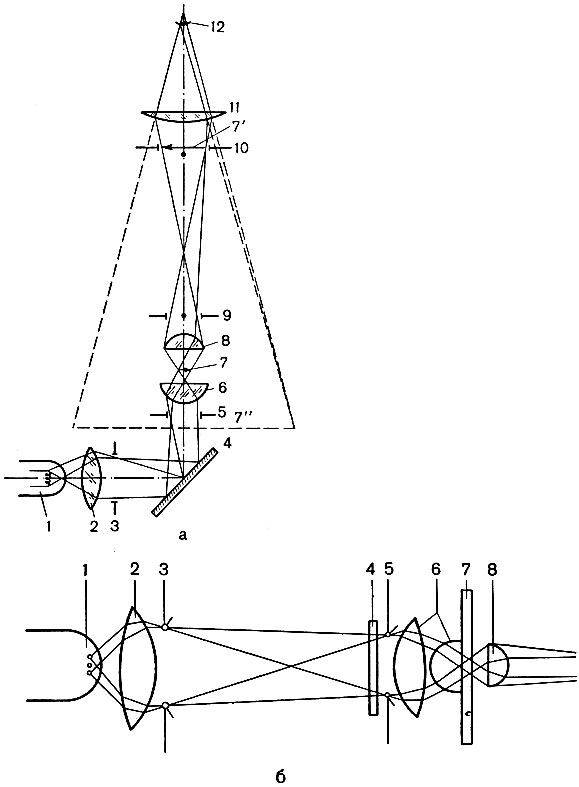
На рис. 2 показана схема хода лучей в микроскопе.
Рис. 2. Схема хода лучей в микроскопе с настройкой освещения по Кёлеру. а — принципиальная схема микроскопа и осветительной системы: 1 — источник света; 2 — коллектор; 3 — полевая диафрагма осветителя; 4 — зеркало; 5 — апертурная диафрагма конденсора; 6 — конденсор; 7 — препарат; 7′ — увеличенное действительное промежуточное изображение, образуемое объективом; 7″ — увеличенное мнимое окончательное изображение, наблюдаемое в окуляр; 8 — объектив; 9 — выходной зрачок объектива; 10 — полевая диафрагма окуляра; 11 — окуляр; 12 — глаз; б — принцип освещения по Кёлеру: 1 — источник света; 2 — коллектор; 3 — полевая диафрагма; 4 — светофильтр; 5 — апертурная диафрагма; 6 — конденсор; 7 — объект; 8 — объектив
Увеличение микроскопа можно определить, умножая увеличение объектива на увеличение окуляра (обычно увеличение объектива и окуляра указано на оправе: объектива до 100×, окуляра — 4×, 5×, 7×, 10×, 12,5×, 15× и 20×).
Однако увеличение не определяет качества изображения. Качество изображения, его четкость определяется разрешающей способностью микроскопа, т. е. возможностью различать раздельно две близко расположенные точки. Предел разрешения — минимальное расстояние, на котором эти точки еще видны раздельно, — зависит от длины волны света, которым освещается объект, и числовой апертуры объектива. Числовая апертура в свою очередь зависит от угловой апертуры объектива и показателя преломления среды, находящейся между фронтальной линзой объектива и препаратом. Угловая апертура — это максимальный угол, под которым могут попадать в объектив лучи, прошедшие через объект. Чем больше апертура и чем ближе показатель преломления среды, находящейся между объективом и препаратом, к показателю преломления стекла, тем выше разрешающая способность объектива.
Различают полезное и бесполезное увеличение. Полезное увеличение обычно равно числовой апертуре объектива, увеличенной в 500-1000 раз. Более высокое окулярное увеличение не выявляет новых деталей и является бесполезным.
В зависимости от среды, которая находится между объективом и препаратом, различают «сухие» объективы малого и среднего увеличения (до 40×) и иммерсионные с максимальной апертурой и увеличением (90-100×).
Особенностью иммерсионных объективов является то, что между фронтальной линзой такого объектива и препаратом помещают иммерсионную жидкость, имеющую показатель преломления такой же, как стекло (или близкий к нему), что обеспечивает увеличение числовой апертуры и разрешающей способности объектива.
В качестве иммерсионной жидкости для объективов водной иммерсии используют дистиллированную воду, а для объективов масляной иммерсии — кедровое масло или специальное синтетическое иммерсионное масло. Недостатком кедрового масла является его быстрое загустевание. Для объективов, работающих в ультрафиолетовой области спектра, в качестве иммерсионной жидкости используют глицерин. Изображение, полученное с помощью линз, обладает различными недостатками: сферической и хроматической аберрациями, кривизной поля изображения и др. В объективах, состоящих из нескольких линз, эти недостатки в той или иной мере исправлены. В зависимости от степени исправления этих недостатков различают объективы ахроматы и более сложные апохроматы. Соответственно объективы, в которых исправлена кривизна поля изображения, называются планахроматами и план апохроматам и. Использование этих объективов позволяет получить резкое изображение по всему полю, тогда как изображение, полученное с помощью обычных объективов, не имеет одинаковой резкости в центре и на краях поля зрения. Все характеристики объектива обычно выгравированы на его оправе: собственное увеличение, апертура, тип объектива (АПО — апохромат и т. п.); объективы водной иммерсии имеют обозначение ВИ и белое кольцо вокруг оправы в нижней ее части, объективы масляной иммерсии — обозначение МИ и черное кольцо.
Все объективы рассчитаны для работы с покровным стеклом толщиной 0,17 мм. Толщина покровного стекла особенно влияет на качество изображения при работе с сильными сухими системами (40×). При работе с иммерсионными объективами нельзя пользоваться покровными стеклами толще 0,17 мм потому, что толщина покровного стекла может оказаться больше, чем рабочее расстояние объектива, и в этом случае, при попытке сфокусировать объектив на препарат, может быть повреждена фронтальная линза объектива.
Окуляры состоят из двух линз и тоже бывают нескольких типов, каждый из которых применяется с определенным типом объектива, дополнительно устраняя недостатки изображения. Тип окуляра и его увеличение обозначены на его оправе.
Конденсор предназначен для того, чтобы сфокусировать на препарате свет от осветителя. Он состоит из нескольких линз, превращающих параллельные лучи от осветителя в сходящиеся. Одной из деталей конденсора является апертурная диафрагма, которая имеет важное значение для правильного освещения препарата. Осветитель состоит из низковольтной лампы накаливания с толстой нитью, накал которой можно регулировать, коллекторной линзы и полевой диафрагмы (от раскрытия которой зависит диаметр освещенного поля на препарате). Зеркало направляет свет от осветителя в конденсор. Для того чтобы сохранить параллельность лучей, идущих от осветителя в конденсор, необходимо использовать только плоскую сторону зеркала. Качество изображения в значительной мере зависит также от правильного освещения.
Настройка освещения и фокусировка микроскопа. Существует несколько различных способов освещения препарата при микроскопии. Наиболее распространенным является способ установки света по Кёлеру, который заключается в следующем:
1) устанавливают осветитель против зеркала микроскопа;
2) включают лампу осветителя и направляют свет на плоское (!) зеркало микроскопа;
3) помещают препарат на предметный столик микроскопа;
4) закрывают зеркало микроскопа листком белой бумаги и фокусируют на нем изображение нити лампы;
5) убирают лист бумаги с зеркала;
6) закрывают апертурную диафрагму конденсора. Перемещая зеркало и слегка передвигая патрон лампы, фокусируют изображение нити на апертурной диафрагме.
Внимание! Расстояние осветителя от микроскопа должно быть таким, чтобы изображение нити лампы было равно диаметру апертурной диафрагмы конденсора.
7) открывают апертурную диафрагму конденсора, прикрывают полевую диафрагму осветителя и значительно уменьшают накал лампы;
8) при малом увеличении (10×), глядя в окуляр, получают резкое изображение препарата;
9) слегка поворачивая зеркало, переводят изображение полевой диафрагмы, которое имеет вид светлого пятна, в центр поля зрения. Опуская и поднимая конденсор, добиваются получения резкого изображения краев полевой диафрагмы (вокруг них может быть видна цветная каемка);
10) раскрывают полевую диафрагму осветителя до краев поля зрения, увеличивают накал нити лампы и слегка (на 1 /3) уменьшают раскрытие апертурной диафрагмы конденсора;
11) при смене объектива необходимо проверить настройку света.
Внимание! После окончания настройки света по Кёлеру ни в коем случае нельзя изменять положение конденсора, раскрытие полевой и апертурной диафрагмы.
Освещенность препарата можно регулировать только нейтральными светофильтрами или изменением накала лампы с помощью реостата.
Для правильного освещения препарата при работе с объективами малого увеличения (до 10×) необходимо отвинтить и снять верхнюю линзу конденсора.
Внимание! При работе с объективами, дающими большое увеличение — с сильными сухими (40×) и иммерсионными (90×) системами, чтобы не повредить фронтальную линзу, при фокусировке пользуются следующим приемом: наблюдая сбоку, опускают объектив макровинтом почти до соприкосновения с препаратом, затем, глядя в окуляр, макровинтом очень медленно поднимают объектив до появления изображения и с помощью микровинта производят окончательную фокусировку микроскопа.
Уход за микроскопом. Микроскоп — точный оптический прибор, требующий бережного обращения с ним. При работе с микроскопом нельзя применять большие усилия. Ни в коем случае нельзя касаться пальцами поверхности линз, зеркал и светофильтров.
Чтобы предохранить внутренние поверхности объективов, а также призмы тубуса от попадания пыли, необходимо всегда оставлять окуляр в тубусе.
При чистке внешних поверхностей линз нужно удалить с них пыль мягкой (беличьей) кисточкой, промытой в эфире. Если необходимо, осторожно протирают поверхности линз хорошо выстиранной, не содержащей остатков мыла, полотняной или батистовой тряпочкой, слегка смоченной чистым бензином, эфиром или специальной смесью для чистки оптики. Не рекомендуется протирать оптику объективов ксилолом, так как это может привести к их расклеиванию.
С зеркал, имеющих наружное серебрение, можно только удалять пыль, сдувая ее резиновой грушей. Протирать их нельзя.
Нельзя также самостоятельно развинчивать и разбирать объективы — это неизбежно приведет к их порче.
По окончании работы на микроскопе необходимо прежде всего тщательно удалить остатки иммерсионного масла с фронтальной линзы объектива указанным выше способом. Затем опустить предметный столик (или конденсор в микроскопах с неподвижным столиком) и накрыть микроскоп чехлом.
Для сохранения внешнего вида микроскопа необходимо периодически протирать его мягкой тряпкой, слегка пропитанной бескислотным вазелином и затем сухой мягкой чистой тряпкой.
Фазово-контрастная микроскопия
Световые волны характеризуются длиной волны, амплитудой и фазой. Глаз человека способен различать длину волны (цвет) и амплитуду (интенсивность, яркость света), но не может обнаружить различия в фазе.
При микроскопии окрашенных объектов наблюдается изменение амплитуды (уменьшение яркости света) и избирательное поглощение света определенной длины волны (изменение цвета).
При наблюдении неокрашенных микроорганизмов, отличающихся от окружающей среды только по показателю преломления, изменения интенсивности не происходит, а изменяется только фаза прошедших световых волн. Поэтому глаз изменений заметить не может и эти объекты выглядят малоконтрастными, прозрачными.
Для наблюдения таких объектов используют фазово-контрастную микроскопию, основанную на превращении фазовых изменений, вносимых объектом, в амплитудные, различимые глазом.
Фазово-контрастное устройство может быть установлено на любом биологическом микроскопе и состоит из: 1) набора объективов со специальными фазовыми пластинками; 2) конденсора с поворачивающимся диском. В нем установлены кольцевые диафрагмы, соответствующие фазовым пластинкам в каждом из объективов; 3) вспомогательного микроскопа.
Настройка фазового контраста в основном заключается в следующем:
1) заменяют объективы и конденсор микроскопа на фазово-контрастные;
2) устанавливают объектив малого увеличения и отверстие в диске конденсора без кольцевой диафрагмы (обозначенное цифрой «0»);
3) настраивают свет по Кёлеру;
4) выбирают фазовый объектив соответствующего увеличения и фокусируют его на препарат;
5) поворачивают диск конденсора и устанавливают соответствующую объективу кольцевую диафрагму;
6) вынимают из тубуса окуляр и вставляют на его место вспомогательный микроскоп. Настраивают его так, чтобы были резко видны фазовая пластинка (в виде темного кольца) и кольцевая диафрагма (в виде светлого кольца того же диаметра). С помощью регулировочных винтов на конденсоре точно совмещают эти кольца. Вынимают вспомогательный микроскоп и вновь устанавливают окуляр.
Благодаря применению этого способа микроскопии контраст живых неокрашенных микроорганизмов резко увеличивается и они выглядят темными на светлом фоне (позитивный фазовый контраст) или светлыми на темном фоне (негативный фазовый контраст). Наша промышленность выпускает устройство КФ-4 для позитивного фазового контраста.
Фазово-контрастная микроскопия широко применяется также для изучения клеток культуры ткани, наблюдения действия различных вирусов на клетки и т. п. В этих случаях часто применяют биологические микроскопы с обратным расположением оптики — так называемые инвертированные микроскопы. У таких микроскопов объективы расположены снизу, а конденсор — сверху. Иногда они заключены в термостат для наблюдения за динамикой изменений в клетках культуры ткани и снабжены кинокамерой.
Морфология некоторых микроорганизмов не может быть изучена с помощью описанных выше способов микроскопии. К ним относятся различные спирохеты и, в частности, лептоспиры, некоторые крупные вирусы. Для наблюдения этих микроорганизмов применяют темнопольную микроскопию.
Темнопольная микроскопия
Темнопольная микроскопия основана на способности микроорганизмов сильно рассеивать свет. Для темнопольной микроскопии пользуются обычными объективами и специальными темнопольными конденсорами. Существует несколько типов таких конденсоров, различающихся по устройству.
Основная особенность темнопольных конденсоров заключается в том, что центральная часть у них затемнена и прямые лучи от осветителя в объектив микроскопа не попадают. Объект освещается косыми боковыми лучами и в объектив микроскопа попадают только лучи, рассеянные частицами, находящимися в препарате. Темнопольная микроскопия основана на эффекте Тиндаля, известным примером которого служит обнаружение пылинок в воздухе при освещении их узким лучом солнечного света.
Чтобы в объектив не попадали прямые лучи от осветителя, апертура его должна быть меньше, чем апертура конденсора. Для уменьшения апертуры в обычный объектив помещают диафрагму или пользуются специальными объективами, снабженными ирисовой диафрагмой.
При темнопольной микроскопии микроорганизмы выглядят ярко светящимися на черном фоне. При этом способе микроскопии могут быть обнаружены мельчайшие микроорганизмы, размеры которых лежат за пределами разрешающей способности микроскопа. Однако темнопольная микроскопия позволяет увидеть только контуры объекта, но не дает возможности изучить внутреннюю структуру.
Обычно с помощью темнопольной микроскопии изучают препараты типа «раздавленная капля». При этом очень строгие требования предъявляются к качеству предметных и покровных стекол и приготовлению препарата. Предметные стекла должны быть не толще 1,1-1,2 мм, покровные — 0,17 мм, без царапин и загрязнений. При приготовлении препарата следует обращать особое внимание на отсутствие пузырьков и крупных частиц (все эти дефекты будут видны ярко святящимися и не позволят наблюдать препарат).
Для темнопольной микроскопии необходимы яркие источники света, поэтому следует применять более мощные осветители и максимальный накал лампы.
Настройка темнопольного освещения в основном заключается в следующем:
1) устанавливают свет по Кёлеру; 2) заменяют светлопольный конденсор темнопольным; 3) на верхнюю линзу конденсора наносят иммерсионное масло или в крайнем случае дистиллированную воду; 4) поднимают конденсор до соприкосновения с нижней поверхностью предметного стекла; 5) объектив малого увеличения фокусируют на препарат; 6) с помощью центрировочных винтов переводят в центр поля зрения светлое пятно (иногда имеющее затемненный центральный участок); 7) поднимая и опуская конденсор, добиваются исчезновения затемненного центрального участка и получения равномерно освещенного светлого пятна. Если этого сделать не удается, то надо проверить толщину предметного стекла (обычно такое явление наблюдается при использовании слишком толстых предметных стекол — конус света фокусируется в толще стекла).
После правильной настройки света устанавливают объектив нужного увеличения и исследуют препарат.
Люминесцентная (флюоресцентная) микроскопия
Люминесцентная (флюоресцентная) микроскопия основана на способности некоторых веществ люминесцировать, т. е. светиться при освещении невидимым ультрафиолетовым или синим светом. Примером такого свечения являются известные всем лампы дневного света, в которых в результате облучения ультрафиолетовыми лучами светится специальный состав — люминофор, покрывающий изнутри колбу лампы.
Цвет люминесценции обычно смещен в более длинноволновую часть спектра по сравнению с возбуждающим ее светом. Так, если люминесценция возбуждается синим светом, то цвет ее может быть от зеленого до красного, если люминесценция возбуждается невидимым ультрафиолетовым излучением, то цвет ее может быть в любой части видимого спектра. Эта особенность люминесценции позволяет, используя специальные светофильтры, поглощающие возбуждающий свет, наблюдать сравнительно слабое люминесцентное свечение.
Устройство люминесцентного микроскопа и правила работы с ним отличаются от обычного светового микроскопа в основном следующим:
1. Наличие мощного источника света в осветителе, излучающего преимущественно в коротковолновой (ультрафиолетовой, синей) части спектра (ртутно-кварцевая лампа сверхвысокого давления). В специальных люминесцентных осветителях, которые устанавливают на обычный микроскоп, применяют кварцевые галогенные лампы (КГМ).
2. Наличие системы светофильтров: а) возбуждающие светофильтры пропускают только ту часть спектра, которая возбуждает люминесценцию;
б) теплозащитный светофильтр защищает от перегрева другие светофильтры, препарат и оптику люминесцентного микроскопа. В отечественных люминесцентных микроскопах теплозащитную функцию кроме того выполняет кювета с плоскопараллельными стеклами, заполненная дистиллированной водой. Эта кювета установлена непосредственно после коллектора.
При работе с люминесцентным микроскопом надо обращать особое внимание на то, чтобы эта кювета была полностью заполнена водой и чтобы вода была абсолютно чистой и прозрачной, поскольку при длительной работе микроскопа в воде могут размножаться микроорганизмы и она мутнеет;
в) «запирающие» светофильтры расположены между препаратом и окуляром. Эти светофильтры поглощают возбуждающее излучение и пропускают свет люминесценции от препарата к глазу наблюдателя.
В нашей стране разработан очень эффективный способ освещения препаратов для возбуждения люминесценции, который используется во всех отечественных люминесцентных микроскопах. Этот способ заключается в том, что препарат освещают светом, падающим на него через объектив. Благодаря этому освещенность увеличивается при использовании объектов, имеющих большую числовую апертуру, т. е. тех, которые используются для изучения микроорганизмов. Очень важную роль при этом способе освещения играет специальная интерференционная светоделительная пластинка, направляющая свет в объектив и представляющая собой полупрозрачное зеркало, которое избирательно отражает и направляет в объектив только ту часть спектра, которая возбуждает люминесценцию, а пропускает в окуляр только свет люминесценции.
Оптика объективов люминесцентного микроскопа изготавливается из нелюминесцирующих сортов оптического стекла и склеивается специальным нелюминесцирующим клеем. На оправе таких объективов выгравирована буква «Л». При работе с объективами масляной иммерсии при люминесцентной микроскопии пользуются специальным нелюминесцирующим иммерсионным маслом.
Правила настройки люминесцентного микроскопа подробно изложены в инструкции к микроскопу.
На рис. 3 показан люминесцентный микроскоп «Люмам», выпускаемый Ленинградским оптико-механическим объединением (ЛОМО).
Рис. 3. Микроскоп люминесцентный исследовательский серии ‘Люмам ИЗ’
Для изучения микроорганизмов в люминесцентном микроскопе их предварительно окрашивают (флюорохромируют) сильно разведенными растворами специальных люминесцирующих красителей (флюорохромов), которые избирательно связываются с определенными структурами клетки. Флюорохромы отличаются от обычных красителей тем, что применяются в очень малых концентрациях (До нескольких мкг/мл); кроме того, ими могут быть окрашены не только фиксированные, но и живые клетки. Люминесцентная микроскопия также используется для регистрации результатов реакции иммунофлюоресценции (РИФ) (см. главу 12).
Электронная микроскопия
Различные способы световой микроскопии позволяют изучать сравнительно крупные микроорганизмы (бактерии, простейшие), но не дают возможности наблюдать объекты, величина которых меньше чем 0,2 мкм, так как разрешающая способность микроскопа зависит от длины волны видимого света. Поэтому в световом микроскопе не может быть изучено строение вирусов.
Принципиально новые возможности для изучения тонкого строения бактерий и вирусов появились после изобретения электронного микроскопа.
В электронном микроскопе вместо световых волн для построения изображения используют поток электронов в глубоком вакууме.
В качестве «линз», фокусирующих электроны, служит электромагнитное поле, создаваемое электромагнитными катушками. Изображение в электронном микроскопе наблюдают на флюоресцирующем экране и фотографируют. Объекты при электронной микроскопии находятся также в глубоком вакууме, поэтому подвергаются фиксации и специальной обработке. Кроме того, они должны быть очень тонкими, так как поток электронов сильно поглощается. В связи с этим в качестве объектов используют ультратонкие срезы толщиной 20-50 нм, что значительно меньше толщины вирусных частиц. Разрешающая способность современных электронных микроскопов равна 0,15 нм, что позволяет получить полезное увеличение в миллионы раз.
Электронный микроскоп по своим размерам и сложности устройства очень отличается от светового. Колонна микроскопа, в которой находится объект и разгоняются электроны, превышает рост человека, а для размещения микроскопа нужна отдельная комната.
Контрольные вопросы
1. Из каких основных частей состоит микроскоп?
2. Как правильно настроить свет в микроскопе?
3. В чем принцип фазово-контрастной микроскопии?
4. На чем основана темнопольная микроскопия и когда ее используют?
5. На чем основана люминесцентная микроскопия?
6. Что такое электронный микроскоп и какова его разрешающая способность (увеличение)?
Источник