Лабораторные методы выявления микобактерий туберкулеза Методы обследования на МБТ
Бактериологическая диагностика включает обработку клинического материала, микроскопическое исследование, выделение микроорганизма с применением культуральных методов, идентификацию микобактерий с использованием бактериологических и биохимических гестов, а также определение лекарственной чувствительности микобактерий.
Существует несколько групп методов, используемых для выявления МБТ в различном диагностическом материале: рутинные (микроскопия, культуральное исследование), биологические (биопроба, определение вирулентности штаммов МБТ). автоматические системы (MGIT, ВАСТЕС, МВ/ВасТ, ESP Culture System и др.), молекулярной генетические методики (PCR. I.CR, NASBA, Q-Bela и др.). Каждый из этих методов обладает определенной чувствительностью и специфичностью, что необходимо учитывать при клинической интерпретации полученных результатов.
Бактериоскопическое исследование мокроты с окраской мазка по Цилю-Нильсену для выявления кислотоустойчивых микобактерий (КУБ) является наиболее быстрым, доступным и экономически эффективным из существующих методов выявления больных туберкулезом. Оно может быть осуществлено в любой клинико- диагностической лаборатории (КДЛ) лечебно-профилактических учреждений всех уровней и ведомств. Бактериоскопия мокроты представляется чрезвычайно информативной для выяснения эпидемиологической опасности пациента для окружающих, которая коррелирует с числом микобактерий в образце. Бактериоскопическое исследование, проведенное должным образом, имеет положительную прогностическую ценность для легочного туберкулеза, более 90%. Разрешающая способность данного метода составляет 50-100 тыс. микобактерий в 1 миллилитре мокроты и существенно зависит от ряда факторов: правильности сбора мокроты, подготовленности лабораторного персонала и разрешающей способности используемых микроскопов. При микроскопии мазков, приготовленных из проб, взятых в течение трех последовательных дней, результативность метода повышается на 20-30%. Однако нет необходимости использовать более 4-5 проб мокроты.
Метод окраски по Цилю-Нильсену наиболее часто используется при бакгериоскопичсском выявлении микобактерий. Он заключается в следующем: мазки мокроты окрашивают фуксином при нагревании, затем обесцвечивают солянокислым спиртом и докрашивают метиленовым синим. В результате микобактерий окрашиваются в малиновый цвет, а фон — в синий. Это специфическое окрашивание обусловлено способностью микобактерий удерживать краситель при обработке кислотой или спиртом.
В бактериологических лабораториях, выполняющих большое количество исследований (100 и более ежедневно), используется люминесцентная микроскопия. Данный метод основан на способности липидов микобактрий воспринимать люминесцентные красители (акридиновый оранжевый, аурамин, родамин и др.) и затем светиться при облучении их ультрафиолетовыми лучами. В зависимости от красителей, микобактерий туберкулеза дают четкое ярко-красное свечение на зеленом фоне или золотисто-желтое — на темно-зеленом фоне. Метод люминесцентной микроскопии обладает большей чувствительностью, чем световая микроскопия, особенно в сочетании с методом обогащения диагностического материала (микроскопия осадка), поскольку люминесцентная микроскопия позволяет обнаружить измененные микобактерий, утратившие кислотоуетойчивость. в связи с чем они не выявляются при бактериоскопии по Цилю-Нильсену. Мазки для люминесцентной микроскопии готовят из осадка, полученного после обработки диагностического материапа детергентом с последующим отмыванием либо нейтрализацией. При положительном результате бактериоскопии мазков, окрашенных флуорохромами, должна быт ь проведена подтверждающая микроскопия мазков, окрашенных по Цилю-Нильсену
Источник
Микобактерии туберкулеза способы выявления
Для диагностики туберкулёза применяют бактериоскопические, бактериологические, биологические, серологические и аллергологические методы, входящие в обязательный диагностический минимум. Материалом для исследований служат мокрота, отделяемое свищей, моча, СМЖ, испражнения.
Микроскопия возбудителя туберкулеза в патологическом материале. В мазках, окрашенных по Цилю-Нильсену, обнаруживают кислотоустойчивые палочки возбудителя туберкулеза.
Нередко материал содержит мало бактерий туберкулеза и для повышения вероятности их обнаружения используют методы обогащения: центрифугирование и флотацию. В первом случае исследуемый материал обрабатывают смесью растворов NaCl и NaOH, центрифугируют и микроскопируют осадок. Второй метод включает обработку материала смесью NaOH, дистиллированной воды и ксилола (или бензола). Образец энергично встряхивают; образующаяся пена всплывает и захватывает микобактерии. Пену отсасывают и готовят мазки.
Наиболее результативна люминесцентная микросколия возбудителя туберкулеза. Материал обрабатывают аурамин-родамином и бактерии окрашиваются в бело-жёлтый цвет. Для выявления L-форм применяют AT, меченные флюорохромами.
Выделение возбудителя туберкулеза
Достоинство метода — возможность получения чистой культуры туберкулеза, позволяющая её идентифицировать, оценить вирулентные свойства и определить чувствительность к ЛС. Материал засевают, тщательно втирая, на твёрдые питательные среды.
Для повышения эффективности выделения возбудителя туберкулеза и уничтожения контаминирующей микрофлоры применяют методы обогащения или обрабатывают материал 6-12% серной кислотой. Основной недостаток бактериологического метода — длительность получения результата (от 2 до 12 нед). В связи с этим разработаны ускоренные микрометоды выделения возбудителя туберкулеза.
Один из распространённых методов выделения возбудителя туберкулеза, метод Прайса, заключается в следующем. Материал помещают на предметное стекло, обрабатывают серной кислотой, отмывают физиологическим раствором и вносят в питательную среду, дополненную цитратной лизированной кровью.
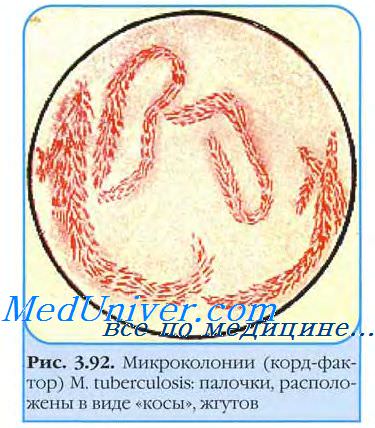
Стекло вынимают через 3-4 сут и окрашивают но Цилю-Нильсену. При микроскопии обнаруживают микроколонии микобактерии возбудителя туберкулеза. Вирулентные бактерии образуют змеевидные (рис. 22-2), а невирулентные — аморфные микроколонии. Культуры L-форм выделяют посевом в столбик полужидкой среды и инкубируют при 37 °С 1-2 мес.
Рост проявляется в виде облачка помутнения с мелкими вкраплениями. Вирулентность выделенной культуры возбудителя туберкулеза определяют заражением лабораторных животных и по наличию корд-фактора. Последний легко идентифицируют по способности микобактерии связывать нейтральный красный и нильский голубой и удерживать их после добавления щелочи. Вирулентные штаммы возбудителя туберкулеза удерживают красители, авирулентные — нет.
Источник
Бактериологические методы
В соответствии с современными программами ВОЗ, основой выявления туберкулёза за рубежом считают проведение микроскопии мазков мокроты, полученной от кашляющих больных, обратившихся к врачам общей практики; мазки окрашивают по Цилю-Нильсену. Эта методика входит в отечественный поликлинический и клинический минимум обследования пациента, выделяющего мокроту. В 1995 г. Минздравмедпром России в приказе № 8 «О развитии и совершенствовании деятельности лабораторной клинической микробиологии (бактериологии) лечебно-профилактических учреждений» подтвердил эту обязанность клинико-диагностических лабораторий. Обязательное бактериологическое исследование мокроты на М. tuberculosis должно быть организовано для нетранспортабельных больных, больных хроническими заболеваниями органов дыхания и мочевыводящей системы, а также для работников неблагополучных по туберкулёзу животноводческих хозяйств. Этот старейший метод полностью сохраняет свое значение вследствие доступности для практических клинико-диагностических лабораторий, низкой стоимости и быстроты выполнения.
При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 — 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии, что и является большим минусом этого метода. Только при идеальном выполнении всех требуемых условий, указанных в Приказе № 109 МЗ РФ,-исследование не менее трех проб диагностического материала, правильный сбор мокроты, наличие современного бинокулярного микроскопа и высококачественных реактивов, просмотр до 300 полей зрения — возможно повышение чувствительности до 10000 микробных клеток.
Микобактерии туберкулёза имеют вид тонких, слегка изогнутых палочек различной длины с утолщениями на концах или посередине, располагаются группами и поодиночке (рисунок 1,а) Окрашенные по Цилю-Нильсену мазки микроскопируют с иммерсионной системой не менее 10 мин.
Люминесцентная микроскопия
Метод основан на проникновении в микробную клетку карболового производного флюоресцентного красителя (аурамина, родамина). При окраске флюоресцентным красителем аурамином-родамином микобактерии можно видеть при неиммерсионном 100-кратном увеличении. Более точен результат при окраске по Цилю-Нильсену карболфуксином и иммерсионной микроскопии при 1000-кратном увеличении. Именно окраска мазка по Цилю-Нильсену рекомендована при применении технологий DOTS. Микобактерии в этом случае выглядят светящимися желтыми палочками (рисунок 1, б). Метод имеет неоспоримые преимущества, так как позволяет при меньшем увеличении микроскопа просмотреть фактически весь мазок, так же этот метод экономически более эффективен, так как уменьшается время, затрачиваемое на просмотр мазков.
К недостаткам метода ЛМ следует отнести значительно более высокую стоимость люминесцентного микроскопа, при процедуре окрашивания- соблюдение и коррекция pH мазка, а также освобождение микобактерий в диагностическом материале (особенно в мокроте) от окружающей их слизи, которая препятствует проникновению флуоресцентного красителя в микробную клетку. Поэтому нецелесообразно использование ЛМ для нативной мокроты, но применять этот метод рекомендуется при исследовании мазков, приготовленных после центрифугирования из осадка материала, обработанного для культурального исследования и нейтрализованного после деконтаминации. Поэтому метод ЛМ следует применять в бактериологических лабораториях, где культуральное и микроскопическое исследование может быть произведено из одной и той же порции диагностического материала.
При гистологическом или цитологическом исследовании иногда можно обнаружить характерные для туберкулёза клетки, являющиеся результатом защитной реакции организма на внедрение туберкулёзной палочки. Наличие в цитограмме гигантских клеток Лангханса с несомненностью решает диагноз туберкулёза. Эти клетки имеют очень большие размеры (80 — 90 мкм и более в диаметре). Цитоплазма окрашена в серо-голубой цвет. По её периферии расположено в ряд большое количество ядер (до 20), расположенных в форме кольца (рисунок 1, в).
Другим признаком туберкулёза является присутствие в препарате так называемых эпителиоидных клеток, из которых и развиваются клетки Лангханса. Это происходит при увеличении количества ядер без разделения цитоплазмы, которая только увеличивается в размерах (рисунок 1, г).
Микроскопия позволяет быстро получить результат, но обладает низкой чувствительностью и специфичностью, невозможностью дифференциации кислотоустойчивых микобактерий.
Рисунок 1
Микобактерии туберкулеза
а — метод окраски по Цилю-Нельсену
б — метод люминисцентной микроскопии
в — клетки Лангхаса
г — эпителиоидные клетки
Культуральный метод
Наиболее распространенным методом выявления микобактерий туберкулеза в нашей стране является культуральный метод. Это «золотой стандарт» бактериологической диагностики туберкулеза, так как чувствительность метода существенно выше микроскопического и дает возможность получить чистую культуру микобактерий для её последующей идентификации и исследования лекарственной устойчивости. Этот метод дает положительные результаты при наличии в исследуемом материале от 20 до 100 жизнеспособных микробных клеток в 1 мл. Однако он трудоемок и длителен в связи с тем, что микобактерии туберкулеза растут очень медленно и их обнаружение может быть зарегистрировано только через 3 недели культивирования.
Исторически сложилось, что питательные среды на яичной основе (Левенштейна-Йенсена, Финна-2, Огавы, Аникина, «Новая», Попеску) получили наибольшее распространение среди плотных питательных сред, применяемых для выделения МБТ. Посев материала на среду Левенштайна-Йенсена проводят в бактериологической лаборатории. Рост первых колоний на классических средах отмечают через 4 — 8 недель. Однако появившиеся в последние годы агаровые среды Миддлбрука (7Н10, 7Н11) позволяют быстрее обнаружить рост микобактерий (от двух до четырех недель) и обеспечивают лучшие возможности для изучения морфологии колоний, чем на яичных средах. Недостатком агаризованных питательных сред является необходимость инкубации посевного материала в термостате с углекислым газом, поэтому агаризованные среды в России практически не применяются.
Следует отметить, что в связи с высокой избирательностью различных штаммов микобактерий и потребностью в полноценных белках до сих пор нет универсальной питательной среды, способной заменить все остальные. В Приказе № 109МЗ РФ для посева диагностического материала на МБТ рекомендуется использовать по одной пробирке международной питательной среды Левенштейна-Йенсена и Финна-2. Однако практика показывает, что кроме указанных сред целесообразно использовать и какую-либо из дополнительных, а посев на три пробирки питательной среды также повышает эффективность культуральной диагностики.
Для полноценной культуральной диагностики туберкулеза необходимо иметь соответствующие помещения и оборудование. Особенно важно наличие центрифуги и антиаэрозольной защитой и способностью обеспечить ускорение 3000g. А также шкафов биологической безопасности для предотвращения внутрилабораторного инфицирования.
Основным недостатком культуральной диагностики туберкулеза является длительность исследования — от трех недель до трех месяцев. Поэтому остаются актуальными дальнейшие исследования по разработке методов ускорения роста микобактерий.
Системы BACTEC
Культуральная диагностика туберкулеза переживает в настоящее время принципиальные изменения, связанные с внедрением в практику полностью автоматизированных систем культивирования МБТ. Главное отличие этих методов — применение жидких питательных сред для культивирования с последующей радиометрической (BACTEC 460), колорометрической (Mb-Bact, Вас- tALERT) и люминесцентной детекцией роста (BACTEC MGIT 960). Рост МБТ на жидкой питательной среде в этих системах удается обнаружить уже через 1 — 2 недели в зависимости от их исходного количества в диагностическом материале. Частота выявления микобактерий так же несколько выше, чем на плотных питательных средах. Автоматизированные системы BACTEC с использованием соответствующих флаконов, содержащих различные противотуберкулезные препараты, позволяют сократить время исследования лекарственной устойчивости микобактерий до 10 — 14 суток.
Из перечисленных автоматизированных систем наиболее эффективна в настоящее время система BACTEC MGIT 960BD. Флаконы MGIT с жидкой питательной средой 7Н9 содержат в придонной части под силиконом флуоресцентный индикатор, «погашенный» высокими концентрациями кислорода. При наличии роста микобактерий в процессе поглощения кислорода индикатор начинает светиться, регистрация флуоресценции в сисиеме BACTEC MGIT производится автоматически. Использование флаконов MGIT возможно и «вручную», тогда регистрацию свечения производят с помощью трансиллюминатора на флаконах MGIT составляет 11 суток.
Основным недостатком BACTEC MGIT, как и других систем BACTEC, является высокая стоимость оборудования (до 100000 долларов США) и флаконов с питательной средой — посев одной пробы диагностического материала стоит до 400 рублей.
Посев на L -формы микобактерий
Так называемые дефектные по клеточной стенке L-формы микобактерий и других инфекционных патогенов являются результатом изменчивости и основным видом персистирования, то есть переживания в неблагоприятных условиях. Посев на L-формы особенно эффективен при внелегочном туберкулезе, поскольку вегетация МБТ в очагах ВЛТ при повышенном ацидозе и анаэробиозе приводит к снижению их жизнеспособности и ферментативной активности.
Диагноз не может быть поставлен только на основании выявления L-форм микобактерий, но их обнаружение, особенно при верификации методом ПЦР, является весомым аргументом в пользу туберкулезной природы заболевания. В очагах внелегочного туберкулеза наблюдается ранняя L-трансформация микобактерий, поэтому их обнаружение позволяет поставить диагноз на начальных стадиях заболевания.
Источник