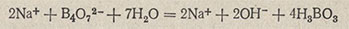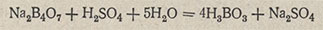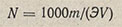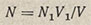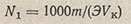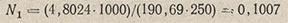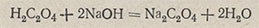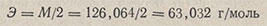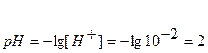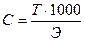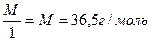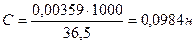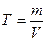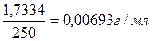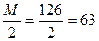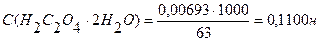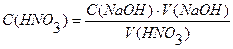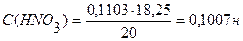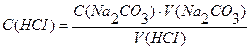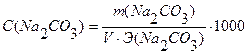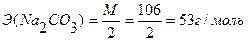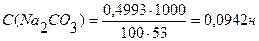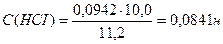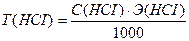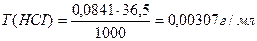- Метод нейтрализации
- Индикаторы метода нейтрализации
- Приготовление рабочих растворов и установка их титров
- Лекция 2 методы кислотно-основного титрования, или методы нейтрализации
- 2.1. Характеристика метода
- 2.2. Установление точки эквивалентности
- Сущность кислотно-основного титрования. Кривые титрования
- Индивидуальные задания
- Обучающие задачи
Метод нейтрализации
Для выполнения определений по методу нейтрализации применяют титрованные растворы кислот (серной, соляной или азотной) и растворы щелочей (гидроксидов натрия, калия или бария). Для установления точки эквивалентности применяют индикаторы, изменяющие окраску в определенной области pH.
Индикаторы метода нейтрализации
Метиловый оранжевый. Область перехода окраски при pH 3,1-4,4. Для титрования берут 1-2 капли раствора на 20-25 мл титруемого раствора. Для приготовления раствора индикатора растворяют 2 г сухого метилового оранжевого (метилоранжа) в 1 л воды. Переход окраски от красной к желтой.
Метиловый красный. Область перехода окраски при pH 4,2-6,2. Дает более резкий переход окраски, чем метиловый оранжевый. Для титрования применяют не более одной капли 0,2%-ного этанольного раствора на 25 мл титруемого раствора, при больших количествах индикатора переход окраски труднее заметен. Переход окраски от красной к желтой.
Фенолфталеин. Область перехода окраски при pH 8,2-10,0. Для титрования используют 1-2 капли 1%-ного этанольного (70%-ного) раствора индикатора на 25 мл титруемого раствора. Переход окраски от красного к бесцветному. Красная (розовая) окраска легко обесцвечивается под действием CO2, выделяющегося в результате реакции. Оттитрованные до розовой окраски растворы при стоянии могут также обесцветиться под действием CO2 воздуха. Применяют при титровании слабых кислот. Имеются и другие индикаторы.
Приготовление рабочих растворов и установка их титров
Приготовление 0,1 н. раствора серной кислоты. Эквивалент серной кислоты ЭH2SO4 = 98,08 : 2 = 49,04 г. Для приготовления 0,1 н. раствора необходимо получить раствор, содержащий в 1 л 49,04 * 0,1 = 4,90 г H2SO4. Раствор готовят приближенной концентрации из разбавленной 1:2 или 1:5 серной кислоты; далее точную нормальность раствора устанавливают титрованием. Для приготовления 1 л 0,1 н. раствора H2SO4 необходимо 16,8 мл кислоты плотностью 1,18 г/см3 (разбавленной 1:5) или 8,1 мл кислоты плотностью 1,35 г/см3 (разбавленной 1:2) разбавить водой в мерной колбе вместимостью 1 л до метки.
Для вычисления объема исходной серной кислоты, необходимой для приготовления 1 л 0,1 н. раствора H2SO4, нужно 0,1 эквивалента H2SO4 (4,9 г) умножить на 100 и разделить на процентное содержание H2SO4 в кислоте. Получают навеску кислоты в граммах; разделив ее на плотность, получают объем в миллилитрах.
Установка титра и нормальности 0,1 н. раствора серной кислоты. По тетраборату натрия Na2B4O7-10H2O. Тетраборат натрия гидролизуется в водном растворе с образованием ионов OH-:
которые и титруются кислотой. Поскольку ионы гидроксила связываются ионами водорода, реакция протекает до конца. Суммарно реакцию можно представить следующим уравнением:
Эквивалент тетрабората натрия в этой реакции равен 1/2 моля, а его масса равна Э = 381,37 / 2 = 190,69 г/моль. Чтобы препарат тетрабората натрия соответствовал формуле Na2B4O7-10H2O, его перекристаллизовывают. Для этого растворяют 140-150 г тетрабората натрия в 300 мл воды при нагревании не выше 60 °С. Раствор фильтруют через складчатый фильтр в фарфоровую чашку, охлаждаемую льдом. Фильтрат помешивают стеклянной палочкой, выделившиеся кристаллы отфильтровывают с отсасыванием, промывают небольшим количеством холодной воды и повторяют перекристаллизацию. Полученные кристаллы высушивают на воздухе 2-3 дня. Продаваемые препараты не соответствуют своей формуле из-за выветривания.
Для установки титра кислоты нужно взять такую навеску тетрабората натрия, чтобы на нее было израсходовано примерно 25 мл раствора кислоты. Навеска будет составлять: 191 * 0,1 * 25 : 1000 = 0,5 г.
Для установки титра кислоты берут 3-4 конические колбы вместимостью 100-150 мл и помещают в каждую точную навеску (около 0,5 г) тетрабората натрия. Каждую навеску растворяют примерно в 50 мл воды при слабом нагревании. Добавляют сначала в раствор одной из навесок 2-3 капли раствора индикатора метилового красного или метилового оранжевого. Раствор приобретает желтую окраску. Титруют приготовленным раствором (примерно 0,1 н.) кислоты до появления розового (с метиловым красным) или оранжевого (с метиловым оранжевым) окрашивания. Титрование ведут, сначала прибавляя раствор кислоты из бюретки малыми порциями при непрерывном перемешивании, затем осторожно титруют быстро падающими каплями, под конец титрование замедляют, последние капли добавляют по одной после сильного взбалтывания. Меньшую навеску следует титровать первой, потому что это даст приблизительную ориентировку в расходовании раствора на последующие навески. Такой способ установки титра называется методом отдельных навесок.
Для установки титра методом пипетирования готовят точно 0,1 н. раствор тетрабората натрия. Для этого точную навеску (19,07 г на 1 л или 4,760 г на 250 мл) тетрабората натрия взвешивают на часовом стекле и переводят в мерную колбу через воронку. Воронку и часовое стекло обмывают из промывалки струей горячей воды, затем колбу наполняют водой на 2/3 объема. Взбалтывая содержимое колбы круговыми движениями, растворяют навеску, после чего охлаждают до комнатной температуры, разбавляют водой до метки и перемешивают.
Отбирают пипеткой 25,0 мл приготовленного раствора тетрабората натрия в колбу для титрования, добавляют 2-3 капли раствора индикатора (метилового оранжевого или метилового красного) и титруют раствором кислоты, как и в случае отдельных навесок. Рекомендуется титровать со «свидетелем». Для приготовления «свидетеля» в колбу для титрования наливают мензуркой 50 мл воды, две капли раствора индикатора и одну каплю кислоты из бюретки, чтобы появилось очень слабое, но вполне заметное оранжевое или розовое окрашивание. Титрование тетрабората проводят до появления такой же интенсивности окраски, как у «свидетеля».
Для вычисления нормальности раствора кислоты по методу отдельных навесок пользуются формулой
где N — определяемая нормальность кислоты; m — навеска тетрабората, г; Э — эквивалентная масса тетрабората, г/моль; V — объем раствора кислоты, затраченный на титрование навески, мл.
По каждой навеске вычисляют нормальность и находят ее среднее значение. При титровании методом пипетирования расчет ведут по формуле
где N — искомая нормальность раствора кислоты; N1 — нормальность раствора тетрабората натрия; V1 — объем раствора тетрабората натрия, мл; V — объем, раствора кислоты, мл.
Например, навеска тетрабората натрия 4,8024 г растворена в мерной колбе вместимостью 250 мл и разбавлена водой до метки. На 25,0 мл этого раствора было израсходовано (среднее из четырех титрований) 25,85 мл устанавливаемого раствора H2SO4. Нормальность приготовленного раствора тетрабората натрия находят по формуле
где m — навеска тетрабората, г; Э — эквивалентная масса тетрабората, г/моль; Vк — объем колбы с раствором тетрабората натрия, мл. Подставив в эту формулу приведенные значения, получим:
Нормальность раствора серной кислоты:
Титр раствора серной (или другой) кислоты можно устанавливать также то карбонату натрия или по стандартному раствору гидроксида.
Приготовление 0,1 н. раствора гидроксида натрия (едкого натра). Для приготовления нужно пользоваться химически чистым реактивом (хч). Навеску берут несколько большей, чем требуется по расчету (на 30-50%). Взвешивают на химических лабораторных весах, отбирая шпателем свежие куски. Навеску помещают в фарфоровый стакан и дважды быстро промывают ее водой для удаления карбоната. Обмытые куски щелочи растворяют в небольшом количестве воды, переливают в склянку, предназначенную для хранения раствора щелочи, и разбавляют до необходимого объема прокипяченной (для удаления CO2) и затем охлажденной дистиллированной водой.
Растворы едкого натра (как и других щелочей) сильно поглощают CO2 из воздуха и изменяют свой титр. Поэтому растворы щелочей хранят в герметически закрытых склянках, защищая их от действия CO2 воздуха пробкой с хлоркальциевой трубкой, заполненной натронной известью; бюретку присоединяют к бутыли с помощью сифона.
Установление титра и нормальности 0,1 н. раствора гидроксида натрия. По щавелевой кислоте H2C2O4-2H2O. Щавелевая кислота взаимодействует со щелочью по уравнению
Эквивалент щавелевой кислоты равен 1/2 моля, а его масса
Для установления нормальности методом отдельных навесок растворяют 0,25 г (точную навеску) свежеперекристаллизованной щавелевой кислоты в 25 мл воды, добавляют 1-2 капли раствора фенолфталеина и титруют раствором NaOH до появления устойчивого розового (малинового) окрашивания. Нормальность вычисляют по формуле, приведенной выше. Нормальность можно установить методом пипетирования.
Для титрования можно применять только свежеприготовленный 0,1 н. раствор щавелевой кислоты. Раствор щавелевой кислоты неустойчив при хранении, поэтому для разового пользования его готовят не более 250 мл.
По янтарной кислоте HOOC-CH2-CH2-COOH. Янтарная кислота не содержит кристаллизационной воды, не гигроскопична. Продажные препараты квалификации хч или чда содержат не менее 99,9% основного вещества. Эквивалент янтарной кислоты равен 1/2 моля, а его масса 59,04 г/моль.
Для определения нормальности раствора NaOH растворяют 0,20-0,25 г янтарной кислоты (точное взвешивание) в 25 мл воды, добавляют 2-3 капли раствора фенолфталеина и титруют раствором NaOH до появления розового окрашивания, не исчезающего в течение 1 мин. Для устранения влияния CO2 раствор кипятят и титруют горячим. Титр устанавливают по отдельным навескам, так как янтарная кислота неустойчива при хранении в растворе. Нормальность можно устанавливать также по стандартному раствору кислоты с известным титром.
Источник
Лекция 2 методы кислотно-основного титрования, или методы нейтрализации
2.1. Характеристика метода
Методы нейтрализации основаны на применении реакций нейтрализации.
Основным уравнением процесса нейтрализации в водных растворах является взаимодействие ионов гидроксония (или водорода) с ионами гидроксила, сопровождающееся образованием слабо диссоциированных молекул воды:
Методы нейтрализации позволяют количественно определять кислоты (с помощью титрованных растворов щелочей), основания (с помощью титрованных растворов кислот) и другие вещества, реагирующие в стехиометрических соотношениях с кислотами и основаниями в водных растворах (например, соли аммония, реагирующие со щелочами; карбонаты, реагирующие с кислотами, и т. п.).
Применяя специальные приемы титрования, методами нейтрализации можно определять содержание многих солей, дифференцированно (раздельно) титровать смеси сильных, слабых и очень слабых кислот, а также смеси оснований и солей в неводных растворах.
Титрование кислотами и основаниями.Пользуясь каким-либо титрованным раствором, содержащим ионы гидроксония (например, раствором НС1), можно титровать основания; титрованными растворами оснований титруют кислоты.
Техника определения состоит в том, что к определенному количеству раствора основания (или кислоты) постепенно приливают из бюретки титрованный раствор кислоты (или основания) до наступления точки эквивалентности. Количество основания (или кислоты), содержащееся в исследуемом растворе, вычисляют по объему титрованного раствора кислоты (или основания), израсходованного на нейтрализацию определенного объема раствора анализируемого образца или навески исследуемого продукта.
2.2. Установление точки эквивалентности
Определение точки эквивалентности с помощью индикаторов.Точное установление точки эквивалентности, т. е. того момента, когда количество прибавленного реактива В станет эквивалентно количеству реагирующего с ним определяемого вещества А, имеет очень важное значение в титриметрическом анализе вообще и в методе нейтрализации в особенности.
Практически момент эквивалентности (точку эквивалентности) устанавливают индикаторным методом по изменению окраски индикатора, 1—2капли раствора, которого добавляют в титруемый раствор.
Физико-химические, или инструментальные, методы установления точки эквивалентности. В связи с тем, что цветные индикаторы оказываются непригодными для установления точки эквивалентности при титровании сильно окрашенных или мутных растворов, разработаны и широко применяются другие способы установления точки эквивалентности, основанные на наблюдении свойств раствора, резко меняющихся в момент эквивалентности. Большое значение приобрели физические и физико-химические, или инструментальные, методы установления точки эквивалентности, основанные на измерении при помощи специальных приборов некоторых величин, характеризующих какое-нибудь свойство раствора (например, электропроводность), которое меняется в процессе титрования постепенно, а в точке эквивалентности —резко. К этим методам титрования относятся кондуктометрические, высокочастотные, по-тенциометрические, амперометрические и некоторые другие.
Источник
Сущность кислотно-основного титрования. Кривые титрования



Метод кислотно-основного титрования (метод нейтрализации) – предназначен для определения концентрации кислот, оснований, солей и основан на реакции нейтрализации
Реакции кислотно-основного взаимодействия являются реакциями передачи протона от титранта к определяемому веществу или наоборот; характеризуются высокой скоростью и протекают строго стехиометрически.
Так как реакция нейтрализации не сопровождается изменением окраски раствора, точку эквивалентности определяют с помощью индикатора. Но обычно индикаторы меняют окраску не строго в точке эквивалентности, а с некоторым отклонением от неё. Другими словами, конечная точка титрования, (момент, в который происходит изменение окраски индикатора) не совпадает с точкой эквивалентности, а только более или менее соответствует ей. Поэтому даже при правильном выборе индикатора допускается погрешность – так называемая индикаторная ошибка титрования. Неправильный же выбор индикатора может вообще исказить результаты титрования.
Индикаторы, применяемые в кислотно-основном титровании: кислотно-основные индикаторы, например, метиловый оранжевый, фенолфталеин и др.
Титранты кислотно-основного титрования: растворы сильных кислот при определении концентрации оснований, растворы щелочей при определении концентрации кислот.
Стандартные вещества: карбонат натрия Na2CO3, тетраборат натрия Na2B4O7?10H2O для установления титра или нормальной концентрации (стандартизации) кислот. Щавелевая кислота Н2С2О4 ·2Н2О – для стандартизации щелочей.
Определяемые вещества: сильные и слабые кислоты; сильные и слабые основания; соли, подвергающиеся гидролизу.
Виды кислотно-основного титрования:
Для правильного титрования , и, следовательно, получения верных результатов, необходимо правильно подобрать индикатор.
Для этого следует знать:
— как меняется рН раствора в колбе в ходе титрования, каково значение рН в точке эквивалентности и вблизи неё?
Для ответа на эти вопросы строят кривые титрования.
Кривая титрования – это график зависимости рН среды в колбе от объема добавленного титранта. Кривая титрования характеризуется точкой эквивалентности, точкой нейтральности, скачком титрования, линией нейтральности.
Линия нейтральности – прямая, параллельная оси абсцисс и пересекающая ось ординат при рН = 7.
Точка нейтральности – точка пересечения кривой титрования с линией нейтральности.
Скачок титрования – участок резкого изменения рН.
Титрование сильной кислоты сильным основанием (или наоборот). Расчет и построение кривой титрования. Для построения кривой титрования рассчитаем значения рН в точке эквивалентности и вблизи неё (когда добавлено титранта 0%, 90%, 99%, 99,9%, 100%, 100,1%, 101%, 110%, 200% от количества, необходимого для полной нейтрализации раствора в колбе) при титровании 10 мл 0,1н. раствора соляной кислоты 0,1н. раствором гидроксида натрия.
НСI + NaOH ↔ NaCI + H2O
По условию в колбе 10 мл 0,1н. раствор НСI, следовательно, в бюретке 0,1н. раствор NaOH.
По закону эквивалентов:
С(HCl) ?V(HCl)=C(NaOH) ?V(NaOH)
Следовательно, для полной нейтрализации 10 мл 0,1н. раствора НСI потребуется 10 мл 0,1н. раствора NaOH. По мере добавления к раствору кислоты, находящемуся в колбе, из бюретки раствора щелочи будет происходить постепенная нейтрализация соляной кислоты, причем 
Объем добавленного титранта, в нашем случае объем добавленной щелочи, рассчитываем по формуле:
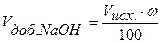
где ω – процент добавленного титранта.
Концентрация кислоты в колбе в процессе титрования будет меняться:
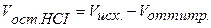
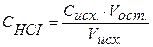
Точка №1: добавлено 0% NaOH, т.е. 0 мл. Концентрацию ионов Н + в колбе рассчитываем по формуле (8), значение рН – по формуле (5):
[H + ] = CHCI = 0,1 = 10 -1 ,
рН = -lg[H + ] = -lg10 -1 = 1
Точка №2: добавлено 90% от объема щелочи, необходимого для нейтрализации кислоты. Объем добавленной щелочи рассчитываем по формуле (35):
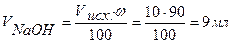
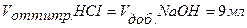
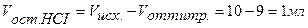
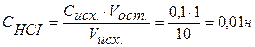
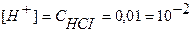
Аналогично рассчитываются точки №№ 3,4.
Точка №5 – точка эквивалентности, так как добавлено эквивалентное количество щелочи (100%). Вся кислота в колбе оттитрована:

НСI + NaOH ↔ NaCI + H2O
В колбе находится раствор хлорида натрия. Данная соль гидролизу не подвергается. Как рассчитать рН? Концентрация ионов Н + определяется диссоциацией воды:
Из формулы ионного произведения воды
[H + ] = [OH — ] = 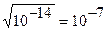
pH = — lg [H + ] = — lg 10 -7 = 7.
Таким образом, при титровании сильной кислоты сильным основанием (или наоборот) точка эквивалентности совпадает с точкой нейтральности.
Точка №6: теоретически продолжаем титрование, чтобы построить график и подобрать индикатор. Добавляем 100,1% от необходимого объема щелочи, следовательно, в колбе избыток щелочи.
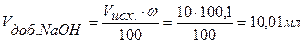
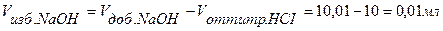
Находим концентрацию щелочи в колбе по формуле:
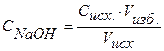
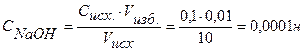
Концентрацию гидроксид-ионов рассчитываем по формуле (12), для расчета концентрации ионов Н + в щелочном растворе используем формулу (4):
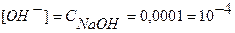
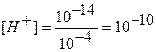
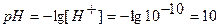
Аналогично рассчитывают точки №№ 7,8,9. Данные расчетов заносим в таблицу.
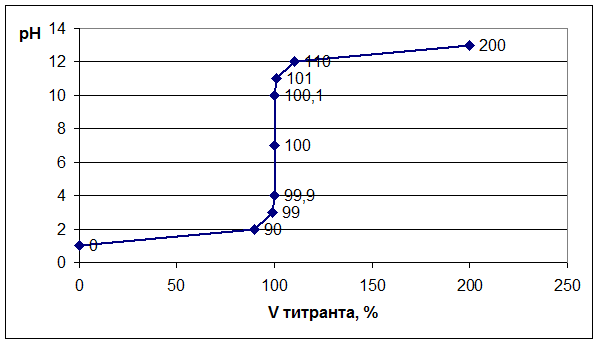
Далее строим график зависимости: рН = f (Vтитранта, %). На графике отмечаем точку эквивалентности, скачок титрования, линию нейтральности.
| № точки | Добавлено щелочи | От-титро-вано к-ты, мл | Vост. к-ты, мл | Хар-р среды р-ра в колбе | 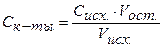 | [H + ] | рН |
| % | мл | ||||||
| кислая | C = 0,1 н. | 10 -1 | |||||
| кислая | C = 0,01н. | 10 -2 | |||||
| 9,9 | 9,9 | 0,1 | кислая | С = 0,001н. | 10 -3 | ||
| 99,9 | 9,99 | 9,99 | 0,01 | кислая | С = 0,0001н. | 10 -4 | |
| нейтр. | определяется диссоциацией воды [H + ]·[OH — ] = 10 -14 | 10 -7 | |||||
| Vизб. щелочи, мл | 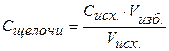 | ||||||
| 100,1 | 10,01 | 0,01 | щелоч | C = 0,0001н. | 10 -10 | ||
| 10,1 | 0,1 | щелоч | С = 0,001н. | 10 -11 | |||
| щелоч | С = 0,01н. | 10 -12 | |||||
| щелоч | С = 0,1н. | 10 -13 |
Следует отметить, что при титровании сильного основания сильной кислотой рН раствора в колбе будет меняться в обратном направлении, то есть от 14 до 0.
Выбор индикатора. Каждый индикатор изменяет свою окраску в определенном диапазоне значений рН – это так называемая область перехода. Показатель титрования индикатора (рТ) – это значение рН, при котором наблюдатель отчетливо отмечает изменение окраски раствора и признает титрование оконченным. Индикатор подбирают таким образом, чтобы его показатель титрования рТ был как можно ближе к значению рН в точке эквивалентности.
Для нашего случая (см. Приложение VII) подойдут следующие индикаторы: метиловый оранжевый, метиловый красный, лакмус, фенолфталеин.
Титрование слабой кислоты сильным основанием. В качестве примера рассмотрим титрование уксусной кислоты гидроксидом натрия:
Ацетат натрия подвергается гидролизу:
В результате образования некоторого избытка гидроксид-ионов точка эквивалентности не совпадает с точкой нейтральности, а лежит в щелочной области. Следовательно, имеет место сужение скачка титрования в кислотной области. Для данного вида кислотно-основного титрования подходит индикатор фенолфталеин.
Титрование слабого основания сильной кислотой. В качестве примера рассмотрим титрование гидроксида аммония соляной кислотой:
Хлорид аммония подвергается гидролизу:
В результате образования некоторого избытка ионов Н + точка эквивалентности лежит в кислотной области. Следовательно, имеет место сужение скачка титрования в щелочной области. Для данного вида кислотно-основного титрования подходят индикаторы метиловый оранжевый, метиловый красный.
Титрование слабой кислоты слабым основанием (и наоборот)невозможно, так как наблюдается сужение скачка титрования и в кислотной, и щелочной области. Скачок титрования исчезает на кривой титрования. Следовательно, не может быть резкого изменения окраски индикатора.
Индикаторы кислотно-основного титрования. Ионная теория индикаторов. Индикаторы в методе кислотно-основного титрования представляют собой слабые органические кислоты НInd или слабые органические основания IndOH, у которых молекулярная и ионная формы имеют различную окраску.
Примером кислотного индикатора НInd является фенолфталеин, его молекулы бесцветны, а анионы Ind — имеют малиновую окраску. Согласно ионной теории индикаторов изменение цвета индикатора вызывается смещением равновесия в уравнении диссоциации:
бесцветная малиновая
Если к раствору, содержащему фенолфталеин, прибавить немного щелочи, ионы ОН — будут связывать ионы Н + с образованием слабого электролита Н2О и равновесие смещается в сторону образования анионов Ind — , раствор окрасится в малиновый цвет. Если же добавить к раствору фенолфталеина немного кислоты, то повышение концентрации протонов вызовет смещение равновесия в сторону недиссоциированных молекул индикатора и раствор станет бесцветным.
Ионно-хромофорная теория. Молекулы индикаторов содержат хромофоры (носители цветности). Это особые группы атомов с сопряженными двойными связями и неподеленными электронными парами (– N ≡ N –, – N = O, =C=O, = = ). Изменение окраски индикатора происходит при превращении одних хромофоров в другие у двухцветных индикаторов и при появлении и исчезновении хромофоров у одноцветных индикаторов. Другими словами, кислотно-основные индикаторы могут существовать в двух взаимно переходящих формах, имеющих различную окраску. Переход происходит под действием ионов Н + или ОН — . На окраску индикаторов оказывают влияние также ауксохромы. Это содержащиеся в их молекулах группы -ОН, –NH2 и их производные ( – ОСН3, –N(CH3)2 и т.п.), которые в отличие от хромофоров не сообщают окраску, а усиливают их действие, повышая интенсивность вызываемой ими окраски.
Индивидуальные задания
Рассчитать значения рН в точке эквивалентности и вблизи нее и построить кривую титрования:
| № варианта | Условие |
| 20 мл 0,01н. раствора НNO3 0,01н. раствором NaOH | |
| 20 мл 0,1н. раствора NaOH 0,1н. раствором НNO3 | |
| 30 мл 0,01н. раствора НNO3 0,01н. раствором NaOH | |
| 30 мл 0,1н. раствора КОН 0,1н. раствором НNO3 | |
| 40 мл 0,01н. раствора NaOH 0,01н. раствором НСI | |
| 40 мл 0,1н. раствора НСI 0,1н. раствором КОН | |
| 60 мл 0,1н. раствора НNO3 0,1н. раствором NaOH | |
| 60 мл 0,01н. раствора КОН 0,01н. раствором НСI | |
| 70 мл 0,01н. раствора НNO3 0,01н. раствором NaOH | |
| 70 мл 0,1н. раствора КОН 0,1н. раствором НNO3 | |
| 80 мл 0,1н. раствора НСI 0,1н. раствором КОН | |
| 80 мл 0,01н. раствора КОН 0,01н. раствором НNO3 | |
| 20 мл 1н. раствора НСI 1н. раствором КОН | |
| 20 мл 1н. раствора NaOH 1н. раствором НСI | |
| 100 мл 0,01н. раствора НСI 0,01н. раствором NaOH | |
| 100 мл 0,1н. раствора NaOH 0,1н. раствором НNO3 | |
| 10 мл 1н. раствора НNO3 1н. раствором КОН |
Обучающие задачи
Задача №1
Титр раствора НСI равен 0,00359 г/мл. Найти молярную концентрацию эквивалента раствора соляной кислоты.
Дано: Решение:
Т(НСI) = 0,00359г/мл
С — ? Э (НCI) =
Ответ: С (НСI) = 0,0984н.
Задача №2
Какова молярная концентрация эквивалента и титр раствора щавелевой кислоты (Н2С2О4?2Н2О), полученного растворением 1,7334 г её в мерной колбе ёмкостью 250 мл?
Дано: Решение:
m (Н2С2О4 ? 2Н2О) = 1,7334г
Vколбы = 250 мл Т (Н2С2О4 ? 2Н2О) =
С — ? Т — ?
Э (Н2С2О4 ? 2Н2О) =
Задача №3
На титрование 20 мл раствора НNO3 израсходовано 18,25 мл 0,1103н. раствора NaOH. Вычислить молярную концентрацию эквивалента раствора НNO3.
Дано: Решение:
С (NaOH) = 0,1103н.
С (НNO3) — ?
Ответ: С (НNO3) = 0,1007н.
Задача №4
Вычислить нормальность и титр соляной кислоты, если на титрование 10,0 мл раствора Na2CO3, полученного растворением навески 0,4993г в мерной колбе ёмкостью 100мл, расходуется 11,2 мл раствора НСI.
Дано: Решение:
Vколбы = 100 мл
V (Na2CO3) = 10,0 мл
V (HCI) = 11,2 мл
С (НСI) — ?
Т (НСI) — ?
Э (НСI) = М = 36,5 г/моль
Ответ: С(НСI) = 0,0841н., Т(НСI) = 0,00307 г/мл.
Задачи для самостоятельного решения
1. Титр раствора азотной кислоты равен 0,00609 г/мл. Найти молярную концентрацию эквивалента кислоты. Ответ: 0,0967н.
2. Рассчитать величину навески Н2С2О4?2Н2О для приготовления 100мл 0,1н. раствора. Ответ: 0,63г.
3. Какова молярная концентрация эквивалента и титр раствора Na2CO3, полученного растворением: а) навески 1,0678г в мерной колбе емкостью 200 мл; б) навески 0,4968г в мерной колбе емкостью 100 мл; в) навески 0,5265г в мерной колбе емкостью 100 мл? Ответы: а) Т = 0,00534 г/мл, С = 0,1008н; б) Т = 0,00497 г/мл, С = 0,0938н; в) Т = 0,00527 г/мл, С = 0,0994 н.
4. На титрование 10,00 мл раствора NaOH израсходовано 9,15 мл 0,0981н. раствора НСI. Вычислить молярную концентрацию эквивалента гидроксида натрия. Ответ: 0,0898н.
5. На титрование 10,00 мл 0,0915н. раствора Na2CO3 израсходовано 10,2 мл раствора НСI. Вычислить молярную концентрацию эквивалента раствора HCI. Ответ: 0,0897н.
6. На титрование 10,00 мл 0,1041н. раствора Na2CO3 израсходовано 8,9 мл раствора НСI. Вычислить нормальность раствора HCI. Ответ: 0,1170н.
7. На титрование 10,00 мл раствора NaOH израсходовано 8,75 мл 0,1055н. раствора НСI. Вычислить молярную концентрацию эквивалента NaOH. Ответ: 0,0923н.
8. Какой объем 0,0965н. раствора NaOH пойдет на титрование 10 мл 0,1105н раствора НСI? Ответ: 11,45 мл.
9. Какой объем 0,0991н раствора НСI пойдет на титрование 10 мл 0,1025н раствора NaOH? Ответ: 10,34 мл.
10. Вычислить нормальность и титр раствора соляной кислоты, если на титрование 20,00 мл раствора Na2CO3, полученного растворением навески 0,9985г в мерной колбе емкостью 200 мл, расходуется 24 мл раствора НСI. Ответ: С = 0,0785н., Т = 0,00287 г/мл.
11. Вычислить нормальность раствора НСI, если на титрование 10,00 мл раствора Na2CO3, полученного растворением навески 0,5502г в мерной колбе емкостью 100 мл, расходуется 9,75 мл раствора НСI. Ответ: С = 0,1065н.
? Контрольные вопросы
1. Сущность титриметрического анализа. Что такое титрование, точка эквивалентности? Способы установления точки эквивалентности.
2. Способы выражения концентрации растворов в титриметрическом анализе. Приведите соответствующие формулы.
3. Что лежит в основе классификации методов титриметрического анализа. Кратко охарактеризуйте каждый метод. Применение титриметрического анализа.
4. Стандартные и стандартизированные растворы. Требования, предъявляемые к стандартным веществам. Стандартные и стандартизированные растворы в кислотно-основном титровании. Приведите примеры. Формулы расчета массы вещества для приготовления стандартного раствора, расчета титра и нормальной концентрации стандартного раствора, расчета концентрации стандартизированного раствора.
5. Сущность кислотно-основного титрования. Что такое точка эквивалентности? В какой области значений рН лежит точка эквивалентности при титровании: а) сильной кислоты сильным основанием (или наоборот); б) слабой кислоты сильным основанием; в) слабого основания сильной кислотой? Привести примеры и объяснить. Объяснить, возможно ли титрование слабой кислоты слабым основанием.
6. Выбор индикатора в кислотно-основном титровании. Что такое область перехода и показатель титрования индикатора? Ионная теория индикаторов на примере фенолфталеина.
7. Ионно-хромофорная теория индикаторов. Понятие о хромофорах и ауксохромах.
Источник