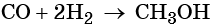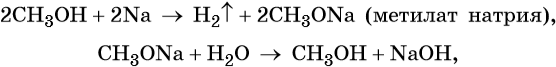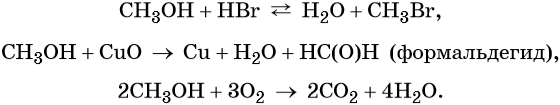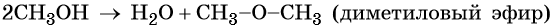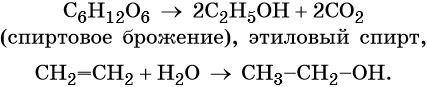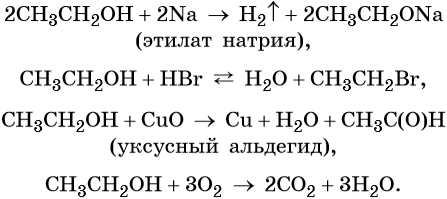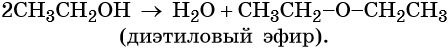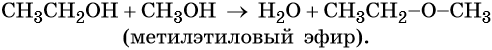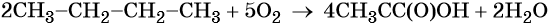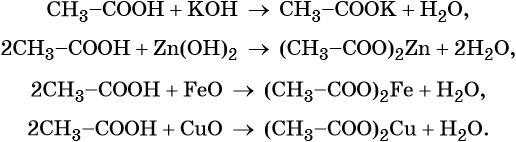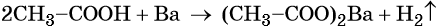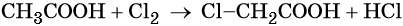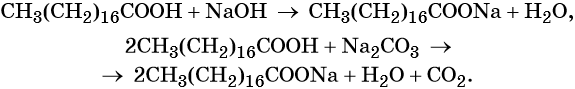- Кислородсодержащие вещества: спирты (метанол, этанол, глицерин), карбоновые кислоты (уксусная и стеариновая)
- Тренировочные задания
- Сложные эфиры: способы получения и свойства
- Классификация сложных эфиров
- По числу карбоксильных групп:
- Номенклатура сложных эфиров
- Химические свойства сложных эфиров
- 2. Переэтерификация
- 3.Восстановление сложных эфиров
- Получение сложных эфиров
- 1. Этерификация карбоновых кислот спиртами
- 2. Соли карбоновых кислот с галогеналканами
Кислородсодержащие вещества: спирты (метанол, этанол, глицерин), карбоновые кислоты (уксусная и стеариновая)
Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы (–OH).
По числу гидроксильных групп спирты делят на одноатомные, двухатомные, трёхатомные и многоатомные.
Предельными одноатомными спиртами называют класс химических веществ, отвечающий общей формуле CnH2n+1OH и содержащий в своей молекуле функциональную гидроксильную группу –OH, связанную с углеводородным радикалом.
Родоначальником гомологического ряда предельных одноатомных спиртов является метиловый спирт, или метанол. Его структурная формула CH3OH.
Метиловый спирт представляет собой бесцветную жидкость с характерным запахом, которая смешивается с водой во всех отношениях. Его температура кипения равна +64,7 °С, температура плавления –93,9 °С. В промышленности его получают из смеси оксида углерода (II) и водорода в присутствии катализатора — окиси цинка и хрома при высокой температуре:
Метиловый спирт реагирует с щелочными металлами с образованием соответствующих метилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:
При межмолекулярной дегидратации метилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:
Метиловый спирт применяют в производстве формальдегида, полимерных материалов, в качестве растворителя в различных процессах.
Метиловый спирт очень ядовит. Известны многочисленные случаи тяжёлых отравлений этим соединением, часто со смертельным исходом.
Ближайший гомолог метилового спирта — этиловый спирт, или этанол. Его структурная формула CH3–CH2–OH. Он представляет собой бесцветную жидкость с характерным запахом. Смешивается с водой во всех отношениях. Его температура кипения равна +78,3 °С, температура плавления –114,2 °С.
Разработано несколько промышленных методов получения этанола. Наиболее важными являются спиртовое брожение сахаристых веществ, например глюкозы в присутствии дрожжей, а также каталитическая гидратация этилена:
Этиловый спирт реагирует с щелочными металлами с образованием соответствующих этилатов, вступает в обратимые реакции с галогенводородными кислотами, а также в окислительно-восстановительные реакции:
При межмолекулярной дегидратации этилового спирта (катализатор — концентрированная серная кислота) происходит образование простого эфира:
Если в реакцию этерификации взять смесь метилового и этилового спиртов одним из продуктов реакции может быть эфир несимметричного строения:
Этиловый спирт широко применяется в химической промышленности для производства красителей, ядохимикатов, пороха, пластмасс, уксусной кислоты и т. д. Этиловый спирт применяют в медицине и парфюмерии.
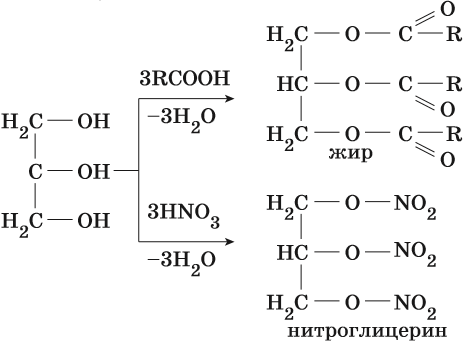
Трехатомные спирты. Эти спирты содержат три гидроксильные группы при разных углеродных атомах. Общая формула трёхатомных спиртов CnH2n-1(OH)3. Простейшим представителем трехатомных спиртов является глицерин. Его структурная формула HOCH2–CH(OH)–CH2OH. Он представляет собой бесцветную сиропообразную жидкость, сладкую на вкус. Смешивается с водой и этиловым спиртом во всех отношениях. Его температура кипения равна +290 °С, температура плавления +17 °С.
Получают глицерин омылением жиров, а также из непищевого сырья.
Глицерин способен образовывать жиры при реакции с карбоновыми кислотами, а его реакция со смесью азотной и серной кислот приводит к образованию тринитрогилцерина NO2–OCH2–CH(O–NO2)–CH2O–NO2— мощного взрывчатого вещества.
При взаимодействии глицерина со свежеосаждённым гидроксидом меди образуется глицерат меди, имеющий характерный ярко-синий цвет. Эта реакция является качественной для определения глицерина.
Глицерин применяют для изготовления полиэфирных полимеров, взрывчатых веществ, в парфюмерии, текстильной и пищевой промышленности.
Уксусная кислота H3CC(O)OH представляет собой бесцветную жидкость с резким запахом. Безводная уксусная кислота, имеющая температура плавления 16,6 °С называется ледяной.
Уксусная кислота широко распространена в природе. Она образуется при уксуснокислом брожении жидкостей, содержащих спирт, содержится в растениях и т. д.
В промышленности уксусную кислоту получают из уксусного альдегида или жидкофазным окислением углеводородов в присутствии солей марганца в качестве катализатора, например:
Уксусная кислота является слабой кислотой. Её производные называют ацетаты.
Она вступает в реакцию с основаниями и амфотерными гидроксидами (реакция нейтрализации), основными и амфотерными оксидами. Во всех случаях образуются соль и вода:
Уксусная кислота может реагировать с активными металлами с образованием солей и выделением водорода:
При хлорировании уксусной кислоты в присутствии красного фосфора образуется хлоруксусная кислота:
Уксусную кислоту используют в качестве полупродукта при производстве ацетонового шелка, красителей и др. Уксусную кислоту также широко применяют в пищевой промышленности. Водные растворы уксусной кислоты с концентрацией 70—80% называются уксусной эссенцией, а с концентрацией 3—5% — столовым уксусом.
Стеариновая кислота СН3(СН2)16СООН представляет собой бесцветные кристаллы с температурой плавления 69,6 °С. В воде стеариновая кислота очень мало растворима. Эта кислота входит в состав животных и растительных жиров, которые и служат источником её получения. Используют стеариновую кислоту в фармацевтической и косметической промышленности. Её натриевая соль — стеарат натрия СН3(СН2)16СООН образуется в результате взаимодействия стеариновой кислоты с гидроксидом или карбонатом натрия.
Стеарат натрия является основной составной частью обычного твёрдого мыла, а стеарат калия — жидкого мыла.
Тренировочные задания
1. Для метанола верны следующие утверждения:
1) это жидкость с характерным запахом, хорошо растворимая в воде
2) содержит в своём составе карбоксильную группу
3) содержит в своём составе гидроксильную группу
4) не горит на воздухе
5) реагирует с бромной водой
2. Для метанола верны следующие утверждения:
1) это газ при нормальных условиях
2) атомы углерода в нём находятся в состоянии sp-гибридизации
3) реагирует с металлическим натрием
4) реагирует с гидроксидом натрия
5) горит на воздухе
3. Для этанола верны следующие утверждения:
1) это жидкость с характерным запахом, не растворимая в воде
2) это низкокипящий газ, хорошо растворимый в воде
3) реагирует с гидроксидом натрия
4) реагирует с хлороводородом
5) реагирует с калием
4. Для этанола верны следующие утверждения:
1) его используют в медицине и пищевой промышленности
2) реагирует с концентрированными щелочами
3) не вступает в окислительно-восстановительные реакции
4) при дегидратации даёт ацетилен
5) при дегидратации даёт этилен
5. Для глицерина верны следующие утверждения:
1) все атомы в его молекуле находятся в состоянии sp-гибридном состоянии
2) реагирует с водой
3) даёт ярко-синее окрашивание со свежеосаждённым раствором гидроксида меди (II)
4) реагирует с угольной кислотой
5) реагирует с азотной кислотой
6. Для глицерина верны следующие утверждения:
1) это предельный двухатомный спирт
2) это предельный трехатомный спирт
3) реагирует с бромной водой
4) реагирует с железом
5) реагирует с натрием
7. Для уксусной кислоты верны следующие суждения:
1) это жидкость с характерным резким запахом, нерастворимая в воде
2) это жидкость с характерным резким запахом, хорошо растворимая в воде
3) все атомы углерода находятся в состоянии sp2-гибридизации
4) атом углерода карбоксильной группы находится в состоянии sp2-гибридизации
5) сгорает на воздухе с образованием углекислого газа и водорода
8. Для уксусной кислоты верны следующие суждения:
1) сильнее соляной кислоты, но слабее угольной кислоты
2) сильнее угольной кислоты, но слабее соляной кислоты
3) не реагирует с основаниями
4) окисляет серу
5) реагирует со щелочами
9. Для стеариновой кислоты верны следующие суждения:
1) это непредельная одноосновная кислота
2) содержит в своём составе карбоксильную группу и углеводородный радикал C17H35
3) сильнее уксусной кислоты
4) сильнее соляной кислоты
5) в виде сложных эфиров входит в состав растительных и животных жиров
10. Для стеариновой кислоты верны следующие суждения:
1) это твёрдое вещество белого цвета, не растворимое в воде
2) реагирует с сульфатом натрия
3) реагирует с гидроксидом натрия
4) относится к сильным кислотам
5) содержит в своём составе углеводородный радикал формулы C15H31
Источник
Сложные эфиры: способы получения и свойства
Сложные эфиры: способы получения, химические и физические свойства, строение.
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
Классификация сложных эфиров
По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
| Например, метилформиат |
- сложные эфиры многоосновных карбоновых кислот — содержат две и более карбоксильные группы -СОО-. Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4.
| Например, тристеарат глицерина |
Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Получение сложных эфиров
1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
| Например, при взаимодействии ацетата натрия с хлорметаном образуется метилацетат. |
CH3-COONa + CH3-Cl = CH3-COOH + NaCl
Источник