Мембранный потенциал. Определение. Величина. Микроэлектродный метод измерения МП.



Одна из важнейших функций биологической мембраны — генерация и передача биопотенциалов. Это явление лежит в основе возбудимости клеток, регуляции внутриклеточных процессов, работы нервной системы, регуляции мышечного сокращения, рецепции.
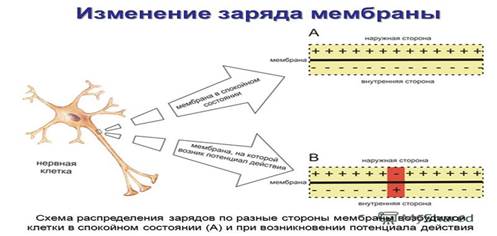
Мембранный потенциал — разность потенциалов между внутренней (цитоплазматической) и наружной поверхностями мембраны живой клетки в состоянии физиологического покоя. Внешняя поверхность клетки несет положительный заряд, а внутренняя сторона мембраны (цитоплазма) – отрицательный. ∆φ= φвн- φнар
Величина МП=-60-90 мВ. Мембранные потенциалы подразделяются на потенциалы покоя и потенциалы действия.
Потенциал покояприсущ как невозбудимым клеткам (например, эритроциту), так и возбудимым (аксоны, кардиомиоциты). Потенциалы действия существуют только в возбудимых клетках и тканях.
Мембранный потенциал покоя образуется за счёт двух процессов: 1. Работа калий-натриевого насоса мембраны. Работа калий-натриевого насоса, в свою очередь, имеет 2 следствия: 1.1. Непосредственное электрогенное (порождающее электрические явления) действие ионного насоса-обменника. Это создание небольшой электроотрицательности внутри клетки (-10 мВ). Виноват в этом неравный обмен натрия на калий. Натрия выбрасывается из клетки больше, чем поступает в обмен калия. А вместе с натрием удаляется и больше «плюсиков» (положительных зарядов), чем возвращается вместе с калием. Возникает небольшой дефицит положительных зарядов. Мембрана изнутри заряжается отрицательно (примерно -10 мВ).
1.2. Создание предпосылок для возникновения большой электроотрицательности. Эти предпосылки — неравная концентрация ионов калия внутри и снаружи клетки. Лишний калий готов выходить из клетки и выносить из неё положительные заряды. Об этом мы скажем сейчас ниже. 2. Утечка ионов калия из клетки. Из зоны повышенной концентрации внутри клетки ионы калия выходят в зону пониженной концентрации наружу, вынося заодно положительные электрические заряды. Возникает сильный дефицит положительных зарядов внутри клетки. В итоге мембрана дополнительно заряжается изнутри отрицательно (до -70 мВ).
Вывод: Калий-натриевый насос создает предпосылки для возникновения потенциала покоя. Это — разность в концентрации ионов между внутренней и наружной средой клетки. Отдельно проявляет себя разность концентрации по натрию и разность концентрации по калию. Попытка клетки выровнять концентрацию ионов по калию приводит к потере калия, потере положительных зарядов и порождает электроотрицательность внутри клетки. Эта электро отрицательность составляет большую часть потенциала покоя. Меньшую его часть составляет непосредственная электрогенность ионного насоса, т.е. преобладающие потери натрия при его обмене на калий.
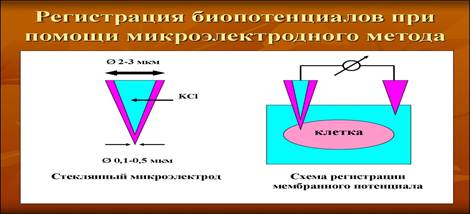
Микроэлектродный метод измерения биопотенциалов. Микроэлектроды бывают металлическими и стеклянными. Металлический микроэлектрод представляет собой стержень из специальной высокоомной изолированной проволоки с регистрирующим кончиком. Стеклянный микроэлектрод диаметром около 1 мм изготавливается из специального стекла — пирекса, с тонким незапаянным кончиком, заполненным раствором электролита. Схема регистрации мембранного потенциала. Микроэлектроды подводят к изучаемым отделам головного мозга, отвечающих за память у животных, и наблюдают графическую запись импульсной активности нейронов.

Микроэлектродный метод дал возможность измерить биопотенциалы не только на гигантском аксоне кальмара, но и на клетках нормальных размеров: нервных волокнах других животных, клетках скелетных мышц, клетках миокарда и других.
В медицине на исследование электрических полей, созданных биопотенциалами органов и тканей, основаны диагностические методы: электрокардиография, электроэнцефалография, электромиография и другие. Практикуется и лечебное воздействие на ткани и органы внешними электрическими импульсами при электростимуляции.
II.
Регистрация кривой порога слышимости
Изучение аппарата для измерения артериального давления
Снятие электрокардиограммы и построение вектора ЭДС сердца
Источник
Мембранный потенциал способы измерения
Когда мембрана проницаема для нескольких различных ионов, суммарный диффузионный потенциал зависит от трех факторов: полярности электрического заряда каждого иона; (2) проницаемости мембраны (Р) для каждого иона; (3) концентраций (С) соответствующих ионов внутри (i) и снаружи мембраны (о). Формула, которую называют уравнением Голъдмана, или уравнением Гольдмана-Ходжкина-Катца, позволяет рассчитать мембранный потенциал на внутренней стороне мембраны, если она проницаема для 2 одновалентных положительных ионов (Na+ и К+) и 1 одновалентного отрицательного иона Сl-.
Рассмотрим это уравнение. Во-первых, ионы натрия, калия и хлора — самые важные ионы, участвующие в генерации мембранных потенциалов нервных и мышечных волокон, а также в нейронах нервной системы. Градиент концентрации каждого из этих ионов по обе стороны мембраны помогает определить величину мембранного потенциала.
Во-вторых, степень вклада каждого из этих ионов в величину мембранного потенциала пропорциональна проницаемости мембраны для этого иона. Так, если мембрана имеет нулевую проницаемость для ионов калия и хлора, мембранный потенциал полностью определяется только градиентом концентрации ионов натрия, и результирующий потенциал равен потенциалу Нернста для натрия. Это справедливо для любого из двух других ионов, если мембрана избирательно проницаема только для одного из них.
В-третьих, градиент концентрации положительного иона, направленный изнутри наружу, ведет к появлению отрицательного заряда внутри клетки. Это связано с тем, что при более высокой концентрации положительных ионов с внутренней стороны мембраны по сравнению с наружной стороной их избыток диффундирует наружу. При этом положительные заряды выходят наружу, а не способные к диффузии анионы остаются внутри клетки, создавая электроотрицательность с внутренней стороны мембраны. Если существует градиент для отрицательно заряженного аниона, возникает противоположный эффект. Например, избыток анионов хлора снаружи ведет к появлению отрицательного заряда внутри клетки, поскольку отрицательно заряженные ионы хлора диффундируют внутрь клетки, оставляя снаружи не способные к диффузии положительные ионы.
В-четвертых, проницаемость натриевых и калиевых каналов подвергается быстрым изменениям во время передачи нервных импульсов, тогда как проницаемость хлорных каналов во время этого процесса существенно не меняется. Следовательно, за передачу сигналов в нервных волокнах ответственны главным образом быстрые изменения натриевой и калиевой проницаемости.
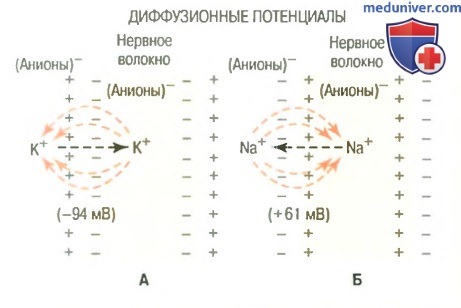
Б. Установление диффузионного потенциала, если мембрана нервного волокна проницаема только для ионов натрия. Обратите внимание, что внутренняя сторона мембраны отрицательна, когда диффундируют ионы калия, и положительна, когда диффундируют ионы натрия, из-за противоположных градиентов концентрации этих двух ионов.
Измерение мембранного потенциала клетки
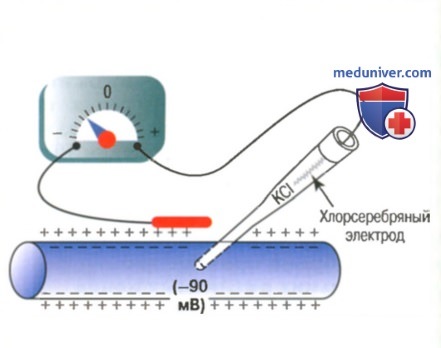
Метод измерения мембранного потенциала теоретически прост, однако его осуществление на практике часто бывает сложным из-за малого размера большинства волокон. Клеточную мембрану прокалывают насквозь пипеткой и вводят ее внутрь волокна. Другой электрод, называемый индифферентным, располагают во внеклеточной жидкости, и с помощью соответствующего вольтметра измеряют разность потенциалов между внутренней и наружной сторонами мембраны. Вольтметр представляет собой весьма сложное электронное устройство, которое позволяет измерять очень малые напряжения, несмотря на чрезвычайно высокое сопротивление электрическому току кончика микропипетки, диаметр которого — менее 1 мкм, а сопротивление — более 1 млн Ом. Для регистрации быстрых изменений мембранного потенциала при передаче нервных импульсов микроэлектрод соединяют с осциллоскопом.
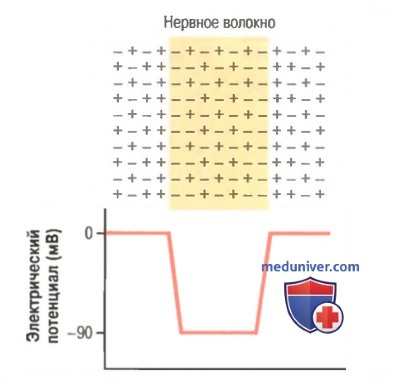
Нижняя часть рисунка демонстрирует величину электрического потенциала, измеряемого в любой точке внутри нервного волокна или у его мембраны (на рисунке слева направо). Пока электрод находится снаружи мембраны нервного волокна, регистрируется нулевой потенциал, соответствующий потенциалу внеклеточной жидкости. Затем при прохождении регистрирующего электрода через зону изменения напряжения на клеточной мембране (так называемый электрический дипольный слои) потенциал резко снижается до -90 мВ. Во время движения электрода через центр волокна величина потенциала остается на постоянном уровне -90 мВ, однако возвращается к нулю в момент прохождения электрода через мембрану на противоположную сторону волокна.
Чтобы зарядить мембрану отрицательно изнутри, нужно транспортировать наружу положительные ионы в количестве, достаточном лишь для развития электрического дипольного слоя на самой мембране. Все остальные ионы внутри нервного волокна могут быть и положительными, и отрицательными. Следовательно, для установления нормального потенциала покоя величиной в -90 мВ внутри нервного волокна через мембрану должно перейти очень небольшое число ионов, т.е. около 1/3000000 — 1/100000000 общего числа положительных зарядов внутри волокна. Соответственно, перемещение столь же небольшого числа положительных ионов снаружи внутрь волокна может обеспечить изменение (реверсию) потенциала от -90 мВ до +35 мВ менее чем за 1/10000 сек.
Источник
Методы измерения мембранного потенциала
Одна из важнейших функций биологической мембраны — генерация и передача биопотенциалов. Это явление лежит в основе возбудимости клеток, регуляции внутриклеточных процессов, работы нервной системы, регуляции мышечного сокращения, рецепции. В медицине на исследовании электрических полей, созданных биопотенциалами органов и тканей, основаны диагностические методы: электрокардиография, электроэнцефалография, электромиография и другие. Практикуется и лечебное воздействие на ткани и органы внешними электрическими импульсами при электростимуляции.
В процессе жизнедеятельности в клетках и тканях могут возникать разности электрических потенциалов:
1) окислительно-восстановительные потенциалы — вследствие переноса электронов от одних молекул к другим;
2) мембранные — вследствие градиента концентрации ионов и переноса ионов через мембрану.
Биопотенциалы, регистрируемые в организме, — это в основном мембранные потенциалы.
Мембранным потенциалом называется разность потенциалов между внутренней (цитоплазматической) и наружной поверхностями мембраны:

В дальнейшем для упрощения написания формул величину 

Прогресс в исследовании биопотенциалов обусловлен:
1) разработкой микроэлектродного метода внутриклеточного измерения потенциалов;
2) созданием специальных усилителей биопотенциалов (УПТ);
3) выбором удачных объектов исследования крупных клеток и среди них гигантского аксона кальмара. Диаметр аксона кальмара достигает 0,5 мм, что в 100-1000 больше, чем диаметр аксонов позвоночных животных, в том числе человека. Гигантские, в сравнении с позвоночными, размеры аксона этого проворного и ловкого головоногого моллюска имеют большое физиологическое значение — обеспечивают быструю передачу нервного импульса по нервному волокну.
Для биофизики гигантский аксон кальмара послужил великолепным модельным объектом для изучения биопотенциалов (недаром выдвигались предложения поставить памятник кальмару — животному, которому так многим обязана наука, подобно существующим памятникам лягушке в Париже и собаке под Санкт-Петербургом).
В гигантский аксон кальмара можно ввести микроэлектрод, не нанеся аксону значительных повреждений.
Стеклянный микроэлектрод (1) представляет собой стеклянную микропипетку с оттянутым очень тонким кончиком (диаметр 0,1-0,5 мкм).
Металлический электрод такой толщины пластичен, и не может проколоть клеточную мембрану, кроме того, он поляризуется. Для исключения поляризации электрода используются неполяризующиеся электроды, например, серебряная проволока (3), покрытая солью 


 |
Второй электрод (4) для сравнения — располагается в растворе (6) у наружной поверхности клетки (5) (рис. 11). Регистрирующее устройство осциллограф.
Микроэлектродный метод дал возможность измерить биопотенциалы не только на гигантском аксоне кальмара, но и на клетках нормальных размеров: нервных волокнах других животных, клетках скелетных мышц, клетках миокарда и других.
Другим эффективным методом измерения потенциала мембраны стал метод локальной фиксации потенциала («Patch Clamp»). Суть метода заключается в том, что микроэлектрод тонким концом, имеющим диаметр 0,5-1 мкм, присасывается к мембране таким образом, чтобы в его внутренний диаметр попал ионный канал. Тогда, используя схему фиксации потенциала, можно измерять токи, которые проходят только через одиночный канал мембраны, а не через все каналы одновременно, как это происходит при использовании стандартного метода фиксации потенциала, описанного выше.
Элемент Нернста
Природа биоэлектрогенеза была понятна лишь после создания теории электрической диссоциации (С.Аррениус 1887г.). Опыт многих исследователей убеждает, что в живых тканях, которые могут рассматриваться как растворы электролитов, генерация потенциала связана с неравномерным распределением ионов.
Самой простой и адекватной моделью является элемент Нернста (Рис.12.). Сосуд, в котором находится растворы одной и той же соли, но разной концентрации, разделен пористой перегородкой (C1 > C2). Вследствие разницы концентрации, ионы диффундируют, причем один из ионов, как правило, катион диффундирует быстрее и более разбавленный раствор приобретает знак катиона. По обе стороны перегородки образуется разность потенциалов, которую называют диффузионной разностью потенциалов.
При этом ЭДС, возникающая в концентрационном элементе, образованном раствором одной соли, определяется из уравнения Нернста.




В реальных условиях, в клетке, разница скорости движения анионов и катионов обусловлена присутствием полупроницаемой мембраны. Без нее ЭДС концентрированного элемента быстро падает. Поэтому потенциалы, возникающие в таком элементе, называются не диффузионными, а мембранными.
 |
Теория электролитической диссоциации была впервые применена и объяснена в механизме биоэлектрогенеза В.Ю.Чаговцем (1896) слушателям ВМА, в дальнейшем развил учение Ю.Бернштейн и лауреаты Нобелевской премии (Ходжкин, Кац, Хакси).
Потенциал покоя.
Установлено, что цитоплазма клеток существенно отличается по химическому составу от внеклеточной жидкости, находящейся в межклеточном пространстве (рис. 13.)
| Ионы | Среда |
| Внеклеточная | Внутриклеточная |
| K + | |
| Na + | |
| Cl — |
Рис. 13. Относительная концентрация ионов внутри и вне клетки.
Разность ионных концентраций создает силу, стремящуюся выровнять содержание ионов, но мембрана препятствует этому процессу. Мембраны обеспечивают избирательную проницаемость для различных ионов. Вследствие этого в тканях наблюдается неодинаковая скорость диффузии через клеточные мембраны катионов и анионов, что при наличии концентрационных градиентов служит непосредственной причиной возникновения мембранных потенциалов. Их называют биопотенциалами.
Таким образом, источником электричества в живой ткани служит концентрационный элемент, образованный растворами электролита, имеющего неодинаковую концентрацию в цитоплазме и межклеточной жидкостью. При рассмотрении живых тканей в качестве концентрационного элемента необходимо учитывать диффузию через клеточную мембрану не одного иона, а всех, концентрации которых неодинаковы внутри и вне клетки. Это обстоятельство учитывает уравнение Гольдмана-Ходжкина-Катца.

в числителе выражения, стоящего под знаком логарифма, представлены концентрации 






Уравнение Гольдмана позволяет рассчитать разность потенциалов, существующую в разных клетках между цитоплазмой и межклеточной средой в покое и при возбуждении.
Потенциал покоя — стационарная разность электрических потенциалов, регистрируемая между внутренней и наружной поверхностями мембраны в невозбужденном состоянии.
Потенциал покоя определяется разной концентрацией ионов по разные стороны мембраны и диффузией ионов через мембрану. Результаты расчетов приблизительно совпадают с величинами мембранных потенциалов, полученными опытным путем. Проанализируем уравнение Гольдмана в состояние покоя:
В состоянии покоя проницаемость мембраны для ионов 


Для аксона кальмара, например,


Таким образом, уравнение Нернста — частный случай уравнения Гольдмана. При концентрации 
















Этим и обеспечивается состояние покоя и готовность клетки к возбуждению. Избирательная проницаемость плазматической мембраны всякой клетки контролирует стабильное разобщение катионов и анионов, вследствие чего на ней стойко поддерживается высокий градиент потенциала и тем самым плазматическая мембрана генерирует ЭДС. Эта ЭДС направлена против причины, ее вызывающей, и противодействует дальнейшему разобщению зарядов на мембране, т.е. выравниванию концентраций между цитоплазмой и межклеточной средой. Существование ионных градиентов на мембранах связано также с работой активного транспорта, и является энергоемким процессом.
Нарушение биоэнергетических процессов в клетке и работы 

Повреждение клеточной мембраны приводит к повышению проницаемости клеточных мембран для всех ионов: к повышению и 



Для сильно поврежденных клеток 
Потенциал действия
Все клетки возбудимых тканей при действии различных раздражителей достаточной силы переходят в состояние возбуждения. Возбудимость — это способность клеток к быстрому ответу на раздражение, проявляющаяся через совокупность физических, физико-химических процессов и функциональных изменений. Обязательным признаком возбуждения является изменение электрического состояния клеточной мембраны. Опыт показывает, что возбужденный участок клетки становится электроотрицательным по отношению к невозбужденному, что указывает на перераспределение ионов в возбужденном участке. Оно имеет временный характер.
Общее изменение разности потенциалов между клеткой и средой, происходящее при возбуждении, называется потенциалом действия. Бернштейн полагал, что при возбуждении мембрана становится проницаемой для всех ионов. Новые градиенты исчезают, разность потенциалов на мембране уменьшается до нуля. Однако при измерении микроэлектродом оказалось, что разность потенциалов не только падает до нуля, но и продолжает изменяться дальше и достигает значительной величины.
Современная теория потенциала действия базируется на данных, полученных методами внутриклеточного отведения, фиксации напряжения на мембране и использованием радиоактивных изотопов. Потенциал действия (ПД), или потенциал возбуждения нервных клеток (волокон), возникает в ответ на достаточное по силе раздражение. ПД — очень быстрый, кратковременный электрический процесс, поэтому для его регистрации необходим катодный осциллограф с широкополосным усилителем.
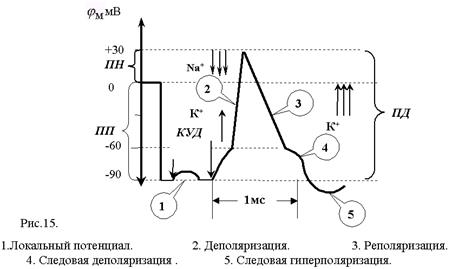
Классическое исследование параметров и механизма ПД проделано на гигантском аксоне кальмара с внутриклеточным раздражением и отведением внутриклеточного потенциала. В это нервное волокно (диаметром 0,5-1 мм) вводили на всю его длину два тончайших проволочных электрода. Один из них был раздражающим: через него в волокно подавали толчки тока того или иного направления, другой регистрировал электрический потенциал. При подаче короткого и слабого толчка выходящего тока внутриклеточный электрод регистрировал кратковременное падение МП, по форме и силе соответствующее толчку тока, но со сглаженными передним и задним фронтами, что определяется емкостью мембраны. Это так называемый локальный потенциал. Локальным он называется потому, что и в экспериментальных, и в естественных уровнях он не распространяется далеко. При усилении стимула и достижении порога раздражения, т.е. критического уровня деполяризации (КУД), возникает потенциал действия (рис.15). При толчке входящего тока любой величины образуется только электротонический
потенциал.
В потенциале действия различают пик (спайк) и следовые потенциалы.
Пик ПД представляет собой кратковременную инверсию (изменение знака на положительный) внутриклеточного потенциала. Он имеет очень быструю восходящую фазу и несколько более медленный спад. Общая длительность пика в данном объекте составляет около 3мс, амплитуда пика 120мВ, т.е. превышает МПП (90 мВ) на 30 мВ. Эту разницу называют овершутом или амплитудой потенциала инверсии.
Вслед за пиком ПД регистрируются значительно более слабые и длительные отрицательный и далее положительный следовой потенциалы (рис.15).
|
Потенциал действия имеет стандартные амплитуду и временные параметры, не зависящие от силы стимула, вызвавшего данный ПД (правило «все или ничего»).
Потенциал действия — это электрический феномен, возникающий на плазматической мембране. Практически нормальный ПД возникает и в перфузируемом гигантском аксоне, лишенном аксоплазмы, при электрической стимуляции его мембраны.
Причиной развития ПД является вызываемое критической деполяризацией мембраны открытие ее натриевых и калиевых каналов. Каналы, открываемые электрическим стимулом, называют потенциалзависимыми.
Открытие потенциалзависимых каналов приводит к пассивному движению соответствующих ионов по их электрохимическим градиентам.
Вход ионов 

При развитии пика ПД отношение 







Подробный анализ изменений мембранной проницаемости для ионов 

 |
 |
В процессе развития ПД действуют многие факторы, связанные прямыми и обратными связями. Например, на восходящей фазе ПД действует система факторов с положительной обратной связью (рис.16).
Здесь деполяризация увеличивает 



На спаде ПД при реполяризации для тока 
В итоге спад тока 
Отрицательный следовой потенциал связан с остаточным током 




Пик ПД — весьма экономичный сигнал, практически не нарушающий ионных градиентов на мембране, энергией которых он питается.
Ионные градиенты на мембране — это «пружина», энергии которой может хватить на 
Рассмотрим локальный подпороговый ответ (ЛО) в нервной клетке. Этот ответ обладает в основном тем же механизмом, что и ПД. Его восходящая фаза определяется входящим током Na, а нисходящая — выходящим током 
Амплитуда ЛО пропорциональна силе раздражителя, а не стандартна, как у ПД, т.е. он не подчиняется правилу «все или ничего».
Рассчитаем равновесный электрохимический потенциал для натрия при возбуждении:
т.е. по сравнению с невозбужденным состоянием при возбуждении коэффициент проницаемости возрастает в 750 раз, т.к. 
В опытах было доказано, что этот равновесный потенциал совпадает с амплитудным значением потенциала инверсии. ПИ всегда положителен, но меньше по абсолютной величине, чем потенциал покоя. ПД равен сумме ПП и ПИ.
Натриевый механизм потенциала действия подтверждают опыты, связанные с изменением концентрации натрия во внешней среде. При удалении ионов натрия из внеклеточной среды приводит к тому, что при стимуляции нервной клетки ПД не
возникает.
Характерные свойства потенциала действия:
1. Наличие порогового значения деполяризующего потенциала.
2. Закон «все или ничего», т.е., если деполяризующий потенциал больше порогового, развивается потенциал действия, амплитуда которого не зависит от амплитуды возбуждающего импульса и нет потенциала действия, если амплитуда деполяризующего потенциала меньше пороговой.
3. Наличие периода рефрактерности, невозбудимости мембраны во время развития потенциала действия и остаточных явлений после снятия возбуждения.
4. Резкое уменьшение сопротивления мембраны в момент возбуждения (у аксона кальмара от 0,1 

Итак, генерация потенциала действия в возбужденных мембранах возникает под влиянием различных факторов и сопровождается в первую очередь повышением проводимости клеточной мембраны для ионов натрия, входом их внутрь клетки, что приводит к деполяризации клеточной мембраны и появлению локального ответа. Этот процесс может достигнуть критического уровня деполяризации, после чего проводимость мембраны для натрия увеличивается до максимума, мембранный потенциал при этом приближается к натриевому равновесному потенциалу. Приблизительно через десять миллисекунд происходит инактивация натриевых каналов. Увеличивается активация калиевых каналов, что приводит к увеличению выходящего калиевого тока, который в свою очередь вызывает реполяризацию и в дальнейшем восстановление потенциала покоя.
Физиологическая роль ПД в потенциалзависимых клетках не ограничивается только возбудимостью клеточной мембраны и проведением нервного импульса. Возникновение ПД сопровождает целый комплекс информационных процессов, которые развиваются в ответ на стимуляцию на фоне ПД. Среди этих процессов следует назвать такие как: 1) изменение обмена веществ, 2) саморегуляция температуры и электрического импеданса, а так же других важных физиологических констант организма.
Источник