- Маркировка функции виды способы нанесения лекарственных средств
- Виды и правила маркировки лекарственных препаратов
- Виды маркировки лекарственных средств
- Основные требования к упаковке лекарственных средств
- Особенности и правила упаковки и маркировки лекарственных средств
- Маркировка лекарств: виды и способы нанесения идентификационных знаков на упаковку
- Различия контрольных идентификационных знаков
- Основные способы нанесения
- Различия методов нанесения
Маркировка функции виды способы нанесения лекарственных средств
Статья 46. Маркировка лекарственных средств
1. Лекарственные препараты, за исключением лекарственных препаратов, изготовленных аптечными организациями, ветеринарными аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность, должны поступать в обращение, если:
1) на их первичной упаковке (за исключением первичной упаковки лекарственных растительных препаратов) хорошо читаемым шрифтом на русском языке указаны наименование лекарственного препарата (международное непатентованное, или группировочное, или химическое, или торговое наименование), номер серии, дата выпуска (для иммунобиологических лекарственных препаратов), срок годности, дозировка или концентрация, объем, активность в единицах действия или количество доз;
(в ред. Федеральных законов от 11.10.2010 N 271-ФЗ, от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
2) на их вторичной (потребительской) упаковке хорошо читаемым шрифтом на русском языке указаны наименование лекарственного препарата (международное непатентованное, или группировочное, или химическое и торговое наименования), наименование производителя лекарственного препарата, номер серии, дата выпуска (для иммунобиологических лекарственных препаратов), номер регистрационного удостоверения, срок годности, способ применения, дозировка или концентрация, объем, активность в единицах действия либо количество доз в упаковке, лекарственная форма, условия отпуска, условия хранения, предупредительные надписи.
(в ред. Федеральных законов от 11.10.2010 N 271-ФЗ, от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
2. Фармацевтические субстанции должны поступать в обращение, если на их первичной упаковке хорошо читаемым шрифтом на русском языке указаны наименование фармацевтической субстанции (международное непатентованное, или группировочное, или химическое и торговое наименования), наименование производителя фармацевтической субстанции, номер серии и дата изготовления, количество в упаковке и единицы измерения количества, срок годности и условия хранения.
(в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
3. Лекарственные средства в качестве сывороток должны поступать в обращение с указанием животного, из крови, плазмы крови, органов и тканей которого они получены.
4. На вторичную (потребительскую) упаковку лекарственных средств, полученных из крови, плазмы крови, органов и тканей человека, должна наноситься надпись: «Антитела к ВИЧ-1, ВИЧ-2, к вирусу гепатита C и поверхностный антиген вируса гепатита B отсутствуют».
5. На первичную упаковку и вторичную (потребительскую) упаковку радиофармацевтических лекарственных средств должен наноситься знак радиационной опасности.
6. На вторичную (потребительскую) упаковку гомеопатических лекарственных препаратов должна наноситься надпись: «Гомеопатический».
7. На вторичную (потребительскую) упаковку лекарственных растительных препаратов должна наноситься надпись: «Продукция прошла радиационный контроль».
8. На первичную упаковку (если для этого существует техническая возможность) и вторичную (потребительскую) упаковку лекарственных препаратов, предназначенных для клинических исследований, должна наноситься надпись: «Для клинических исследований».
(в ред. Федерального закона от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
9. Упаковка лекарственных средств, предназначенных исключительно для экспорта, маркируется в соответствии с требованиями страны-импортера.
10. На транспортную тару, которая не предназначена для потребителей и в которую помещено лекарственное средство, должна наноситься информация о наименовании, серии лекарственного средства, дате выпуска, количестве вторичных (потребительских) упаковок лекарственного средства, производителе лекарственного средства с указанием наименования и местонахождения производителя лекарственного средства (адрес, в том числе страна и (или) место производства лекарственного средства), а также о сроке годности лекарственного средства и об условиях его хранения и перевозки, необходимые предупредительные надписи и манипуляторные знаки.
11. На первичную упаковку и вторичную (потребительскую) упаковку лекарственных средств для ветеринарного применения должна наноситься надпись: «Для ветеринарного применения».
12. На вторичную (потребительскую) упаковку лекарственного препарата наносится штриховой код.
Источник
Виды и правила маркировки лекарственных препаратов
Законодателем был разработан и утвержден приоритетный проект «Внедрение автоматизированной системы мониторинга движения фармпродукции». В прошлом году все субъекты рынка участвовали в добровольном эксперименте, в этом же году была введена обязательная маркировка ЛП. Благодаря данной системе можно будет производить мониторинг движения фармацевтической продукции на всех этапах от производства до сбыта.
Маркировка ЛП представляет собой нанесение специального кода и занесение его в единую информационную базу. Государство в лице надзорных структур сможет отслеживать, какая компания выпустила фармпродукт, в каком объеме и когда. Идентификация позволит всем субъектам рынка, от дистрибьюторов до продавцов и потребителей, определять подлинность продукции, срок изготовления, производителя и уникальный номер ЛП.
Виды маркировки лекарственных средств
Товарный знак. Позволяет дифференцировать фармпродукцию от товаров конкурирующих холдингов и предприятий.
- Штрих-код. Специальное кодовое значение, которое содержит подробные сведения о физико-химических особенностях товара и его стоимости.
- Знак качества. Свидетельствует о том, что фармпродукция полностью соответствует утвержденным стандартам.
По правилам маркировки лекарственных средств, идентификация состоит из трехкомпонентной структуры: текста, рисунка и информационных знаков. Соблюдение требований к упаковке лекарственных препаратов позволит на ранней стадии выявить фальсификат и извлечь из оборота продукцию с истекшим сроком годности. При ведении маркировки ЛС производителям не нужно будет покупать у дистрибьюторов информацию о том, где и сколько реализовано фармпрепаратов. Производственные концерны смогут бесплатно получать информацию из единой базы, что поможет грамотно планировать производственные процессы и минимизировать затраты на услуги медпредставителей.
Основные требования к упаковке лекарственных средств
- Первичная упаковка. В ней должно содержаться торговое название ЛП, не патентованное наименование международного образца, фармацевтическая форма, дозировка активного лекарственного компонента, методика введения фармпрепарата, данные владельца регистрационного документа, серийный номер и срок действия ЛС.
- Вторичная упаковка. Включает в себя требуемые по закону сведения. К ним относится название фармпродукта, наименование международного образца, данные владельца регистрационного документа и производственного предприятия, фактические данные местонахождения производителя, фармацевтическая форма, дозировка активной формы лекарственной субстанции, данные о составе ЛП, серийный номер, дата производства, срок годности фармпродукции, особенности транспортировки и реализации, предупреждающие надписи.
- Транспортная тара. Здесь указывается название ЛС, фармацевтическая форма, общепринятое международное наименование, дозировка активного лекарственного компонента, данные о производственном концерне, количество ЛП в упаковочной системе и таре, особенности условий транспортировки, срок действия фармпродукта, серийные данные. Дополнительно указывают логотип предприятия и предупреждающую информацию.
В качестве носителей маркировочных данных выступают этикетки, вкладыши, бирки, штампы и контрольные ленты. Маркировка лекарственных препаратов должна производиться в соответствии с требованиями федеральных законов и нормативных документов. Это позволяет соблюсти основные условия идентификации ЛС и полностью вывести из оборота контрафактные и недоброкачественные фармпрепараты.
Особенности и правила упаковки и маркировки лекарственных средств
- Название фармпродукта на упаковочной системе прописывается всегда в именительном падеже.
- На вторичной упаковке законодатель разрешает фиксировать допинформацию при условии ее соответствия утвержденной законодателем документации.
- Разрешается размещать на упаковке оригинальную голографическую информацию и всевозможные стикеры, которые необходимы для того, чтобы выделить фармпродукцию на фоне других ЛС.
- МНН препарата должно прописываться на двух языках — английском и русском.
- При совпадении данных производственного концерна и владельца регистрационного удостоверения прописываются данные последнего.
- На первичную упаковку наносятся данные о сроке действия ЛП. При указании месяца подразумевается всегда последнее число месяца, например, если препарат годен до 08.2018, это значит, что его можно использовать до конца августа.
- Предупреждающие надписи должны содержать следующие данные: «Стерильно», «Фармпродукт прошел радиационный контроль», «Хранить в недоступном для детей месте» и т.д.
- Методика нанесения маркировочных данных должна содействовать их полной сохранности в течение всего периода использования ЛП.
В согласии с описанием основных положений законодателя к упаковке и маркировке лекарственных средств, необходимо использовать подходящий цвет идентификации с целью визуального различия продукции. Использование одной и той же цветовой гаммы для первичной и вторичной упаковки позволит дополнительно идентифицировать фармпродукт при перемещении и транспортировке. Следует отметить, что при маркировочных операциях не допускается нанесение выборочных сведений по своему усмотрению. Необходимо прописать все данные в согласии с основными положениями закона и дополнительными рекомендациями регулятора.
Мы рассмотрели основные требования к упаковке лекарственных средств в соответствии с приказом. Более подробную информацию руководители производственных концернов и предприятий могут получить в методических рекомендациях. В них указаны правила кодирования, требования к информационной системе и оборудованию, порядок регистрации участников системы и внесения данных в базу. Следование данным рекомендациям позволит избежать сбыта контрафактной продукции и поможет защитить безупречную репутацию брендовых фармпрепаратов, которые пользуются спросом среди потребителей.
Компания ООО «Меридиан» подготовила уникальное оборудование для производителей лекарственных препаратов по нанесению маркировки на лекарства и агрегированию вторичной упаковки в третичную с автоматической подготовкой информации для базы данных федеральной государственной информационной системы мониторинга движения лекарственных средств.
Источник
Маркировка лекарств: виды и способы нанесения идентификационных знаков на упаковку
На вебинаре компании «Катрен» 17 августа разработчики системы маркировки ЛС рассказали о том, как правильно наносить идентификационные знаки на упаковку лекарств.
В середине августа онлайн-журнал для врачей и фармацевтов «Катрен-Стиль» совместно с Росздравнадзором и компанией «ЦентрИнформ» провел очередной вебинар, посвященный теме пилотного проекта маркировки лекарственных средств. Руководитель проектного офиса управления федеральных проектов и советник генерального директора «ЦентрИнформ» Дмитрий Скорчеллетти рассказал участникам вебинара о способах нанесения идентификационного знака на продукцию.
О том, какая информация должна быть представлена на контрольных идентификационных знаках (КИЗ), подробно описано в методических рекомендациях Росздравнадзора. Однако само нанесение знака маркировки может производиться несколькими способами: это может быть прямая печать или печать на вторичном носителе (этикетке).
Для начала стоит рассказать об основных требованиях к нанесению и оборудованию. Сам контрольно-идентификационный знак должен наноситься с уровнем качества класса С или выше в соответствии со стандартом ИСО 15415 (ГОСТ Р ИСО/МЭК 15415-2012). При его нанесении должна применяться печать с использованием метода коррекции ошибок ЕСС-200. ASCII-кодирование должно быть на основе стандарта ИСО 16022 (ГОСТ Р ИСО/МЭК 16022-2008).
Оборудование для считывания нанесенных кодов должно соответствовать следующим стандартам: ИСО 15415, ГОСТ Р ИСО/МЭК 15415-2012. Кроме этого существует более подробный список ГОСТов и международных стандартов, который должен учитываться при нанесении КИЗ. Подробный разбор ГОСТов можно посмотреть в записи вебинара о валидации оборудования.
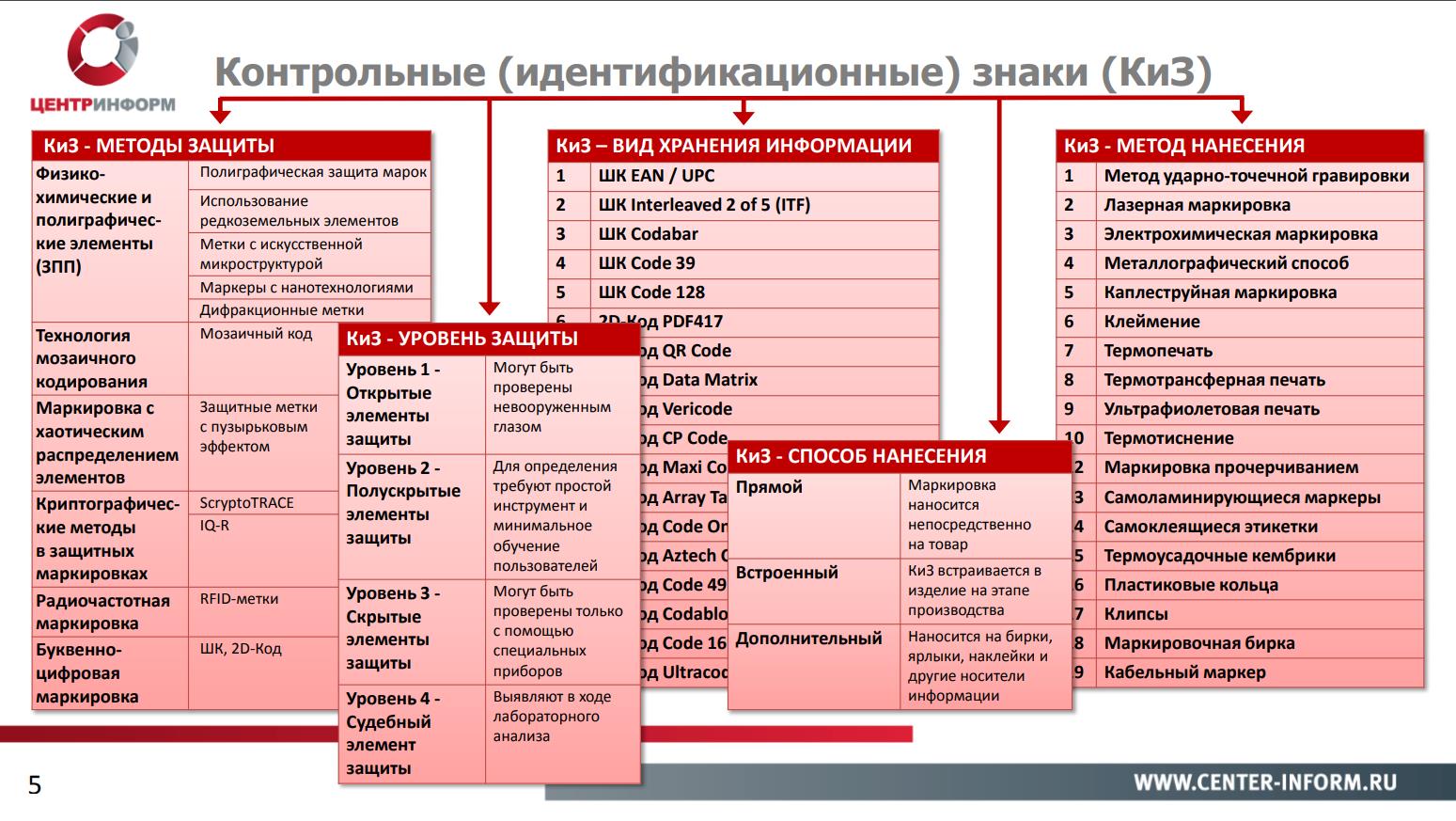
Различия контрольных идентификационных знаков
Есть несколько аспектов, важных в разговоре о КИЗ. Речь здесь идет об уровнях и методах защиты, способах нанесения, а также виде хранения информации.
Маркировка может наноситься прямым способом (когда КИЗ наносится непосредственно на сам товар), встроенным (КИЗ встраивается в изделие на этапе производства) и дополнительным (КИЗ наносится на бирки, наклейки и другие носители информации).
Уровень защищенности идентификационных знаков может варьировать от открытых элементов защиты (когда они могут быть проверены невооруженным глазом) до скрытых и судебных элементов (для проверки таких методов защиты необходимо специальное оборудование или проведение лабораторного анализа).
Отметим, что на данный этап определенных требований к минимальному уровню защищенности нет. Скорее всего, это будет класс не ниже уровня B, т. е. КИЗ должен содержать не менее трех элементов защиты.
Основные способы нанесения
В пилотном проекте будут применяться два основных способа нанесения маркировки на вторичную упаковку ЛС: непосредственная печать на упаковке и печать на этикетке с последующим переносом на упаковку с помощью принтера-аппликатора.
Для нанесения (как на упаковку, так и на вторичный носитель) могут использоваться следующие технологии печати:
Термоструйные принтеры – бесконтактная печать, основанная на нагреве чернил для их переноса на поверхность упаковки. Обычно используется для печати двумерных кодов DataMatrix и других штриховых кодов.
Термотрансферная печать – печатающая головка с цифровым управлением нагревает и переносит краску с риббона непосредственно на гибкие пленки, что позволяет наносить изображения с высоким разрешением.
Системы лазерной̆ маркировки – лазерный луч создает изображение за счет теплового воздействия на поверхность упаковки.
Каплеструйная печать – печать чернилами до пяти строк текста и двумерных штриховых кодов на различных упаковочных материалах.
Различия методов нанесения
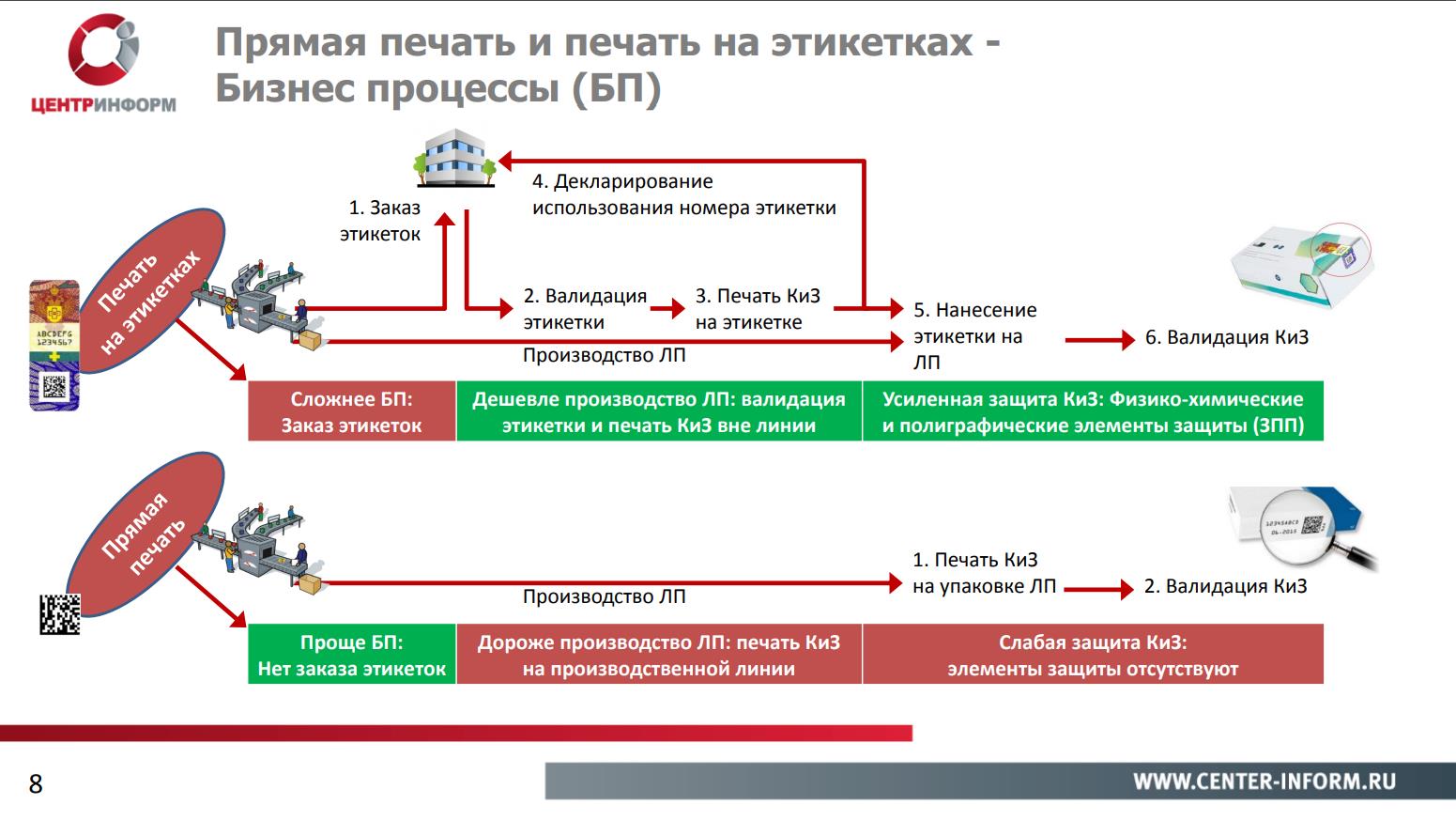
При более детальном сравнении прямой печати и печати на этикетках у этих способов можно найти как плюсы, так и минусы.
Печать на этикетках является более сложным бизнес-процессом. Потому что создание этикеток будет выполнять отдельная лицензированная организация. В этом плане печать маркировки на самой упаковке проще: необходимо лишь установить специальное оборудование на производственной линии.
Однако здесь кроется еще одно различие : стоимость производства лекарственного препарата. Установка оборудования на линию производства намного более затратна, чем печать этикетки третьей стороной.
Кроме этого КИЗ, напечатанные на упаковке, будут иметь меньший уровень защиты, чем напечатанные на этикетке. Поскольку печать этикеток будет производиться сертифицированными изготовителями полиграфической продукции, то на этикетке могут быть размещены различные полиграфические и физико-химические элементы защиты, что невозможно в условиях печати на производстве.
В мировой практике распространены оба способа нанесения маркировки. Однако печати на этикетках отдается большее предпочтение в странах Европейского союза и Арабских Эмиратов как более надежной технологии защиты от контрафакта.
Печать КИЗ на этикетке также может служить защитой от вскрытия. Этикетка с маркировкой может быть нанесена на упаковку таким образом, что при вскрытии она будет повреждена. Другими словами, выполнять роль своеобразной пломбы.
Стоит отметить, что на сегодняшний день в методических рекомендациях нет уточнений по поводу использования этикетки как пломбы контроля вскрытия. На данном этапе это остается на усмотрение производителя.
Источник

 Товарный знак. Позволяет дифференцировать фармпродукцию от товаров конкурирующих холдингов и предприятий.
Товарный знак. Позволяет дифференцировать фармпродукцию от товаров конкурирующих холдингов и предприятий.