- Магний: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- Технология производствa магния.
- Электролитическое получение магния
- Плавкость магния
- Плотность магния
- Электропроводность электролита магния
- Напряжение разложения компонентов электролита
- Вязкость и поверхностное натяжение магния
- Температура электролиза магния
- Растворимость магния в электролите
- Состав электролита магния
- Показатели электролиза магния
- Похожие страницы:
Магний: способы получения и химические свойства
Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Источник
Технология производствa магния.



Основной способ производства магния — электролитический. Электролитическое получение магния из водных растворов невозможно, так как электрохимический потенциал магния значительно более отрицательный, чем потенциал разряда ионов водорода на катоде. Поэтому электролиз магния ведут из его расплавленных солей.
Основная составляющая электролита — хлористый магний МgCl2, а для снижения температуры плавления электролита и повышения его электропровод-ности в него вводят NаСl, СаСl2, КСl и небольшие количества NaF и СаF2.
Основным сырьем для получения магния являются карналлит (МgСl2•КСl•6Н2О), магнезит (МgСО3), доломит (СаСО3•МgСО3), бишофит (МgСl2•6Н2О). Карналлит — это природный хлорид магния и калия MgCl2 • КСl • 6Н2O. Бишофит (MgCl2 • 6Н2O) получается при переработке карналлита или выпари-вается из воды соленых озер и морей. Наибольшее количество магния получают из карналлита.
Основные этапы производства магния:
1.Карналлит;
2. Обогащение карналлита;
3. Обезвоживание карналлита;
4. Электролитическое получение магния;
5. Рафинирование магния;
6. Магний.
Обогащение карналлита является первой стадией его переработки. Сущность процесса обогащения сводится к отделению КСl и нерастворимых примесей путем перевода в водный раствор МgСl2 и КСl. При охлаждении полученного раствора в вакуум-кристаллизаторах выпадают кристаллы искусственного карналлита МgСl2•КСl•6Н2О, которые отделяют фильтрованием.
Карналлит обезвоживают в две стадии. Первую стадию проводят в трубчатых печах или печах кипящего слоя при 550—600° С. Под действием теплоты нагретых газов карналлит обезвоживается и после такой обработки содержит 3—4% влаги.
Вторую стадию обезвоживания осуществляют либо плавкой полученного после первой стадии карналлита в электропечах с последующим отстаиванием окиси магния, либо хлорированием карналлита в расплавленном состоянии.
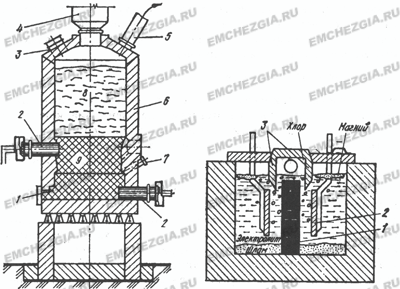
Этот способ производства хлорида магния заключается в хлорировании магнезита или оксида магния, получаемого путем предварительного обжига магнезита. Процесс ведут в шахтных электрических печах. В нижней части (рис. 1) расположены в два ряда электроды 2; между ними находятся угольные брикеты, которые при прохождении электрического тока нагреваются до
750 °С. Шихту загружают сверху, через фурмы 7 вдувают хлор.
У фурм происходит хлорирование оксида магния: MgO + Сl2 + С = MgCl2 + СО. Хлористый магний плавится и скапливается на подине, периодически его выпускают в ковш и транспортируют в электролизный цех.
Рисунок 1. Рисунок 2.
Шахтная печь для производства магния: . Схема магниевого диафрагменного
1 — летка; 2 — угольные электроды; электролизера.
3 — ремонтный люк;
4 — загрузочное устройство;
б — футеровка; 7 — хлорные фурмы;
8 — шихта; 9 — угольные брикеты
Электролитическое получение магния. Для этой цели применяют электролизер (рисунок 2), который изнутри футерован шамотным кирпичом. Анодами служат графитовые пластины 1, а катодами — стальные пластины 2, расположенные по обе стороны анода.
Для электролитического разложения хлористого магния через электролит пропускают ток под напряжением 2,7—2,8 В.
Электролитическое получение магния осуществляют в электролизере (рис. 2). Анодами служат графитовые пластины 1, а катодами — стальные пластины 2. Удельная плотность магния меньше удельной плотности электролита, и поэтому магний всплывает. Хлор, выделяемый на аноде, тоже всплывает. Чтобы избежать взаимодействия хлора с Mg, а также короткого замыкания анода и катода расплавленным магнием, вверху устанавливают специальную разделительную диафрагму 3.
Электролит состоит из МgСl2 (5—17 %), KCl, NaCl и добавок СаF2 и По мере расходования МgСl2 в электролизер периодически заливают жидкие карналлит либо хлористый магний. Электролиз ведут при 670—720 °С. На катоде выделяется магний: Мg2+ + 2е —>на аноде — газообразный хлор 2Cl- — 2е —> Cl2. Из электролизера откачивают хлор и 2—3 раза в сутки с помощью вакуум-ковшей с электрообогревом извлекают жидкий магний.
В процессе электролиза в электролите повышается концентрация других хлоридов за счет расходования МgСl2. Поэтому периодически часть отработанного электролита удаляют из ванны и вместо него заливают расплав МgСl2 или карналлита. В результате частичного разложения примесей на дне ванны образуется шлам, который регулярно удаляют из ванны.
Рафинирование магния. В электролизных ваннах получают черновой магний, который содержит 5% примесей: металлические примеси (Fе, Na, К, Аl, Са) и не металл примеси (МgСl2, КСl, NaCl, СаСl2, МgО). Магний очищают (рафинируют) переплавкой с флюсами.. Это наиболее распространенный способ, заключающийся в выдержке магния в печах сопротивления под слоем флюса. При этом происходит отстаивание (переход в осадок) запутавшихся в расплаве частиц электролита и шлама.
Источник
Электролитическое получение магния

Во избежание взаимодействия хлора и магния и короткого замыкания анода и катода расплавленным магнием вверху устанавливают перегородку 3, называемую диафрагмой. Расходуемый во время электролиза хлористый магний периодически вводят электролит.
Рис. Схема ячейки электролизера для получения магния
Собирающийся на поверхности катодного пространства магний периодически удаляют. Выделяющийся в анодном пространстве хлор отсасывают через трубу и используют, например, для хлорирования окиси магния.
Магний можно получить электролизом чистого расплавленного безводного хлористого магния, однако высокая температура плавления, низкая электропроводность и другие неблагоприятные свойства хлористого магния вынуждают прибегать к более сложным электролитам. Практически удобнее всего использовать карналлит, который обычно содержит в виде примеси хлористый натрий. Такой электролит обладает более низкой температурой плавления, более высокой электропроводнестью и меньше растворяет магний. Поэтому при работе с ним достигается более высокий выход по току и меньший расход электроэнергии.
Ниже приводятся сведения об основных свойствах электролитов.
Рис. 2. Диаграмма плавкости системы MgCl2—KCl
Плавкость магния
Температура плавления компонентов электролита следующая: 718° С — MgCl2; 768° С — КСl; 800° С — NaCl; 774° С — СаСl2.
Смеси этих солей плавятся при значительно более низких температурах, что иллюстрируется, например, двойной диаграм мой плавкости системы КСl—MgCl2 (рис.2). Возможности широко варьировать состав электролита особенно наглядно иллюстрирует диаграмма (рис.3).
Плотность магния
Плотность магния и карналлита находятся в пределах 1,6—1,7 г/см 3 , особенно они близки при температуре 700°С, наиболее удобной для электролиза. Аналогичная картина наблюдается и в тройных электролитах, содержащих MgCl2, КСl и NaCl. Это обстоятельство очень неблагоприятно для электролиза, так как образующиеся на катоде капли магния остаются в электролите, что создает условия обратного взаимодействия хлора с магнием и, следовательно, приводит к бесполезным потерям электроэнергии. Поэтому для того, чтобы обеспечить бы строе всплывание магния и хорошее отделение его от электроли та, целесообразно вводить в электролит утяжеляющие добавки. Обычно такой добавкой служит хлористый кальций.
Рис. 3. Диаграмма плавкости системы хлоридов калия, натрия, магния и кальция при постоянном содержании хлористого магния (10%)
Электропроводность электролита магния
Зависит от его состава. Наименьшей удельной электропроводностью обладает MgCl2(при 800° С она равна 1,17 Ом•см -1 ). При этих же условиях
удельная электропроводность СаСl2 составляет 2,02, КCl — 2,42 и NaCl — 3,57 Ом -1 •см -1 .
На рис. 4 показано изменение удельной электропроводности хлористого магния при добавлении к нему хлористых солей натрия, калия, кальция. Из графика следует, что добавки хлоридов щелочных металлов, а также хлористого кальция значительно увеличивают электропроводность электролита.
Следует отметить, что изменение электропроводности хлористого магния при введении нескольких солей имеет сложный характер.
Напряжение разложения компонентов электролита
В температурных условиях электролиза все компоненты электролита MgCl2, КСl, NaCl и СаСl2 ионизируются по следующим схемам:
MgCl2 ⇄ Mg 2+ + 2Сl — СаСl2 ⇄ Са 2+ + 2Сl — NaCl ⇄ Na + + Сl — ,
Рис. 4. Изменение удельной электропро водности хлористого магния при добавке к нему других хлоридов
Однако исследования показывают, что наличие в расплаве КО способствует образованию комплексных ионов:
Наряду с этими ионами в электролите могут присутствовать и другие ионы, например ионы Mg + . На аноде в этих условиях возможен разряд только ионов хлора, на катоде могут выделяться ионы Mg 2+ , Са 2+ Na + и К + ..
С целью выяснения возможности выделения на катоде наряду с магнием натрия, калия и кальция В. М. Гуськов и другие советские ученые провели обстоятельные исследования и расче ты. Установлено, что в температурных условиях промышленного электролиза (750° С) напряжение разложения MgCl2 равно 2,6В; NaCl 3,15 В; КCl 3,29 В и CaCl2 3,24 В. Так как напряжение разложения хлористого магния значительно меньше, чем других хлоридов, преимущественное выделение магния на катоде при равных концентрациях (вернее активностях катионов) сомнений не вызывает.
Однако в условиях промышленного электролиза возможны значительные колебания температуры электролита и концентрации (точнее активности) отдельных ионов. В этом случае равновесный обратимый потенциал выделения Е равен, как известно:
где Е — электродный потенциал при концентрации ионов С и температуре Т;м Е° —потенциал при концентрации ионов, равной 1 г-ионум в 1 л и температуре 298 К.
Следовательно, при нарушений условий электролиза—уменьшении концентрации в электролите ионов магния и повышении концентрации других ионов — наряду с магнием на катоде может начаться выделение и других металлов, в первую очередь натрия. Поэтому концентрация хлористого магния в электролите не должна быть ниже 5%.
Вязкость и поверхностное натяжение магния
Вязкость чистого расплавленного хлористого магния почти в три раза выше, чем вязкость расплавленных хлоридов натрия и калия. Уменьшение ее благоприятно сказывается на процессе электролиза. Хлориды калия и натрия, кроме вязкости, значительно снижают и поверхностное натяжение хлористого магния на границе с газовой фазой.
По практическим соображениям нежелательно иметь чрезмерно большое поверхностное натяжение электролита, которое затрудняет соединение отдельных капель металла, выделившихся на катоде. Однако нежелательно иметь и чрезмерно малое поверхностное натяжение на границе с газовой фазой, так как в этом случае магний, всплывающий на поверхность, разрывает поверхностную пленку электролита и может окислиться кислородом воздуха.
Чрезмерное снижение поверхностного натяжения электролита при уменьшении количества MgCl2 компенсируется наличием в электролите СаСl2, который, как и все хлориды щелочноземельных металлов, увеличивает поверхностное натяжение.
Температура электролиза магния
Температура плавления четырехкомпонентного электролита оптимального состава лежит в пределах 500° С и не лимитирует процесс электролиза так, как при электролитическом получении алюминия.
Нижний предел температуры процесса ограничивается точкой плавления магния, равной 651° С. Электролиз при температуре 650—660° С приводит к выделению магния в виде твердых мелких корольков, которые плохо всплывают и не могут сливаться в общую массу.
С повышением температуры уменьшается вязкость электролита, увеличиваются конвекционное и диффузионное проникновение растворенного в электролите магния и его мелких капель в анодное пространство, а также выброс хлора в катодную часть ванны, что ведет к большим потерям уже полученного металла и, следовательно, к бесполезным затратам электроэнергии. Одновременно увеличивается окисление и испарение магния, плавающего на поверхности электролита, в связи с повышением упругости его пара.
Наряду с этим повышение температуры электролита увеличивает его электропроводность, а следовательно, снижает напряжение на ванне. С учетом всех этих факторов электролиз ведут в температурном интервале 690—720° С.
Растворимость магния в электролите
В объяснении механизма растворения магния в электролите нет единой точки зрения. Одни исследователи считают, что магний образует в расплаве истинный и коллоидный раствор (так называемый «металлический туман»). Другие считают, что имеет место химическое взаимодействие магния с электролитом, ведущее к образованию субсоединений (соединений низшей валентности). Так или иначе растворение магния в электролите имеет место и приводит к бесполезным потерям электроэнергии из-за того, что растворенный металл, попадая в анодное пространство, вновь хлорируется.
По данным А. И. Журина, максимальной растворяющей способностью среди компонентов электролита обладает расплавленный хлористый магний (0,3%). Добавка к нему хлоридов натрия, калия и кальция снижает растворимость магния, т. е. и в этом случае влияет благоприятно.
Состав электролита магния
Практика работы заводов показала, что для получения магния целесообразно применять четырехкомпонентный электролит, содержащий MgCl2, СаСl2, NaCl и КCl, либо трехкомпонентный (без КCl). Кроме этих основных солей, входящих в состав электролита, на некоторых заводах вводят в электролит еще ряд добавок для улучшения показателей процесса.
Наибольший интерес представляет введение в электролит небольших количеств NaF и CaF2. Положительное влияние этих добавок на электролиз хлористых солей магния было подробно изучено П. П. Федотьевым и убедительно объяснено А. И. Беляевым и Е. А. Жемчужиной. Основываясь на обширном экспериментальном материале, они пришли к выводу, что введение в расплавленные хлористые сели небольших добавок фторйдов приводит к повышению поверхностного натяжения на границе с расплавленным магнием и твердым катодом, что способствует задержанию капель магния на катоде и тем самым их росту.
Практика показала, что целесообразнее вводить NaF, чем CaF2, так как он значительно лучше растворяется в электролите.
Есть ряд веществ, отрицательно влияющих на электролиз.
К таким веществам (примесям) надо в первую очередь отнести влагу, сульфаты, соли железа, окислы магния и бора.
Исследования П. П. Федотьева и других советских ученых показали, что каждая десятая доля процента влаги, содержащаяся в электролите, приводит к снижению выхода по току на 1 %. Под действием электрического тока влага разлагается с выделением на катоде водорода. Ряд исследователей считает, что влага взаимодействует с уже выделенным магнием по реакции
что ведет не только к химическим потерям магния, но и способствует увеличению его физических потерь, так как окись магния, образующаяся на поверхности мелких корольков магния, затрудняет их слияние, а иногда и увлекает их в шлам.
Сульфат магния, попав в электролит, сильно снижает выход по току за счет реакций:
MgSО4 + 3Mg = 4MgO + S,
что приводит к так называемому «кипению» электролита, которое возникает при заливке в ванну расплава даже с незначительным содержанием сульфатов.
На процесс электролиза очень сильно влияют соли железа. При содержании в электролите всего около 0,1% Fе на катоде некоторое время совсем не наблюдается выделения магния и затем значительно снижается выход по току, то же происходит при появлении в электролите титана. Предполагают, что в результате электролиза хлористых солей железа и титана на катоде выделяются их губчатые осадки, адсорбирующие окись магния и пассивирующие катод.
Окись магния непосредственно не влияет на электрохимический процесс получения магния. Она оседает на дно ванны, образуя шлам, увлекающий за собой мелкие корольки магния. Этот шлам приходится периодически вычерпывать, что является тяжелой работой. Кроме того, окись магния оседает на катоде, а это приводит к выделению магния в дисперсной форме. Мелкие капли магния всплывают медленнее крупных и поэтому больше уносятся в анодное пространство, где вновь хлорируются. Аналогичное, но более сильное влияние оказывают и соединения бора (B2O3).
В связи с изложенным, соли, поступающие на электролиз, должны содержать не более: 0,1% Н 2O; 0,03% SO3; 0,04% FeCl3; 0,5% MgO; 0,002% В 2O3 и 0,008% Ті.
В результате изложенного выше сложного влияния различных факторов на свойства электролита магниевая промышленность различных стран применяет электролиты различных составов.
Наиболее широко применяют четыре типа электролитов, основной состав и свойства которых приведены в табл .
Таблица. Состав и свойства электролитов, применяемых для получения магния
| Содержание, % | Основные cвойства | ||||||
| Электролит | MgCl2 | KCl | NaCl | СаСl2 | температура кристаллизации, °С | плотность при 700 °С, г/см 3 | удельная электропроводность Ом -1 • см |
| Калиевый (карналлитовый) | 5—12 | 70—78 | 12—16 | 0—2 | 650 | 1,60 | 1,83 |
| Калиево-натриевый | 8—16 | 38—44 | 38—44 | 4—6 | 625 | 1,63 | 2,10 |
| Натриево-кальциевый Натриевый | 8—16 — | 35—45 45—60 | 30—40 15—25 | 575 650 | 1,78 1,66 | 2,00 2,23 | |
На отечественных заводах вошла в практику добавка к основным составляющим электролита небольших количеств (до 1%) фтористых солей натрия и кальция.
Показатели электролиза магния
Для выделения 12,16 г Mg (1 г-экв) надо затратить 26,8 А•ч, отсюда следует, что 1 А•ч выделяет 0,454 г Mg.
Расход электроэнергии при этом составит
Влияние состава электролита и температуры электролиза на выход по току (Кт) было рассмотрено выше.
Влияние температуры электролита на показатели процесса электролиза приведено на графике (рис.5), из которого следует, что наиболее экономичным является температурный интервал 715—725° С. Однако, учитывая, что повышение темпера туры приводит к загрязнению магния примесями (см. ниже) и большому шламообразованию, оптимальным температурным ин тервалом следует считать 700—720° С.
Рис.5. Изменение выхода по току и удельного расхода электроэнергии в зависимости от температуры при электролитическом получении магния. Работа на натриево-калиевом электролите (по данным Н. М. Зуева, В. В. Вуколова, А. Б. Иванова)
Увеличение плотности тока и межполюсного расстояния при прочих равных условиях несколько повышает выход по току,
однако приводит к увеличению напряжения на ванне (U) и, следовательно, к повышению расхода электроэнергии.
Кроме того, на показатели электролиза влияют глубина ванны, ее конструкция, а также качество обслуживания ванн и уме ние вести его в оптимальном режиме рабочими и инженерно-техническим персоналом.
Статья на тему Электролитическое получение магния
Похожие страницы:
Понравилась статья поделись ей
Источник