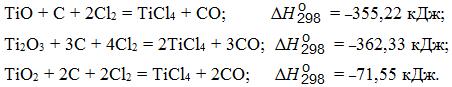- Магниетермический метод получения титана.
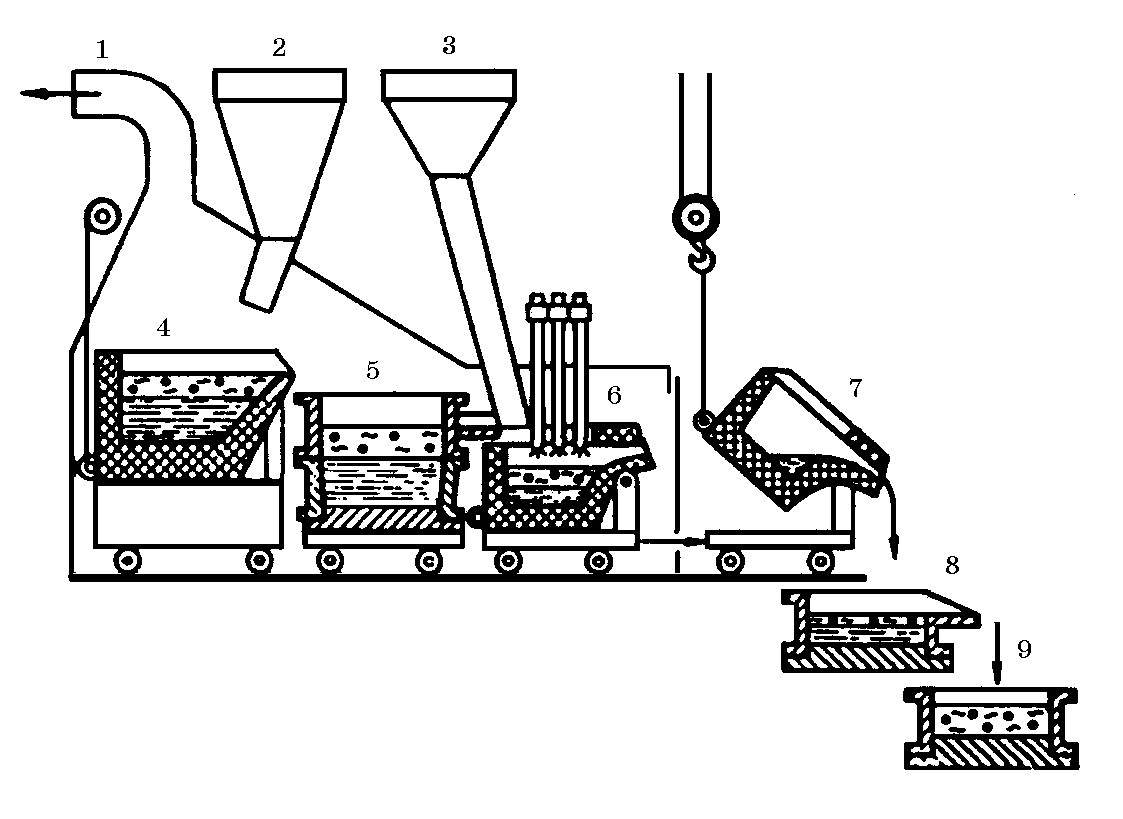
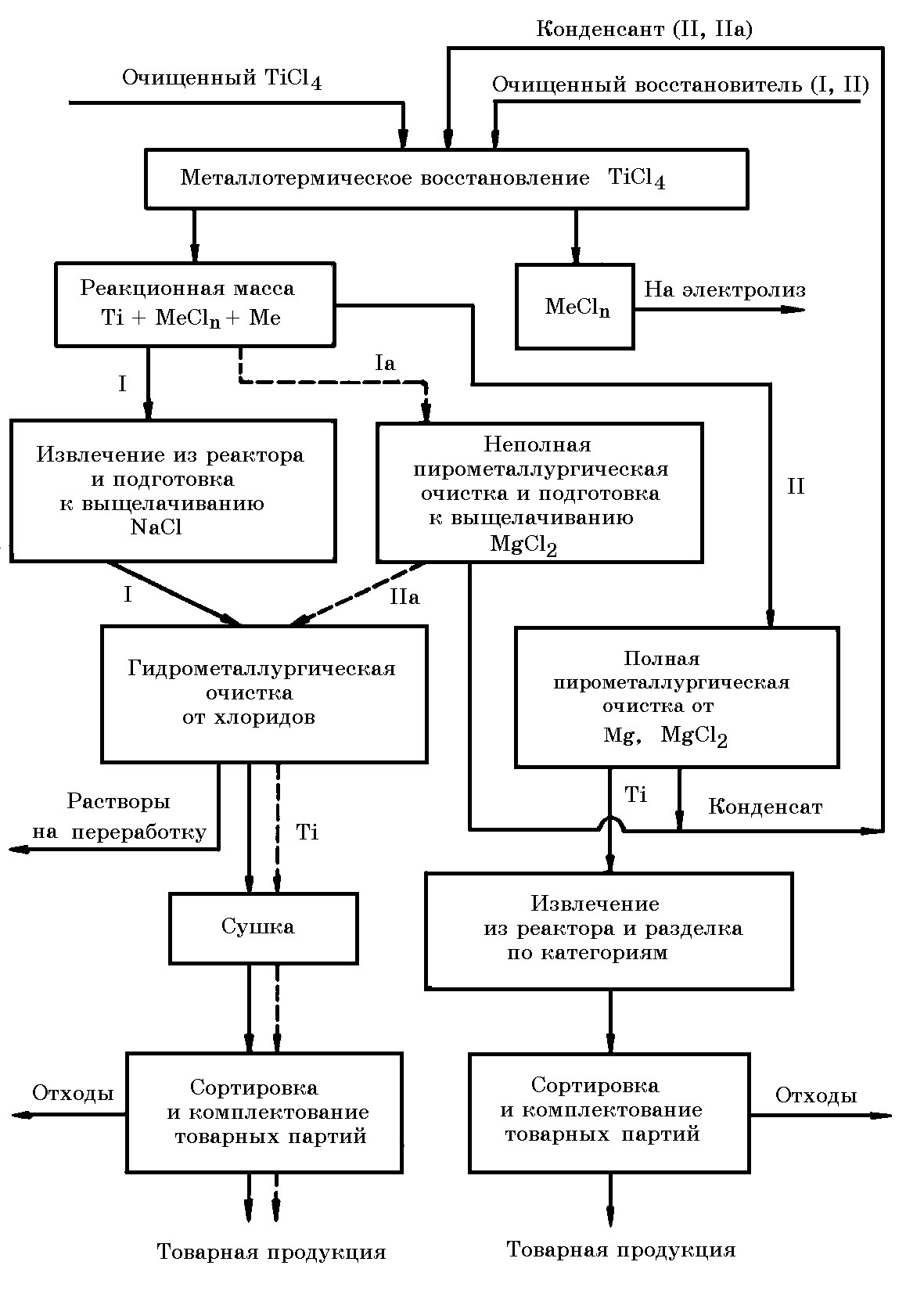
- Технологическая схема магниетермического способа производства титана
- Магниетермический способ получения титана
- 1. Введение
- 2. Свойства и применение титана
- Физико-химические и механические свойства губчатого и пластичного титана
- Способы получения титана
- Применение титана
Магниетермический метод получения титана.
Данный метод основан на получении металлического титана из его четыреххлористого соединения путем восстановления магнием.
Восстановление титана магнием основано на значительно большем сродстве магния к хлору по сравнению со сродством титана к хлору. Реакция протекает по уравнению:
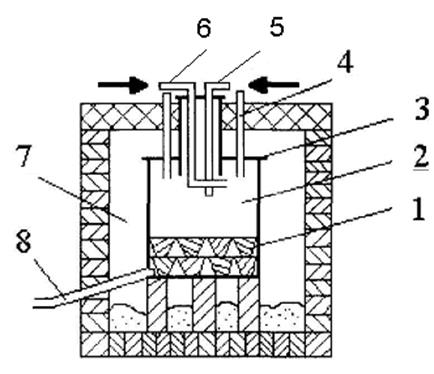
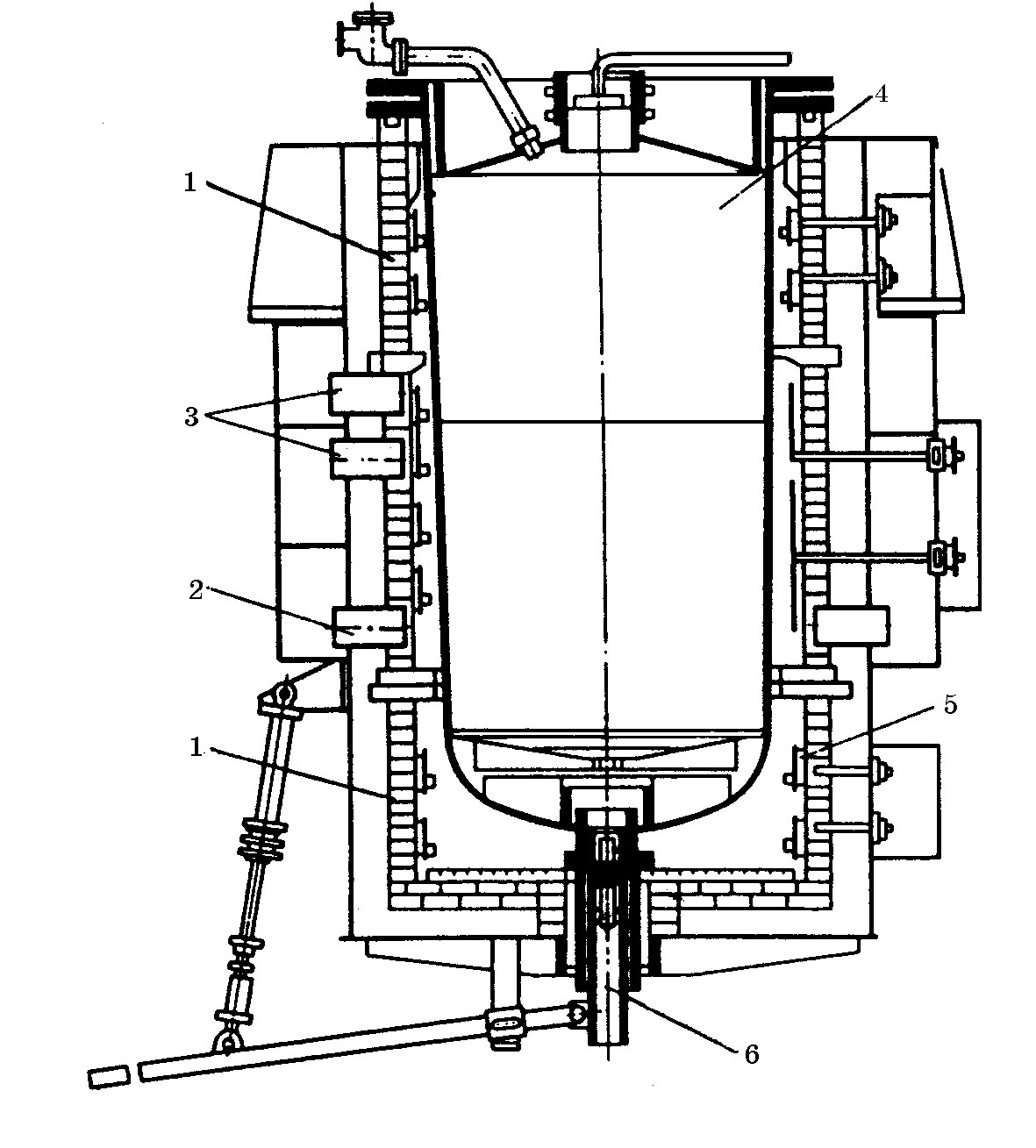
Восстановление протекает интенсивно при температуре 800…900 0 С. Процесс осуществляют в реакторе из нержавеющей стали (рис.2). При температуре процесса, не превышающих 1030 0 С, нет опасности разрушения реактора.
Рис.2. Реактор для восстановления титана
В реактор 2 загружают металлический магний в чушках 1, который предварительно протравливают для удаления окислов, находящихся на его поверхности, и затем промывают водой. Реактор закрывают герметичной крышкой 3 и устанавливают в печь 7. Из реактора откачивают воздух и по трубке 5 заполняют его аргоном или гелием, создавая избыточное давление 0,05…0,25 атмосферы. Реактор разогревают до расплавления магния, после чего в него подают жидкий четыреххлористый титан по трубке 6, пропущенной через крышку реактора. Благодаря выделению тепла в результате реакции между четыреххлористым титаном и магнием температура в зоне реакций доходит до 850…900 0 С и поддерживается на этом уровне в течение всего процесса. Температуру регулируют скоростью подачи жидкого хлорида титана. В случае необходимости производят охлаждение реакционной зоны аппарата или подогрев путем включения электрических нагревателей в печи, в которой установлен реактор.
В реакторе четыреххлористый титан, взаимодействуя с жидким магнием, восстанавливается, а металлический титан оседает преимущественно по стенкам реактора выше уровня жидкого магния. Так как температура в реакторе намного ниже температуры плавления титана, то получается он в виде губчатой массы, состоящей из зерен твердого титана. Эта губчатая масса постепенно заполняет весь реактор. Корку титана пробивают ломиком через трубку 4 или разрушают, повышая давление инертного газа. Хлористый магний оседает на дно реактора, откуда его периодически выпускают через лётку 8. Металлический магний дополнительно вводят в реактор в твердом или жидком виде с помощью специальных подгрузочных кассет.
Полученная губчатая масса титана содержит хлористый и металлический магний. Эти примеси подлежат удалению. В губке по весу находится примерно 60 % титана, 15…20 % избыточного магния и 20…25 % хлористого магния. Магний и хлористый магний удаляют из реактора и используют его в кругообороте производства. Магний применяют в качестве восстановителя, а хлористый магний направляют для электролиза, в результате чего получают магний и хлор. После охлаждения губчатый титан высверливают, упаковывают в герметичную тару и доставляют потребителю. Размеры кусков губки не должны превышать 50 мм.
Дата добавления: 2016-12-16 ; просмотров: 1701 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Технологическая схема магниетермического способа производства титана



Титан — ценный конструкционный материал, если его получать экономичным промышленным способом.
В 1940 г. немецким химиком Вильгельмом Кроллом был предложен магниетермический способ получения титана, который в настоящее время является основным в России, Японии и США.
В Канаде и Европе применяется способ Хантера, который подобен способу Кролла, но для восстановления титана вместо магния используют натрий, и способ называется натриетермический. Он технически более сложен, но процесс идёт при относительно невысокой температуре и титан в меньшей степени загрязняется примесями.
Производство титана является технически сложным процессом, так как металлический титан обладает большой активностью: бурно реагирует с азотом при температуре 500—600 °С и кислородом при 1200—1300 °С, поглощает водород, взаимодействует с углеродом и большинством химических элементов. Проблема налицо: для дальнейшего научно-технического прогресса, успешного развития современных технологий, освоения космоса и огромных морских ресурсов, нужно много этого замечательного металла, но только высокой чистоты. Во всех стадиях производства титана имеется опасность проникновения в титан кислорода и азота, освобождение от которых представляет значительные трудности, поэтому главное требование к оборудованию в металлургии титана – его герметичность.
Высокая активность титана и сильное влияние на его качество даже небольших содержаний примесей, обусловили применение особых технологических приёмов в процессе его производства. Но постоянно ведутся поиски новых, менее затратных способов получения титана.
В 1950-х годах в СССР был разработан уникальный промышленный способ получения магния и титана на одном предприятии. Были построены 3 гигантских титано-магниевых комбината в Усть-Каменогорске (северный Казахстан), Березниках (Пермская область) и в Запорожье (Украина). Магний получали из карналлита и он в жидком виде сразу шёл на восстановление губки, газообразный анодный хлор — на хлорирование титановых шлаков, отработанный электролит из электролизёров – в расплавной хлоратор, а мелкодисперсный конденсат Мg и Мg возвращался в электролизное производство. Всё необходимое сырьё и материалы находились в одном месте, при этом исключались длительные транспортные перевозки и лишние энергетические затраты на переплав и разогрев исходного сырья.
Современный промышленный магниетермический процесс получения чистого титана – многостадийное, весьма сложное в аппаратурном оформлении производство, энергоёмкое и экологически довольно неблагополучное. Каждая стадия переработки титанового сырья представляет собой отдельное многоступенчатое производство со специфическими требованиями к технологии и оборудованию, охране труда и промышленной безопасности, в том числе и экологии. Но этот способ хорош тем, что в качестве сырья используются титановые концентраты, полученные переработкой железосодержащих минералов, которые очень распространены в России и запасы их очень велики.
В России титан получают магниетермическим способом по следующей технологии.
1. Обогащение железотитановых руд в 2 стадии с получением ильменитового концентрата и концентратов редких элементов, зависимости от состава руд, до 8 – 10.
2. Выплавка титановых шлаков в рудотермических электродуговых печах.
Ильменитовый концентрат далее подвергают металлургическому обогащению – восстановительной плавке в смеси с углем. Задача плавки – восстановить оксиды железа, удалить их в виде чугуна и получить титановый шлак, содержащий окислы титана.
3. Хлорирование шлаков.
Полученный титановый шлак измельчают, подвергают магнитной сепарации для удаления железосодержащих частиц, смешивают с нефтяным коксом, загружают в хлоратор, подают газообразный хлор, и при температуре 700-900 °С образуется газообразный четыреххлористый титан Пары четыреххлористого титана находятся в составе многокомпонентной парогазовой смеси (ПГС), содержащей твёрдые частицы шихты, образовавшиеся хлориды и газы.
4. Конденсация парообразного TiCl4.
ПГС очищают от твердых частиц и охлаждают в конденсаторах, орошая жидким ТiСl4. Конденсат отстаивают, фильтруют и получают жидкий четыреххлористый титан технической чистоты.

5. Очистка жидкого TiCl4.
Четыреххлористый титан очищается от растворённых в нём примесей различными физическими и химическими методами в специальном оборудовании.
6. Восстановление TiCl4 магнием.
Очищенный четыреххлористый титан восстанавливают в реакторах расплавленным магнием в атмосфере аргона. При температуре 900 °С происходит образование металлического титана в виде губки
7. Вакуумная сепарация губки
Рафинирование (очистку) титановой губки проводят методом вакуумной дистилляции при 950°С , при этом Mg и MgCl2 расплавляются, испаряются и выделяются в конденсаторе в твёрдом виде. Очищенную титановую губку измельчают, формируют товарные партии и направляют потребителям.
8. Переработка титановой губки плавкой в электродуговых печах.
Переплавкой титановой губки в вакуумных электрических дуговых печах получают титановые слитки. Наличие вакуума предохраняет металл от окисления и способствует его очистке от поглощенных газов и примесей. Для обеспечения высокого качества слитков плавку повторяют несколько раз.
Задание 3.Изучить приведённый материал и ответить на вопросы
1 Общность и отличие способов Кролла и Хантера.
2 Формула карналлита
3 Почему титан и магний получают на одном заводе?
4 Какие особые требования к оборудованию при производстве титана?
Источник
Магниетермический способ получения титана
Содержание > ГЛАВА 11. Электрометаллургия ферротитана > 11.7. Технология получения металлического титана магниетермическим способом
Титан высокой чистоты, используемый как конструкционный материал, получают по сложной многостадийной схеме переработки титановых концентратов. Первоначально концентрат подвергают электроплавке в рудовосстановительных печах единичной мощностью 10–15 МВ∙А (рис. 11.13) для получения передельного высокотитанистого шлака. Задаваемое с шихтой небольшое количество коксика обеспечивает восстановление оксидов железа из ильменитового расплава, поэтому содержание оксидов титана в пересчете на TiO2 достигает 82–84%, а содержание FeO снижается до 3–4%. Шлак на выпуске имеет температуру 1700 о С. На второй стадии титановый шлак подвергают хлорированию газообразным хлором в присутствии углерода для получения тетрахлорида титана TiCl4.
Рис. 11.12. Технологическая схема довосстановления жидких шлаков ферротитана: 1 – труба газоочистки; 2 – бункер шихты для выплавки ферротитана; 3 – бункер шихты для восстановления шлака; 4 – горн для выплавки ферротитана; 5 – изложница для металла и шлака;
6 – электропечь для восстановления шлака; 7 – выкатная ванна электропечи; 8 – копильник; 9 – шлаковня
Тетрахлорид титана TiCl4 представляет бесцветную прозрачную жидкость, дымящую на воздухе. Температура плавления TiCl4 минус 24,1 о С, температура кипения 136,3 о С, плотность 1,73 г/см 3 , теплота образования ∆Н о обр = –804 кДж/моль.
Порошок шлака перед хлорированием брикетируют с углеродистым восстановителем. Хлорирование брикетов ведут в специальных реакторах – хлораторах, представляющих собой шахтную электропечь сопротивления. Углерод в составе брикетов восстанавливает титан, обеспечивает протекание реакций хлорирования при более низких температурах, что делает эти реакции термодинамически необратимыми:
Рис.11.13. Конструкция печи для выплавки титановых шлаков:
1 – труботечка для подачи шихты; 2 – система электроподвода; 3 – водоохлаждаемый свод; 4 – магнезитовая футеровка; 5 – кожух печи
Наряду с восстановлением и хлорированием титана протекают реакции взаимодействия хлора и с другими оксидами, что приводит к образованию хлоридов SiCl4, FeCl2, AlCl3 и др. По изменению энергии Гиббса реакций хлорирования слагающие шлак оксиды располагаются в ряд FeO, K2O, Na2O, Y2O3, CaO, MnO, MgО, TiO2, Fe2O3, SiO2, Cr2O3 и Al2O3. Оксиды, стоящие до TiO2, хлорируются полностью, Al2O3, SiO2, Cr2O3 – в меньшей степени.
Отличительной особенностью хлоридов являются более низкие температуры их плавления и кипения, чем оксидов. Резкое различие физических свойств хлоридов позволяет разделить их обычной термической разгонкой с последующей фракционной конденсацией.
Металлический титан (губку) получают металлотерми-ческим процессом, восстанавливая титан из TiCl4 магнием по экзотермической реакции:
TiCl4(ж.п) + 2Mg(ж.п) = Ti(т) + 2MgCl2(ж.п)
∆G 
Для стандартных условий ∆H 

Рис. 11.14. Принципиальная технологическая схема металлотермического производства титана на основе четыреххлористого титана*
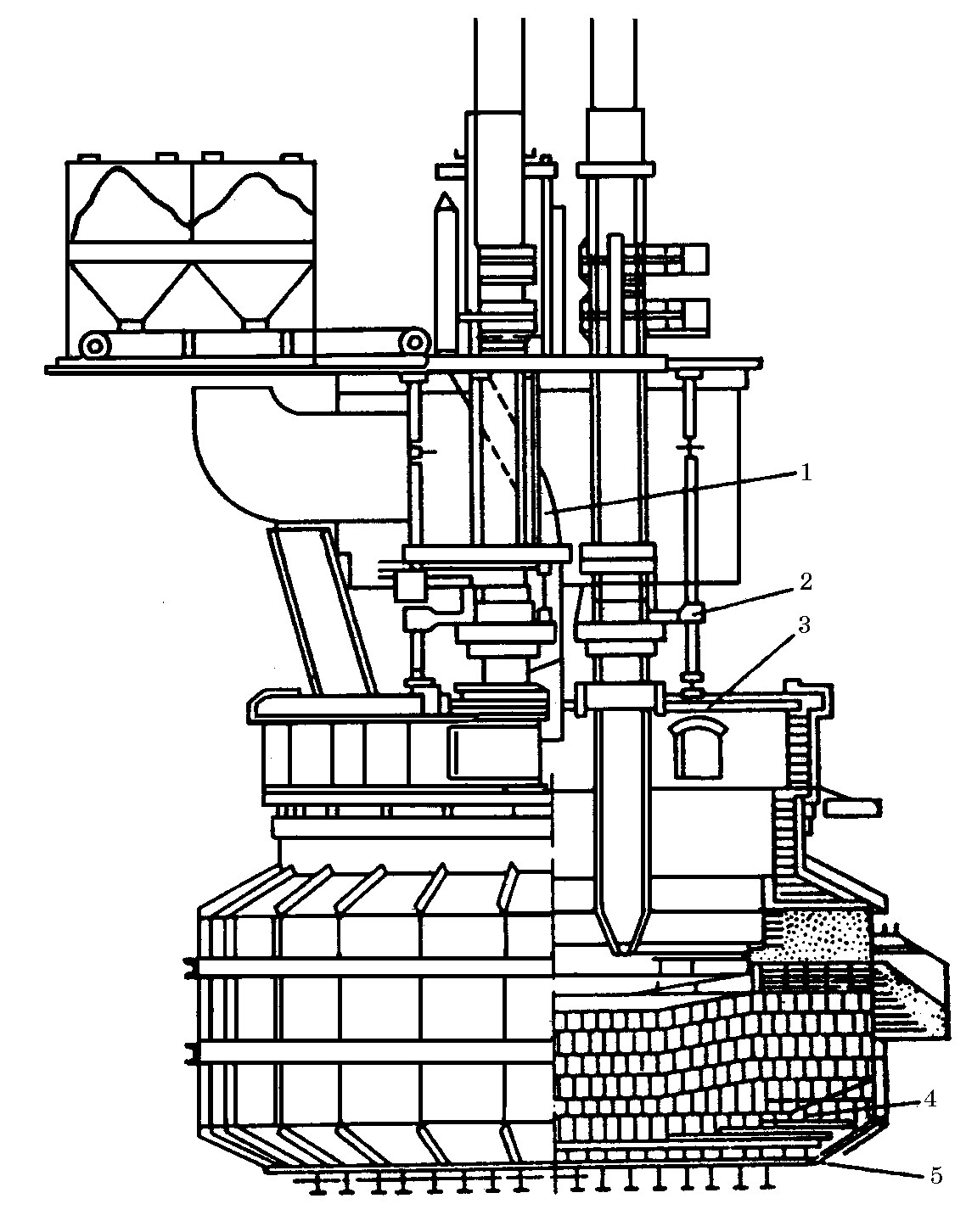
Получаемая на стадии восстановления TiCl4 магнием в электропечи (рис. 11.15) при 930–950 о С реакционная масса после охлаждения представляет собой губчатый титан, поры которого заполнены магнием и MgCl2. Ее состав 60% Ti, 20–30% Mg и 10–20% MgCl2.
Рис. 11.15. Схема установки восстановления четыреххлористого титана:
1 – электропечь; 2 – канал для отвода горячего воздуха; 3 – фурма для подвода холодного воздуха; 4 – аппарат восстановления; 5 – нагреватели; 6 – сливная труба (В.А.Гармата, А.Н.Петрунько и др.)
Очистку губчатого титана от Mg и MgCl2 можно вести вакуум-термическим и гидрометаллургическим методами. Целесообразность применения первого или второго метода определяется некоторыми факторами. Вакуум-термическая очистка губчатого титана от примесей основана на существенном различии в летучести магния, хлорида магния и металлического титана. Процессы рафинирования сопровождаются потреблением энергии и требуют постоянного подвода тепла. Титановую губку перерабатывают на компактный титан выплавкой слитков в вакуумно-дуговых печах.
Источник
1. Введение
Много лет считалось, что металлический титан был получен в 1825 году президентом Шведской академии наук Берцелиусом путем восстановления фтортитаната калия (К2 TiF 6 ) металлическим натрием. По описанию самого Берцелиуса полученный им металл не растворялся даже в плавиковой кислоте (HF). Однако утверждения Берцелиуса, как показали последующие исследования учёных, были ошибочными, ибо чистый титан хорошо реагирует с этой кислотой. В действительности титан был впервые получен в 1875 году нашим соотечественником русским учёным Д.К. Кирилловым, работавшим в Московском университете. Результаты его труда изложены в брошюре «Исследования над титаном», но они , как и многие другие выдающиеся достижения того времени, остались незамеченными в царской России. И только в 1910 году американцу М. Хантеру удалось выделить несколько граммов титана чистотой около 99%. С этого времени начались интенсивные исследования свойств титана, приведшие к разработке в 1940 году У. Кролем промышленного магниетермического способа получения титана. Этот способ основан на следующей реакции:
Магний, как более активный металл, в этом процессе играет роль восстановителя. На 1 кг титана расходуется около 4 кг TiCl4 и 1 кг магния. Сырьем для производства титана служит TiCl4, который получают хлорированием титансодержащих соединений, и магний, производимый обычно электролизом MgC l . Таким образом, подобно получаемый по реакции безводный MgC l пригоден для производства магния электролизом, а выделяемый при электролизе хлор — для производства TiCl4. Следовательно, целесообразно совместить производство магния и титана. Поскольку на практике TiCl4 восстанавливают магнием при температуре 750-850 ° С, т.е. при температуре ниже температуры плавления титана (
1670 ° С), то металл получается в виде спеченных кристаллов — губки. Титановая губка является готовой продукцией титаномагниевых комбинатов и в то же время основным сырьём для металлообрабатывающих предприятий, где из неё различными методами готовят слитки пластичного титана, а затем и прокат.
2. Свойства и применение титана
Физико-химические и механические свойства губчатого и пластичного титана
Губчатый титан представляет собой пористый кристаллический конгломерант с чрезвычайно развитой поверхностью пор. Активная удельная поверхность губки в зависимости от крупности кусков изменяется от 100 до 400 м/кг. Имея большую удельную поверхность пор, губчатый титан способен адсорбировать из воздуха газы и, прежде всего, пары воды. Влагонасыщение губки зависит от её температуры и условий хранения: продолжительности, относительной влажности воздуха, температуры. Насыпная масса губки зависит от способа комплектации товарной партии .У кричной (т.е. основной части блока губки, не соприкасающейся со стенками реактора) фракции -70+12 мм насыпная масса изменяется от 930 до 1050 кг/м и составляет в среднем 960 кг/м . Боковая губка характеризуется большей пористостью и меньшей насыпной массой (600-650 кг/м). Более мелкая губка фракции -12+2 мм (кричная часть) и -12+5 мм (боковая часть) имеет насыпную массу 900-1050 кг/м , а в среднем 990 кг/м.
Плотность губчатого титана составляет 800-3500 кг/м и также зависит от способа комплектации партии.
Теплопроводность губки очень низка (в 13 раз меньше, чем у пластичного титана) и составляет 1,26 Вт/(м*С). Плохая теплопроводность губки значительно затрудняет ее обработку резанием.
Свойства пластичного титана . По внешнему виду титан похож на сталь; он обрабатывается резанием, пластичен, трудно полируется и долго сохраняет блеск. На воздухе металл благодаря оксидно-нитридной пленке устойчив до 430 ° С. Высока коррозионная стойкость титана в воде, в том числе и в морской. Титан существует в двух кристаллических модификациях — низкотемпературной (до 882,5 ° С) и высокотемпературной (выше 882,5 ° С); титан имеет гексагональную плотноупакованную (г.п.) решетку, — титан — объемно-центрированную кубическую (о.ц.к.) решетку. Атомная масса титана 47,9, плотность 4510 кг/м, температура плавления
1670 ° С, температура кипения 3260 ° С, теплота плавления 437 Дж/кг, удельная теплоемкость (в интервале 0-100 ° С) 678Дж/(кг*С), теплопроводность (в интервале 0-200 ° С) 213,6 Вт/(м*С), температурный коэффициент линейного расширения (в интервале 290-570 ° С) 8,2 10°С, удельное электросопротивление (при 20 ° С) 42 10 Ом м, магнитная проницаемость 1,00005 Г/м (титан парамагнитен, т.е. он способствует усилению окружающего его внешнего магнитного поля). Твердость по Бринеллю НВ 90-130. Титан является хорошим геттером, т.е. обладает способностью активно поглощать газы, в особенности кислород, азот и водород. Примеси кислорода и азота снижают пластические свойства титана, а водород делает титан хрупким.
Хлор и другие галогены взаимодействуют с титаном при низких температурах (100-200 ° С) с образованием лёгколетучих галогенидов титана. Титан обладает высокой коррозионной стойкостью во многих средах. В холодной и кипящей воде металл не корродирует. Он практически стоек против действия азотной кислоты любой концентрации на холоде и при нагревании вследствие образования защитной окисной пленки. В разбавленной серной кислоте (до 5% H2S O 4 ) при комнатной температуре титан стоек, в других условиях H2S O 4 разрушает титан. Подобное действие на титан оказывает соляная кислота, которая начинает реагировать с ним при концентрации HC l более 10% и температура выше 25 ° С. В растворах щелочей (концентрации до 20%) на холоде и при нагревании титан стоек. Титан не корродирует в среде расплавов некоторых соединений. Высокая коррозионная стойкость титана обусловливает широкое применение его в химико-металлургических производствах.
Способы получения титана
Помимо магниетермического способа получения титана в аппаратах периодического действия, широкого применяемого в мировой практике, существуют и другие. Важным является производство титана натриетермическим способом, используемым за рубежом, в частности в Англии . Этот способ обоснован на следующей экзотермической (т.е. проходящей с выделением тепла) реакции:
Натриетермический способ имеет определенные преимущества перед магниетермическим (легкость транспортировки натрия вследствие низкой (98 ° С) температуры его плавления; высокая скорость реакции восстановления и прохождение ее со 100%-ным коэффициентом использования натрия; отсутствие сложного и энергоемкого передела вакуумной дистилляции; возможность ведения полунепрерывного процесса и др.). Вместе с тем этому методу свойственны существенные недостатки. Натрий — очень высокоактивное вещество: на воздухе он быстро окисляется, а с водой реагирует со взрывом. Всё это требует соблюдения специальных мер безопасности. Отрицательными сторонами метода также являются высокая экзотермичность процесса восстановления, большой объем восстановителя и продуктов реакции, что приводит к необходимости применения громоздкой аппаратуры. Из других способов производства титана известны восстановление двуокиси титана кальцием по реакции
TiО2 + 2Са = Ti + 2СаО,
гидридом кальция по реакции
Интересен йодный метод, с помощью которого может быть получен высокочистый титан
Все эти способы применяются ограниченно и по своим масштабам значительно уступают магние- и натриетермическому способам. Весьма перспективным является электролитический способ получения титана. Главное его преимущество — отсутствие металлического восстановителя. Достигнуты значительные успехи по разработке и совершенствованию этого метода. Идея метода уже используется в промышленной практике при электролитическом рафинировании титана (например, некачественного губчатого титана, отходов плавки титана и его сплавов).
В этом процессе анодом служит загрязненный титан, погруженный в расплав электролита. Последний содержит хлориды щелочных металлов и низшие хлориды титана (TiC l 2 , TiC l 3 ). При электролизе, проходящем при 800-850 ° С, титан переходит в электролит и осаждается на катоде. Катодный осадок после гидрометаллургической обработки, просеивания служит отличным сырьем для порошковой металлургии.
Применение титана
Титан применяют в виде губки и порошка. Губчатый титан, имеющий развитую поверхность, в небольших количествах используют для очистки и осушки различных газов. В последние годы ускоренными темпами развивается новая отрасль в промышленности — порошковая металлургия, в том числе порошковая металлургия титана. Изделия из высокопористых титановых порошков обладают всеми свойствами компактного титана: малой плотностью, высокой прочностью, высокой коррозионной стойкостью. Их получают прокаткой или прессованием с последующим спеканием. Эффективность от применения 1 тонны титановых фильтрующих элементов, используемых в химической, пищевой и других отраслях промышленности, составляет несколько десятков тысяч рублей. Пластичность титана и его сплавы по сравнению с другими конструкционными металлами обладают более высокой удельной прочностью и исключительной коррозийной стойкостью в атмосферных условиях и агрессивных средах. Титан стоек в воде, в том числе и морской. Это ценное свойство металла широко используется в судостроении. Существенное значение имеют такие свойства титана, как высокая температура плавления, малый коэффициент термического расширения, стойкость против эрозии и кавитации, немагнитность, биологическая инертность. Хорошая растворимость многих элементов, образования химических соединений с переменной растворимостью позволяет на основе титана получать сплавы с разнообразной структурой и свойствами. Легированием и последующей термообработкой временное сопротивление сплава титана можно повысить до 1500 МПа и более, что характерно только для специальных сталей. Удельная прочность титановых сплавов высока, и это позволяет снизить массу конструкций. Преимущества титановых сплавов перед специальными сталями, алюминиевыми и магниевыми сплавами сохраняются при температурах до 400-500 и даже 600 ° С, когда алюминиевые и магниевые сплавы вообще не применимы. При 300-350 ° С титановые сплавы прочнее алюминиевых в 10 раз.
Эти уникальные свойства титана и его сплавов привлекли внимание конструкторов самолетов, ракет, подводных лодок, различных химических аппаратов и на длительный период определили главное применение проката из титана в этих отраслях. Показательны в этом отношении данные по структуре потребления проката из титана и его сплавов в США по годам, приведенные ниже:
Источник