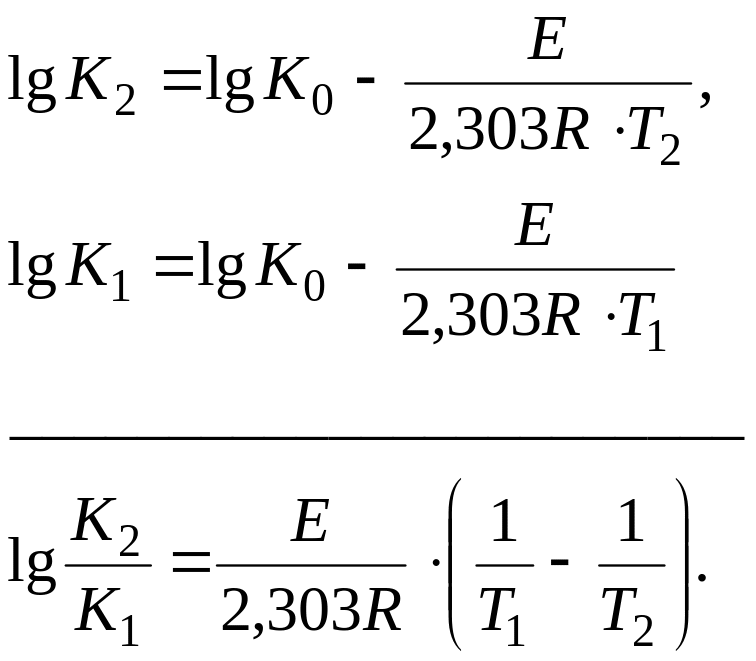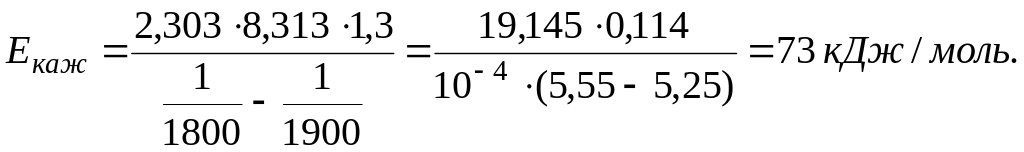- Лимитирующая стадия процесса способы ее определения
- Гетерогенные химические процессы в системе «газ-твердое вещество». Лимитирующая стадия. Зависимость скорости процесса от рабочих условий. Способы определения лимитирующей стадии.
- Способы определения лимитирующих стадий
- Способы определения лимитирующих стадий и звеньев гетерогенного процесса
Лимитирующая стадия процесса способы ее определения
Теория лимитирующей стадии химико-технологического процесса разрабатывается, начиная с основополагающей работы Франк-Каменецкого [8], и встречается в большом числе публикаций [1, 4, 911].
Для проведения реакции в гетерогенных реакторах необходим перенос одного или нескольких реагентов через межфазную поверхность и (или) перенос продуктов реакции из зоны собственно химической реакции.
Соотношение скоростей химического превращения и массопереноса определяется кинетикой химической реакции (константой скорости реакции) и скоростью массопереноса, которая в свою очередь зависит от площади межфазной поверхности и коэффициента массопередачи, т. е. от толщины и степени турбулизации пограничных слоев.
Проиллюстрируем это на примере, когда наряду с химической реакцией первого порядка имеет место диффузия с эффективным коэффициентом диффузии D [4]:

где С0 исходная концентрация реагента; С концентрация реагента в зоне реакции; F площадь межфазной границы раздела; D эффективный коэффициент диффузии; d расстояние, на котором происходит диффузия; V реакционный объем; k константа скорости химической реакции.
В стационарном состоянии реактора Wd = Wp и, следовательно:


Зависимость константы скорости реакции k от температуры подчиняется экспоненциальному закону, в то время как D меняется значительно медленнее. Вследствие этого при достаточно низких температурах k 


Этот случай соответствует диффузионному режиму, когда скорость процесса зависит только от параметров диффузионной модели.
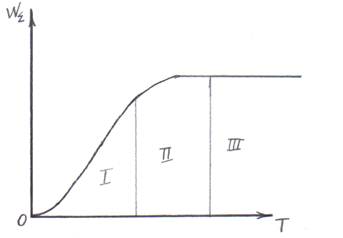
Схематично зависимость скорости реакции от температуры представлена на рис. 18.3.1.1.
Сплошная кривая соответствует уравнению (18.3.1.1); пунктирные кривые соответствуют влиянию температуры на диффузию, не сопровождающуюся химической реакцией, и на реакцию, не сопровождающуюся диффузией.
Рис. 18.3.1.1. Переход из кинетической области
в диффузионную
В центральной части кривой скорость процесса быстро нарастает, что обусловлено действием химической реакции, а правее наблюдается более медленное увеличение скорости, соответствующее переходу в диффузионную область. Ряд таких реакций изучен экспериментально: горение углерода [13], окисление сульфата цинка [12].
Укажем методы определения лимитирующей стадии процесса диффузионной или кинетической [3].
1. Определение по температурной зависимости суммарной скорости процесса.
Если с изменением температуры на 10 С суммарная скорость процесса изменяется в 23 раза (как следует из закона Аррениуса), лимитирующей стадией является собственно химическое превращение, а реактор работает в кинетической области.
Если же с изменением температуры на 10 С суммарная скорость процесса изменяется, значительно меньше, чем в 2 раза, лимитирующей стадией является массообмен.
В промежуточных случаях реакция протекает в диффузионно-кинетической области.
Применение этого метода выявления лимитирующей стадии осложняется тем, что для некоторых каталитических реакций характерны низкие энергии активации.
2. Определение по кажущемуся порядку реакции.
Если порядок реакции отличается от единицы, лимитирующей скоростью является химическое превращение. Однако если порядок реакции равен единице, вопрос о лимитирующей скорости остается открытым, т. к. процесс массообмена зависит от концентрации также в первой степени.
3. Определение зависимости суммарной скорости процесса от гидродинамических условий его проведения.
Если скорость процесса не зависит от гидродинамических условий его проведения, то реакция проходит в кинетической области. В противном случае лимитирующей стадией является массоперенос. Так, например, если в реакторе с механическим перемешивающим устройством суммарная скорость процесса зависит от скорости вращения мешалки, то реакция проходит
в диффузионной области. Независимость скорости процесса от интенсивности перемешивания указывает на то, что процесс проходит в кинетической области.
Источник
Гетерогенные химические процессы в системе «газ-твердое вещество». Лимитирующая стадия. Зависимость скорости процесса от рабочих условий. Способы определения лимитирующей стадии.



Гетерогенные процессы – процессы, в которых участвуют вещества в различных фазах. Между фазами существует граница раздела фаз.
Глубина протекания гетерогенных процессов оценивается по изменению твердого вещества.
1) размеры твердой частицы уменьшаются;
2) размеры остаются постоянными.
Для описания гетерогенных процессов разработан ряд кинетических моделей. Наиболее распространены 2 модели:
1) модель квазигомогенная (гетерогенный процесс протекает одновременно в любой точке объема твердой частицы).
2) модель с фронтальным перемещением зоны реакции (модель с невзаимодействующим ядром).
— реакция начинается на внешней поверхности частицы и после ее завершения в реакцию вступают глубинные слои;
— с течением времени зона реакции продвигается вглубь частицы;
— за зоной реакции остается твердый продукт.
В произвольный момент времени твердая частица представляет собой внутреннее ядро, окруженное внешней оболочкой. Ядро состоит из непрореагировавшего реагента, поэтому эту модель называют моделью с непрореагировавшим ядром.
На примере гетерогенной реакции:
газ+тв в-во→газ+ тв в-во
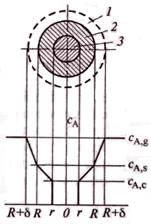
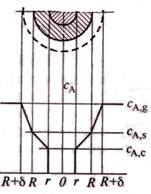
Профиль изменения концентрации газообразного реагента при взаимодействии с твердой частицей.
1-пограничная газовая пленка с концентрацией реагента А ниже, чем в газовом потоке; 2-слой твердых продуктов реакции (слой золы); 3-ядро непрореагировавшего реагента В.
Рассмотрим стадии гетерогенного процесса, которые описываются моделью с фронтальным перемещением зоны реакции.
I) внешняя диффузия – подвод реагента А к пов-ти твердой частицы через слой газа, обедненный этим компонентом.
Происходит в пограничном слое.
В результате протекания реакции aA+bB→продукты
концентрация газообразного реагента А у пов-ти твердой частицы ниже, чем в ядре газового потока. Пусть δ – толщина поверхностной газовой пленки. За ее пределами концентрация газообразного реагента постоянна и равна СA,g , а внутри пленки СА уменьшается от СA,g до концентрации на поверхности твердой частицы СA,s.
Вещество А переносится из ядра газового потока к пов-ти частицы за счет молекулярной диффузии (в результате хаотического движения молекул, не связанного с движением потоков жидкости) и вследствие конвективного переноса (движения с газовой средой в направлении, совпадающем с направлением потока).
wlA= -(1/F)*(dnA/dτ)=β(CAg-CAs) – скорость конвективной диффузии, т.е количество газообразного А перенесенного вследствие конвективной диффузии через единицу пов-ти в единицу времени.
β – коэффициент массоотдачи, зависящий от гидродинамики потока, β=D/δ1
D – коэф-т молекулярной диффузии
Повысить скорость внешней диффузии можно, увеличивая движущую силу, которая равна CAg-CAs, либо коэффициент массоотдачи.
II) внутренняя диффузия – проникновение газообразного реагента через поры твердого продукта реакции к поверхности ядра, на которой осуществляется химическое взаимодействие.
Закон Фика выражает скорость внутренней диффузии:
Dэф – эффективный коэф-т диффузии, учитывающий пористость твердого вещества.
Так как слой твердых продуктов реакции представляет собой определенное сопротивление переносу реагента А из пограничной газовой пленки к пов-ти ядра, то концентрация этого реагента по мере движения к поверхности ядра будет уменьшаться от СA,s на внешней поверхности твердой частицы до СА,с на поверхности ядра.
Если толщина слоя золы невелика, то:
Тогда скорость внутренней диффузии:
Измельчение твердых частиц продукта – основной путь интенсификации внутренней диффузии.
III) Химическая реакция на поверхности ядра
kS – константа скорости поверхностной химической реакции.
Если химическая реакция необратима, концентрация газообразного реагента на пов-ти ядра уменьшится от CA,c, достигнутой после стадии внутренней диффузии, до нуля (до полного расходования).
Скорость химической стадии может быть увеличена либо вследствие возрастания концентрации газообразного реагента CA,c, либо вследствие роста константы скорости kS.

Основной путь интенсификации гетерогенного процесса, протекающего в кинетической области, — повышение температуры.
Источник
Способы определения лимитирующих стадий
1) Экспериментальный способ.
Способ основан на изучении влияния различных факторов на суммарную скорость.
− Влияние температуры T
Лимитирует внешняя диффузия.
I – кинетическая область;
III – диффузионная область.
Рис. 8.7. Зависимость скорости гетерогенного процесса от температуры.
− Влияние скорости потока u
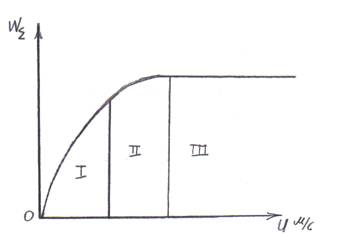
I – кинетическая область;
III – диффузионная область.
Рис. 8.8. Зависимость скорости гетерогенного процесса от линейной скорости потока.
− Влияние размера частицы R
I – кинетическая область;
III – диффузионная область.
Рис. 8.9. Зависимость скорости гетерогенного процесса от размера твердых частиц.
2) Экспериментально-расчетный способ.
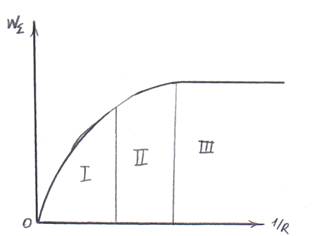
Состоит в том, что производится эксперимент и определяется продолжительность процесса τ=f (xB).
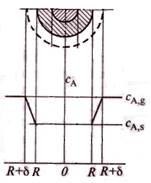
I – лимитирование процесса внешней диффузии;
II – лимитирование процесса внутренней диффузии;
III – лимитирование кинетической области.
Рис. 8.10. Зависимость степени превращения твердого реагента от времени пребывания твердой частицы в реакторе.
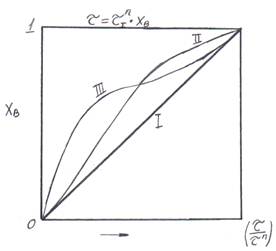
Рис. 8.11. К определению лимитирующей стадии.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Источник
Способы определения лимитирующих стадий и звеньев гетерогенного процесса
Лимитирующую стадию гетерогенного процесса можно определить по энергии активации, перепадам концентрации, влиянию перемешивания и концентрации реагирующего вещества на скорость процесса.
Определение лимитирующей стадии по энергии активации. Если сохранить прочие равные условия, то, определив скорости процесса 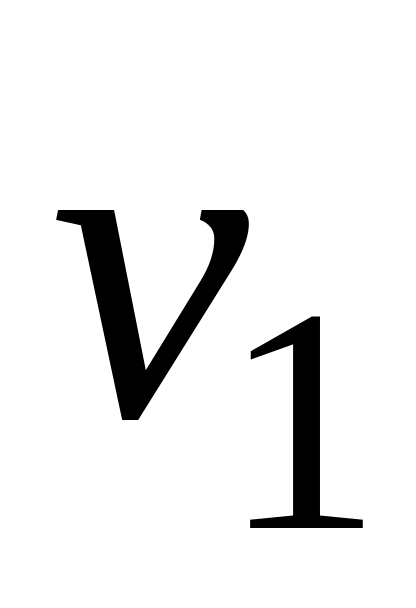
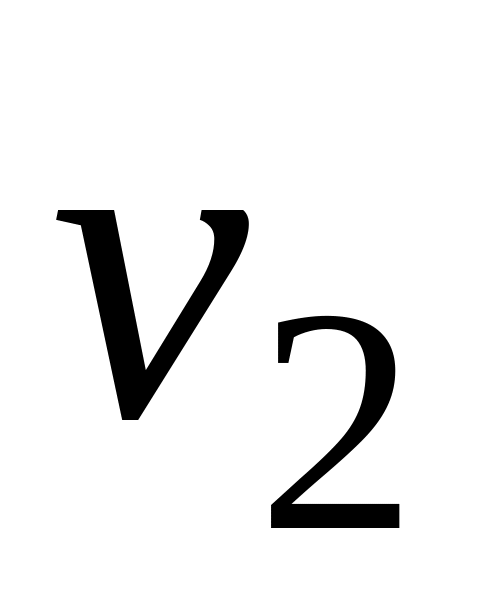
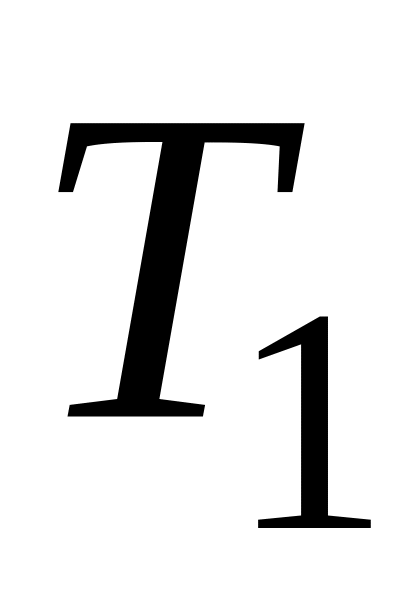
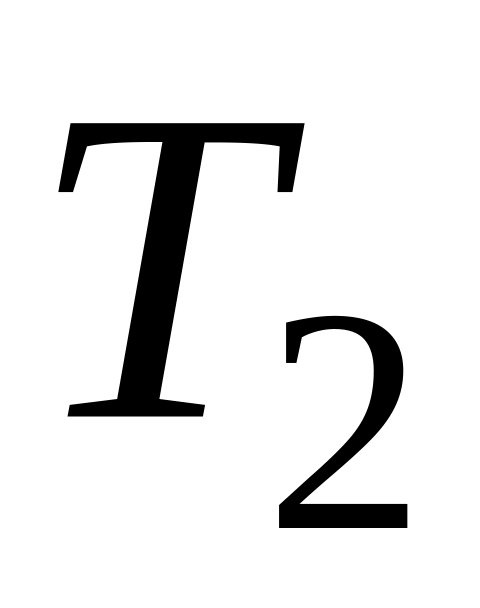
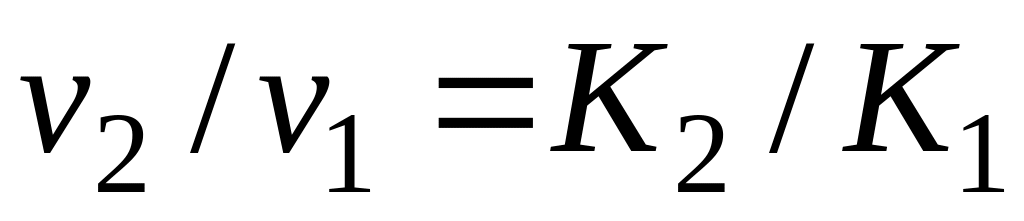
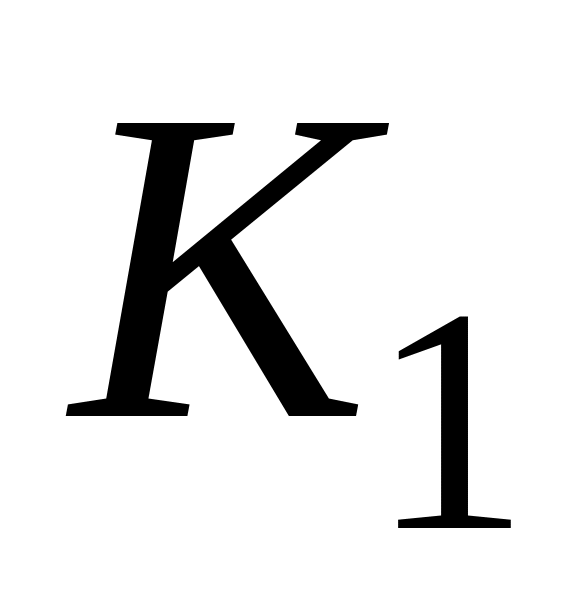
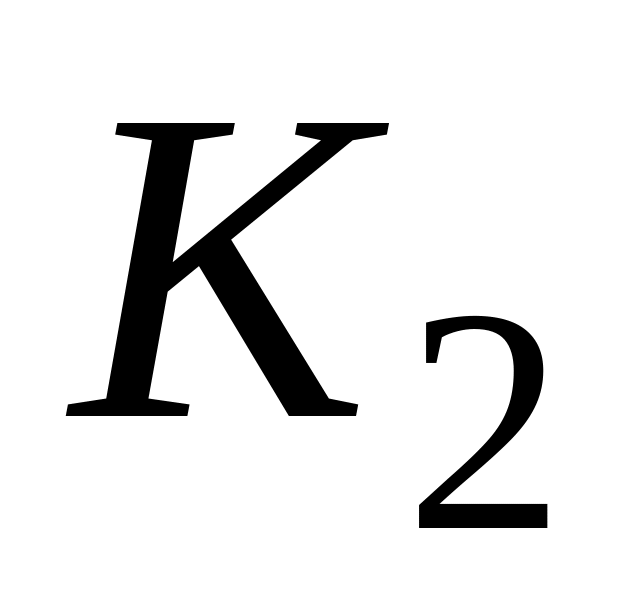
Логарифмируя (5.9) и выполняя алгебраическое сложение, получаем
Окончательно 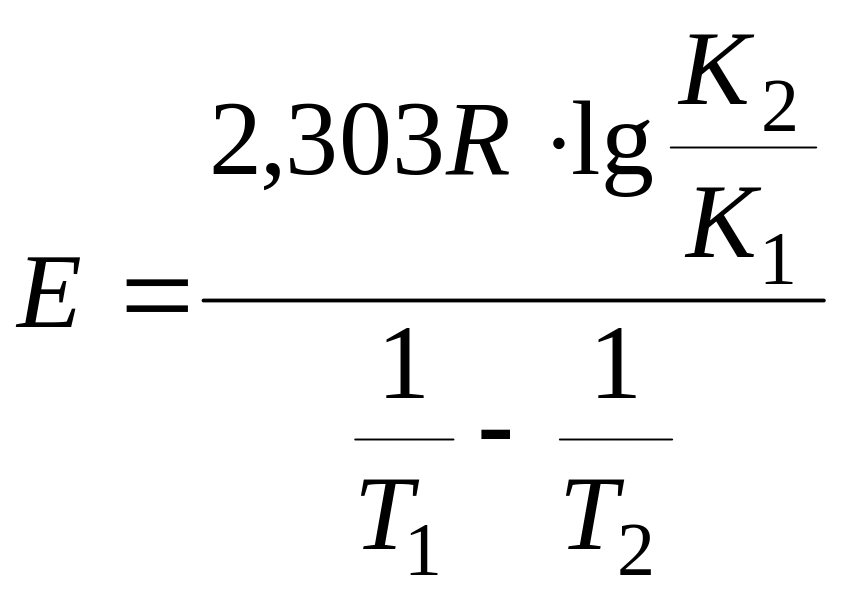
Как уже отмечалось, если процесс лимитируется химическими, адсорбционными звеньями и зарождением новых фаз, то 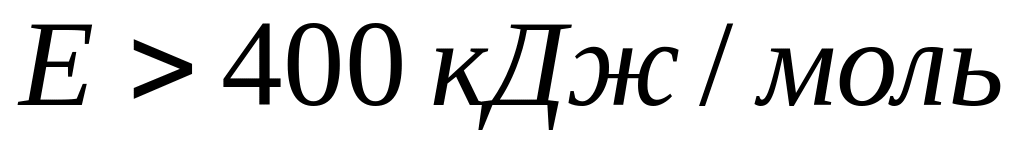
Пример. Опытами установлено, что в период безрудного кипения в мартеновской ванне (когда кислород поступает в металл только из атмосферы печи через шлак) скорость выгорания углерода 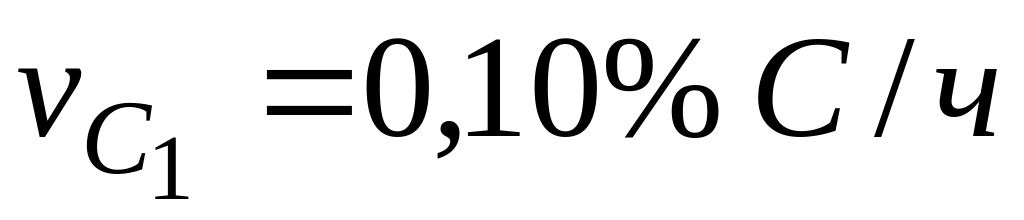

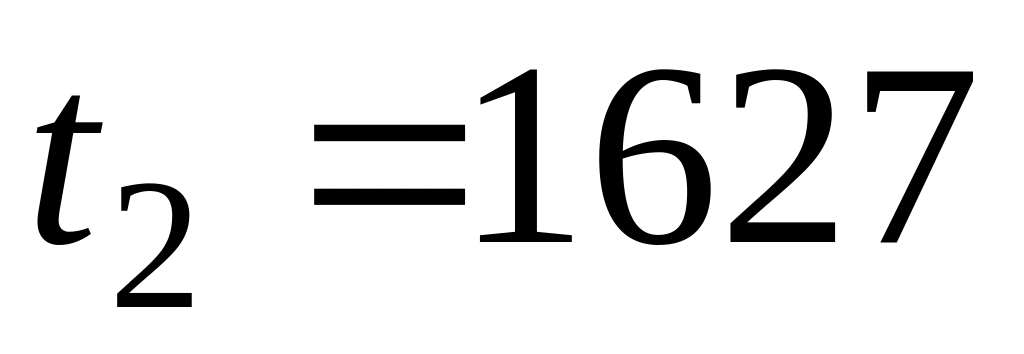
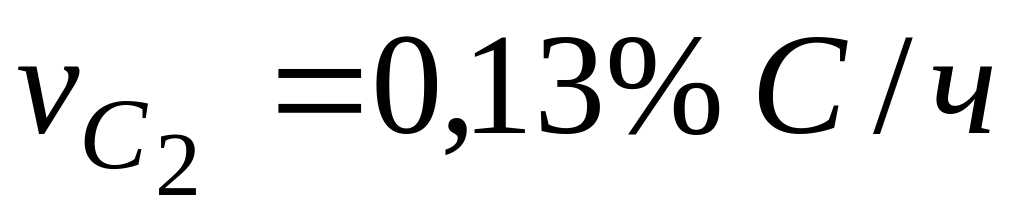
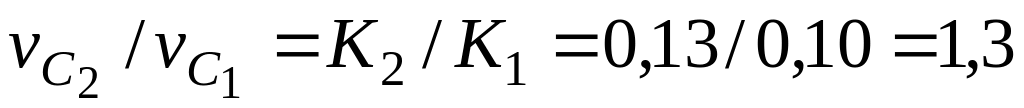
«Кажущаяся» энергия активации мала (150 ). Следовательно, процесс окисления углерода лимитируется одной из диффузионных стадий, но это не указывает, какая из них лимитирует процесс.
Определение лимитирующего звена по перепадам концентраций. Если процесс состоит из ряда последовательных диффузионных звеньев, то при стационарном процессе по закону сохранения массы скорости отдельных стадий (секундные диффузионные потоки, отнесенные к объему металла, ) и процесса в целом равны между собой:
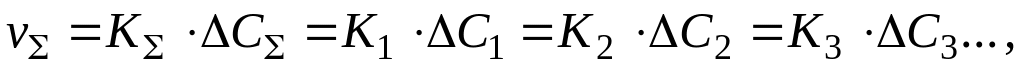
где 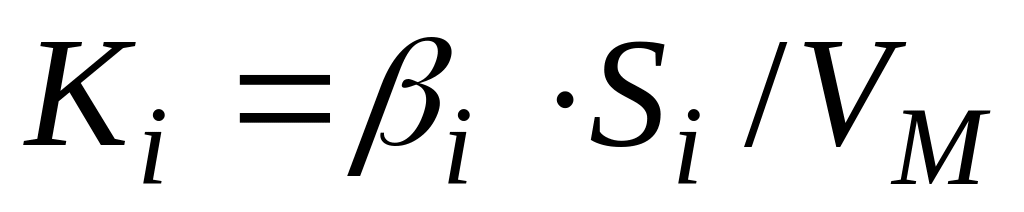
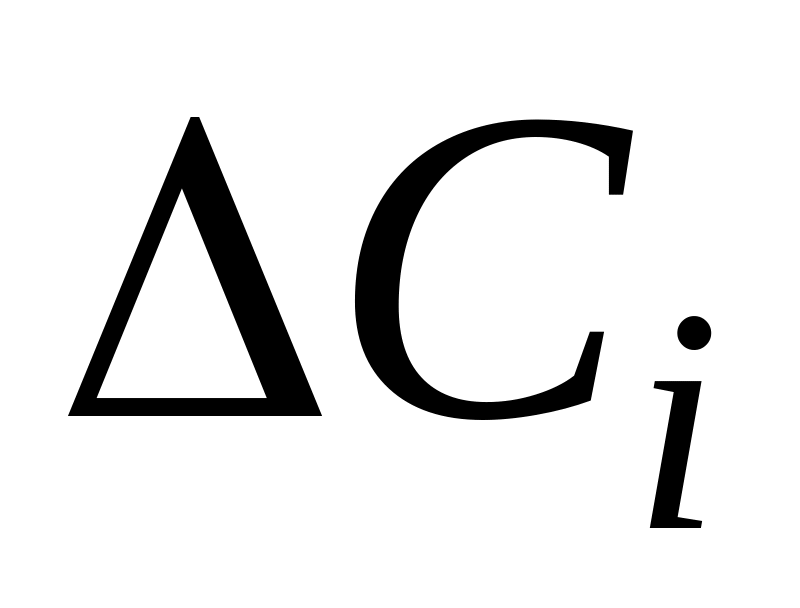
Очевидно, чем меньше 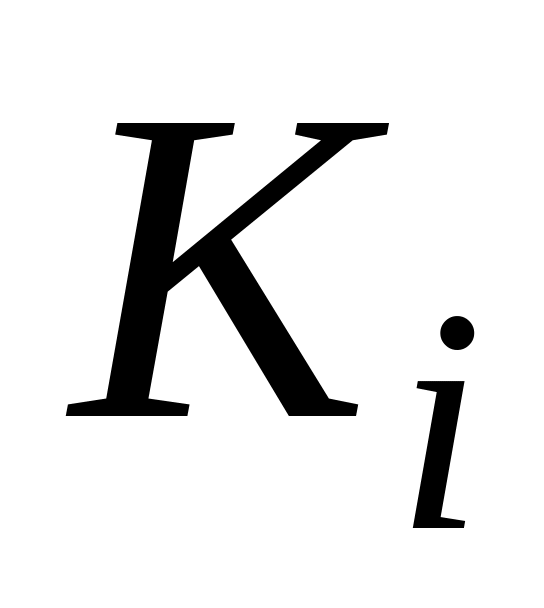
Здесь имеем полную аналогию с гидравликой, переносом электричества, теплоты и т.п. Наибольшее падение напора напряжения, температуры и т.п. наблюдается в звеньях цепи с максимальным сопротивлением.
«Сопротивление» каждого диффузионного звена [28]
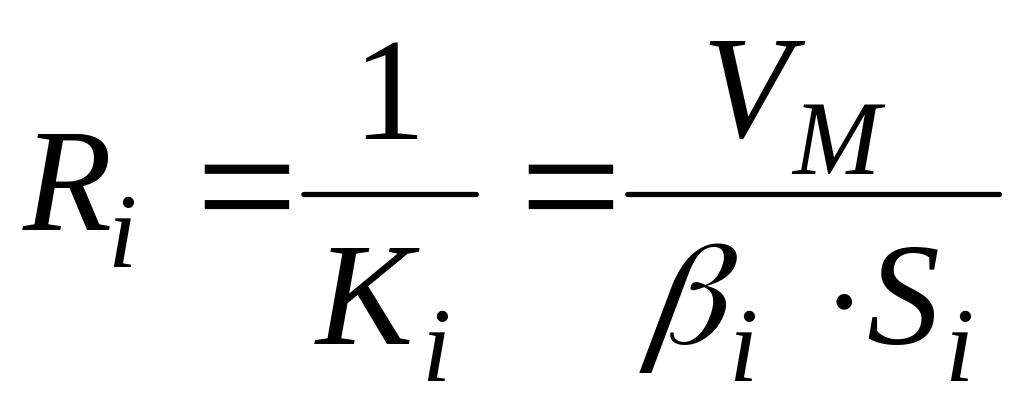
В [44; 54] неправильно обозначают 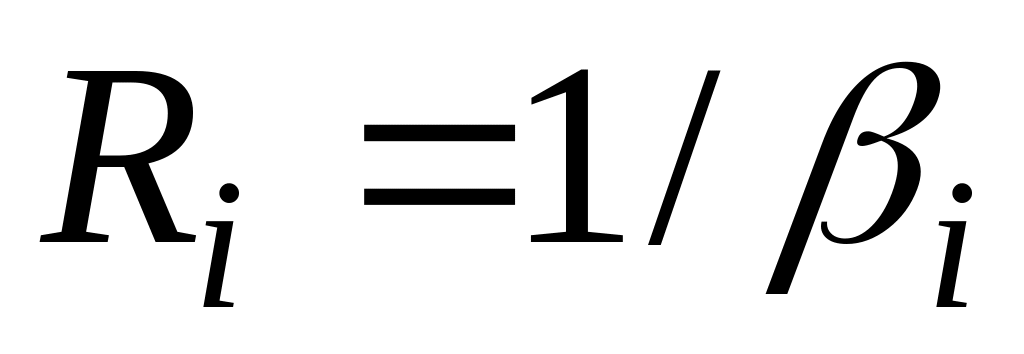
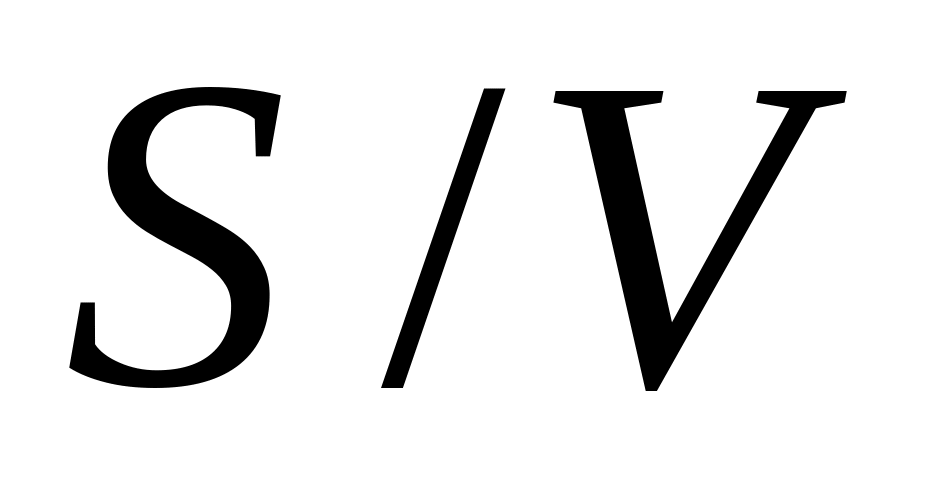
Общее «сопротивление» всей системы
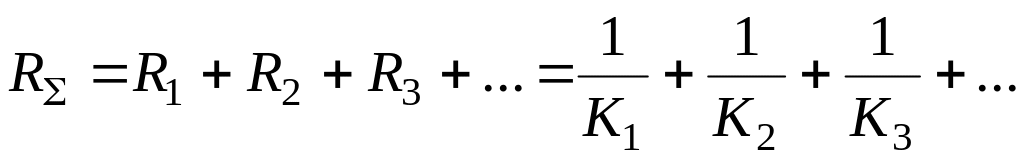
Общая скорость процесса
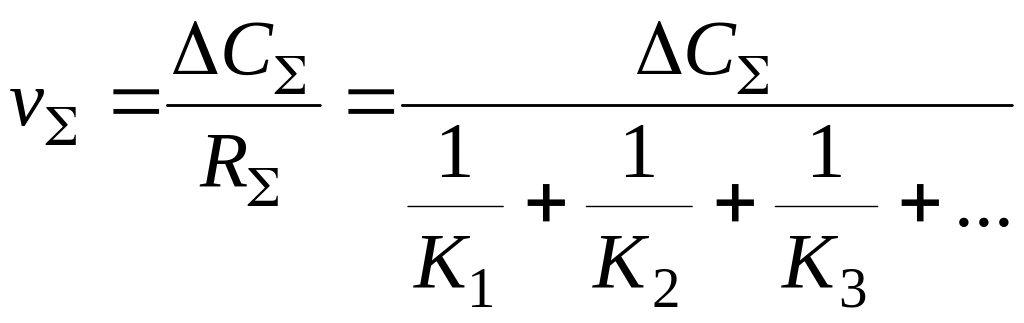
Из (5.14) следует, что суммарная константа скорости всего процесса

Очевидно, что если константа скорости наиболее медленного звена несоизмеримо меньше (более чем на 2 порядка), чем у остальных звеньев, то суммарная константа скорости всего процесса равна константе скорости наиболее медленного звена. Однако в литературе часто не учитывают, что если имеется несколько медленных звеньев с соизмеримыми значениями констант скорости, то константа скорости всего процесса значительно меньше, чем у наиболее медленного звена. Так, при значениях 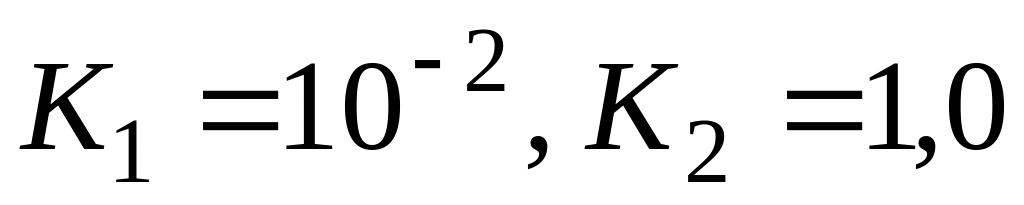
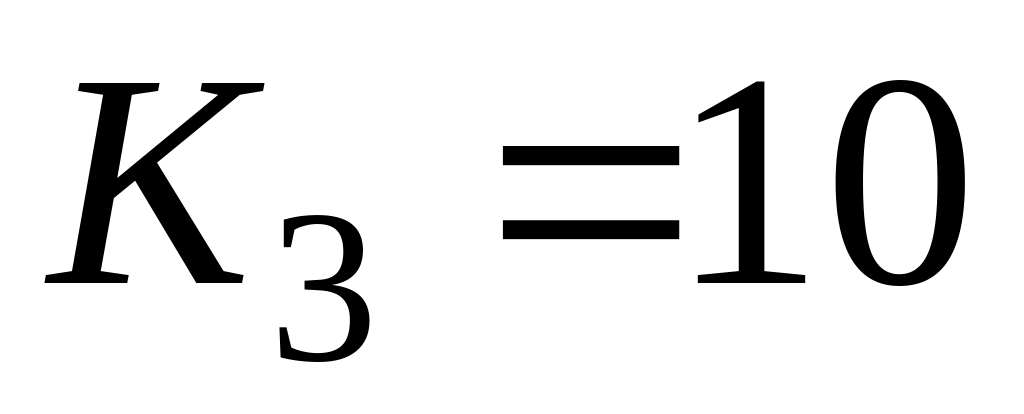
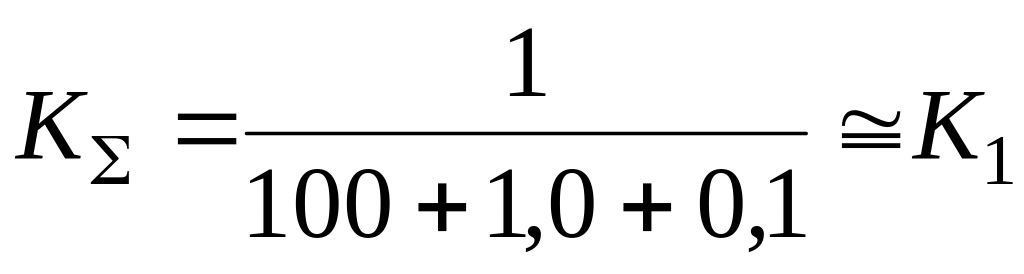
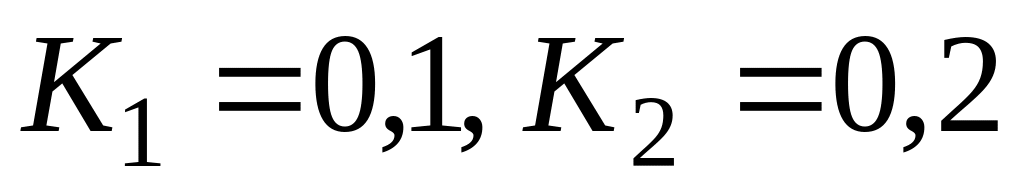
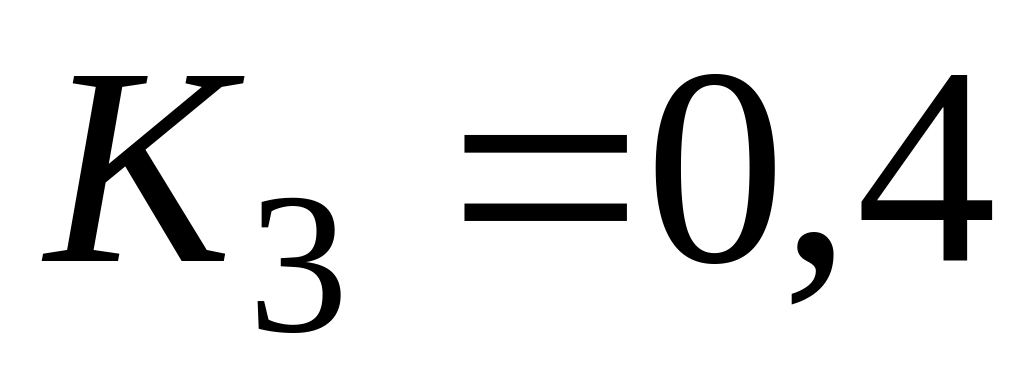
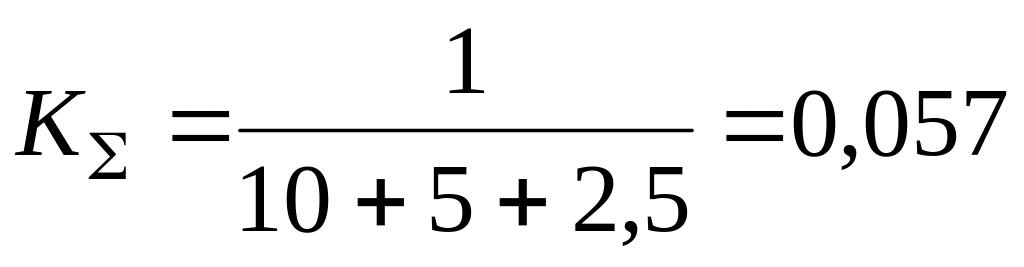
Источник