Практическая работа №6. Получение, собирание и распознавание газов. —
Вариант 1.
Опыт 1. Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в нее 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43) и наденьте на кончик трубки еще одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4. Опишите, как можно распознать водород.
Ответ:
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1-2 гранулы цинка и прилили в нее 1-2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки еще одну пробирку, подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Сняли пробирку с водородом и не переворачивая ее поднесли к горящей спиртовке. Чистый водород взрывается с глухим хлопком.
Опыт 2. Получение, собирание и распознавание аммиака
Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Вопросы и задания
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
3. Опишите не менее двух способов распознавания аммиака.
Ответ:
Собрали прибор для получения аммиака и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объемом по 1 ложечке для окисления веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли ее пробкой и укрепили на лапке штатива. На газоотводную трубку надели сухую пробирку для собирания аммиака. Пробирку со смесью хлорида аммония и гидроксида кальция нагрели.
Вариант 2.
Опыт 1. Получение, собирание и распознавание кислорода
Соберите прибор, как показано на рисунке 114, и проверьте его на герметичность. В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
Вопросы и задания
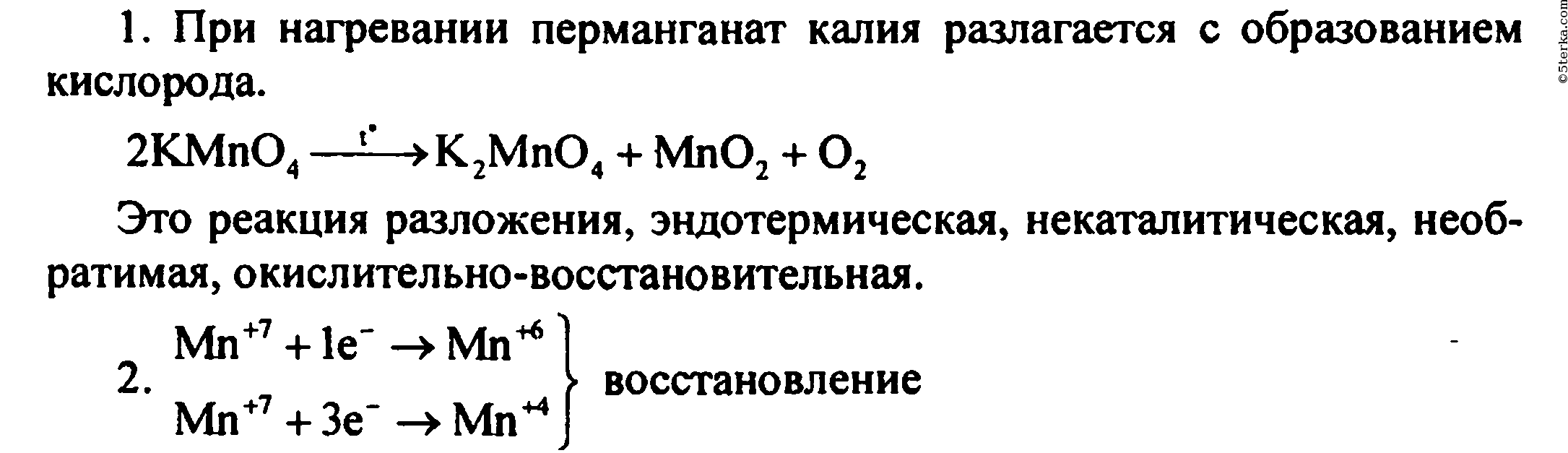
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали кислород.
Ответ:
Собрали прибор для получения кислорода и проверили его на герметичность. В пробирку насыпали примерно на 1/4 ее объема перманганата калия у отверстия пробирки положили рыхлый комочек ваты.
Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.
Опыт 2. Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1—2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2—3 мл известковой воды.
Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Вопросы и задания
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали оксид углерода (IV).
Ответ:
В пробирку поместили несколько кусочков мела и прилили 1 мл разбавленной соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку, в которой находится 2-3 мл известковой воды. Наблюдаем как через известковую воду проходят пузырьки газа.
Эта реакция является качественной на углекислый газ.
Источник
Лабораторный способ распознавания водорода
Тема 21. Водород.
Часть I
1. Строение атома: 1Н 1е
2. Строение молекулы. Молекула Н2 образована за счёт ковалентной неполярной химической связи.
Молекулярная формула — Н2.
Электронная формула – 1е
Структурная формула – Н-Н
3. Физические свойства водорода: бесцветный газ, без запаха, легче воздуха.
4. Заполните таблицу «Двойственное положение водорода в Периодической системе».
5. Химические свойства водорода (рассмотреть с позиций окисления-восстановления).
6. Получение, собирание и распознавание водорода.
1) Напишите уравнение реакции, соответствующее лабораторному способу получения водорода, и рассмотрите с позиций окисления-восстановления.
2) Эта реакция протекает в аппарате киппа или приборе Кирюшкина. Укажите верный способ собирания водорода (Б), ответ поясните.
Н2 легче воздуха, поэтому будет собираться в верхней части пробирки.
3)
7. Дополните схему «Применение водорода».
Часть II
1. На Земле в чистом виде водород не встречается, а в космосе самый распространённый.
Заполните схему «Водород и его соединения в природе».
2. Установите соответствие между продуктами реакции и исходными веществами.
3. Запишите уравнения реакций возможных способов получения водорода в лаборатории и рассмотрите с позиций окисления-восстановления.
4. Закончите уравнение реакции и рассмотрите её с позиций окисления-восстановления.
К какому типу металлургии можно отнести данный процесс?
— пирометаллургия
5. Какой объём воздуха нужен для сжигания 120 м3 водорода?
6. На основании решения задания 5 сформулируйте правило Гей-Люссака: объёмы газообразных веществ, участвующих в реакции, соотносятся между собой как небольшие целые числа.
7. Вспомните и запишите определение.
Изотопы – это разновидности химического элемента с одинаковым зарядом ядра и разным массовым числом.
8. Укажите три вида изотопов водорода.
9. Используя Интернет и другие источники информации подготовьте презентацию на тему «Применение тяжёлых изотопов водорода». Запишите план презентации в особой тетради.
Источник
Практическая работа № 6(н). Получение, собирание и распознавание газов
Получение, собирание и распознавание водорода
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1—2 гранулы цинка и прилейте в нее 1—2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43) и наденьте на кончик трубки еще одну пробирку. Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Снимите пробирку с водородом и, не переворачивая ее, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Вопросы и задания
1. Что происходит при взаимодействии цинка с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства водорода, непосредственно наблюдаемые при проведении опыта.
4. Опишите, как можно распознать водород.
Ответы:
Собрали прибор для получения газов и проверили его на герметичность. В пробирку положили 1-2 гранулы цинка и прилили в нее 1-2 мл соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой и надели на кончик трубки еще одну пробирку, подождали некоторое время, чтобы пробирка заполнилась выделяющимся газом.
Сняли пробирку с водородом и не переворачивая ее поднесли к горящей спиртовке. Чистый водород взрывается с глухим хлопком.

Получение, собирание и распознавание аммиака

Соберите прибор, как показано на рисунке 113, и проверьте его на герметичность.
В фарфоровую чашку насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке для сжигания веществ. Смесь перемешайте стеклянной палочкой и высыпьте в сухую пробирку. Закройте ее пробкой и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия!). На газоотводную трубку наденьте сухую пробирку для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогрейте сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
Для обнаружения аммиака поднесите к отверстию перевернутой вверх дном пробирки влажную фенолфталеиновую бумажку.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, снимите с газоотводной трубки. Конец газоотводной трубки сразу же закройте кусочком мокрой ваты.
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что вы наблюдаете? Почему вода поднялась в пробирке? Закройте пальцем отверстие пробирки под водой и выньте ее из сосуда. Добавьте в пробирку 2—3 капли раствора фенолфталеина. Что наблюдаете?
Проведите аналогичную реакцию между растворами щелочи и соли аммония при нагревании. Поднесите к отверстию пробирки влажную индикаторную бумажку. Что наблюдаете?
Вопросы и задания
1. Что происходит при взаимодействии хлорида аммония и гидроксида кальция? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Опишите физические свойства аммиака, непосредственно наблюдаемые в опыте.
3. Опишите не менее двух способов распознавания аммиака.
Ответы:
Собрали прибор для получения аммиака и проверили его на герметичность. В фарфоровую чашку насыпали хлорид аммония и гидроксид кальция объемом по 1 ложечке для окисления веществ. Смесь перемешали стеклянной палочкой и высыпали в сухую пробирку. Закрыли ее пробкой и укрепили на лапке штатива. На газоотводную трубку надели сухую пробирку для собирания аммиака. Пробирку со смесью хлорида аммония и гидроксида кальция нагрели.

Получение, собирание и распознавание кислорода
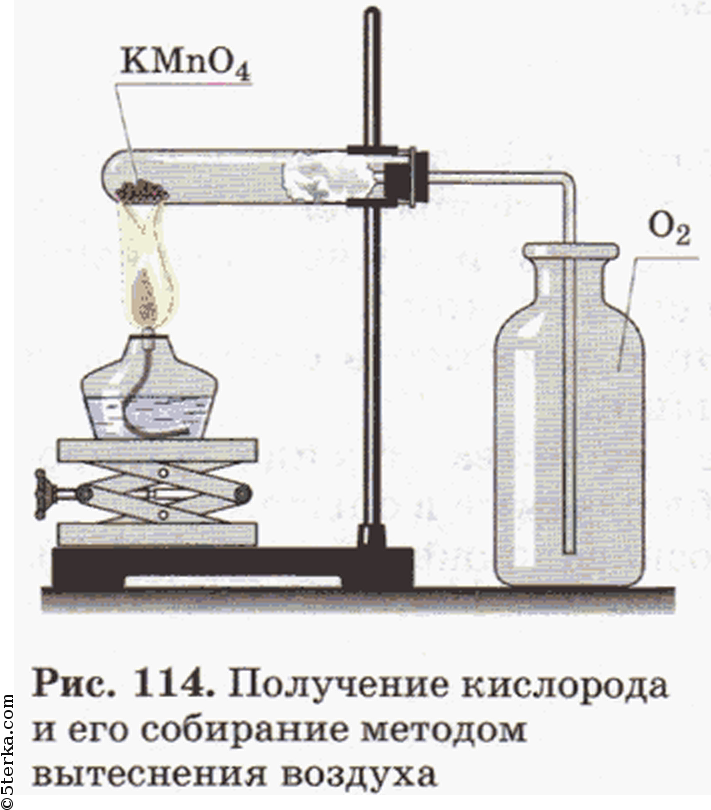
Соберите прибор, как показано на рисунке 114, и проверьте его на герметичность. В пробирку насыпьте примерно на ¼ ее объема перманганата калия KMnO4 и у отверстия пробирки положите рыхлый комочек ваты. Закройте пробирку пробкой с газоотводной трубкой. Укрепите пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Наличие кислорода в сосуде проверьте тлеющей лучинкой.
Вопросы и задания
1. Что происходит при нагревании перманганата калия? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите записанную реакцию с точки зрения процессов окисления-восстановления.
3. Опишите физические свойства кислорода, непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали кислород.
Ответы:
Собрали прибор для получения кислорода и проверили его на герметичность. В пробирку насыпали примерно на 1/4 ее объема перманганата калия у отверстия пробирки положили рыхлый комочек ваты.
Закрыли пробирку пробкой с газоотводной трубкой. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород.

Получение, собирание и распознавание оксида углерода (IV)
В пробирку поместите несколько кусочков мела или мрамора и прилейте 1—2 мл разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку, в которой находится 2—3 мл известковой воды.
Несколько минут наблюдайте, как через известковую воду проходят пузырьки газа.
Вопросы и задания
1. Что происходит при взаимодействии мела или мрамора с соляной кислотой? Составьте уравнение реакции и дайте ее характеристику по всем изученным признакам классификации химических реакций.
2. Рассмотрите проведенную реакцию в свете теории электролитической диссоциации.
3. Опишите физические свойства оксида углерода (IV), непосредственно наблюдаемые в опыте.
4. Опишите, как вы распознавали оксид углерода (IV).
Ответы:
В пробирку поместили несколько кусочков мела и прилили 1 мл разбавленной соляной кислоты. Закрыли пробирку пробкой с газоотводной трубкой. Конец трубки опустили в другую пробирку, в которой находится 2-3 мл известковой воды. Наблюдаем как через известковую воду проходят пузырьки газа.

Эта реакция является качественной на углекислый газ.

задача №6
к главе «Практические работы».
Источник