- Оксид серы (IV)
- Cпособы получения оксида серы (IV)
- Химические свойства оксида серы (IV)
- Лабораторный способ получения сернистого газа
- Методы получения диоксида серы
- Двуокись серы
- Восстановление серной кислоты медью
- Реактивы
- Аппаратура
- Получение.
- Разложение сульфитов металлов кислотами
- Реактивы
- Аппаратура
- Получение.
- Очистка технической сжиженной двуокиси серы
- Испытание чистоты
- Хранение
- Сернистый газ — физические свойства, получение и применение
- Систематические и тривиальные названия вещества
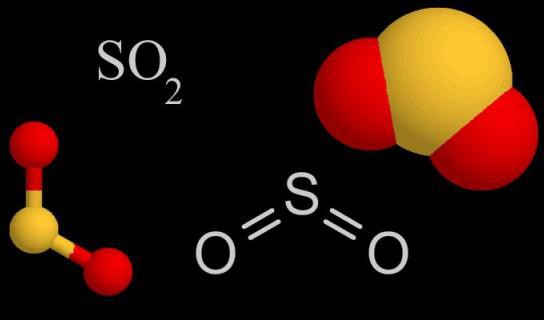
- Состав и особенности молекулярного строения SO2
- Некоторые физические параметры диоксида серы
- Растворимость и взаимодействие с водой
- Сернистый газ в природе
- Сернистый газ — получение в лаборатории и в промышленности
- Основные химические свойства диоксида серы
- Практическое использование сернистого газа
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Источник
Лабораторный способ получения сернистого газа
Методы получения диоксида серы
| Авторы: | Рапопорт Ф. М., Ильинская А. А. |
| Источник: | Рапопорт, Ф. М. Лабораторные методы получения чистых газов : научное издание / Ф. М. Рапопорт, А. А. Ильинская.,с.157-159 — М. : Госхимиздат, 1963. — 419 с. |
Двуокись серы
Двуокись серы SO2 — бесцветный, негорючий газ с резким раздражающим запахом. Молекулярный вес 64,06. Молярный объем 21,89 д. Вес 1 л газа при 0°С и 760 мм рт. ст. 2.9263 г. Температура кипения —10,0 °С; температура плавления —75,5°С. Плотность по воздуху при 0°С и 760 мм рт. ст. 2,2635.
Двуокись серы ядовита. Предельно допустимая концентрация двуокиси серы в воздухе составляет 0,02 мг/л.
Восстановление серной кислоты медью
При нагревании концентрированной серной кислоты в присутствии меди выделяется двуокись серы:
Получаемый газ содержит примесь серного ангидрида, влаги и воздуха, от которых его необходимо очистить.
Реактивы
Медные стружки, обезжиренные и промытые.
Серная кислота, х. ч., концентрированная
Пятиокись фосфора, ч д. а., воэогнанная в токе кислорода .
Аппаратура
Получение гаэа проводят в толстостенной реакционной колбе емкостью около 500 мл. Колбу закрывают пришлифованной пробкой, в которую впаяна капельная воронка (конец воронки доходит почти до дна колбы) и трубка, отводящая гаэ. Для очистки газа от примеси триоксида серы и высушивания к отводной трубке присоединяют последовательно промывную склянку с концентрированной серной кислотой и колонку с пятиокисью фосфора. После очистки гаэ поступает в приемник-конденсатор, где он сжижается.
Получение.
В реакционную колбу прибора помещают очищенные медные стружки и концентрированную серную кислоту, взятые в равных весовых частях. Нагревают колбу на песчаной бане. Выделяющаяся двуокись серы после очистки конденсируется в приемнике при охлаждении смесью твердой углекислоты и ацетона до температуры около — 70 °С. Скорость выделения газа регулируют силой нагрева и скоростью прибавления серной кислоты. Несконденснрованные газы над сжиженной двуокисью серы откачивают. Если желательно получить газ особой чистоты, сжиженный продукт подвергают фракционированной перегонке. Наиболее чистой является средняя фракция.
Разложение сульфитов металлов кислотами
Сульфит натрия в растворе разлагают концентрированной серной кислотой:
Выделяющийся газ, содержащий примесь воздуха, водяных gаров и серного ангидрида, очищают,высушивают и конденсируют. При необходимости проводят дополнительную очистку методом фракционированной дистилляции.
Реактивы
Сульфит натрия, безводный, ч. д. а.
Серная кислота, х. ч., концентрированная .
Пятиокись фосфора, ч. д. а., воэогнанная в токе кислорода.
Аппаратура
Для получения двуокиси серы иэ сульфита натрия пользуются прибором, описанным выше.
Получение.
Приготовляют раствор сульфита натрия в предварительно прокипяченной воде из расчета 70 г сульфита натрня в 120 г воды и наливают приготовленный раствор в реакционную колбу прибора. В капельную воронку вводят концентрированную серную кислоту и постепенно прибавляют кислоту к раствору в колбе. Двуокись серы выделяется равномерным потоком и после промывания раствором серной кислоты (для поглощения SOa и частичного высушивания) и высушивания пятиокисью фосфора конденсируется в приемнике при охлаждении смесью твердой углекислоты к ацетона.
Полученный газ пригоден для большинства обычных работ, проводимых в лаборатории. Для исследований, где требуется газ высокой степени чистоты, необходимо провести фракционную дистилляцию .
Очистка технической сжиженной двуокиси серы
Жидкий сернистый ангидрид в баллонах, в зависимости от содержания влаги, выпускается двух сортов.
Ангидрид сернистый жидкий технический (ГОСТ 2918—45J, содержит следующие примеси: нелетучий остаток—не более 0,1%; мышьяк — не более 2*10 5 %. Содержание влаги не perламентируется.
Ангидрид сернистый жидкий безводный (ТУ MXIT 2083—50), получаемый обезвоживанием жидкого технического сернистого ангидрида, представляет собой тродукт, в котором содержание влаги не должно превышать 0,0035%.
Как видно из приведенных показателей, применение сжиженного технического сернистого ангидрида в качестве исходного материала для получения газообразной двуокиси серы при соответствующей очистке может обеспечить получение чистого газа. Для этой цели рекомендуется использовать баллон, из которого уже отбирали газ; чем больше газа отобрано предварительно из баллона, тем меньше трудно конденсируемых примесей содержит испаряемый газ. Газообразную двуокись серы промывают концентрированной серной кислотой, высушивают над лятнокнсью фосфора и конденсируют.
Полученный газ можно применять непосредственно, без дальнейшей очистки. В случае необходимости дополнительную очистку проводят с помощью однократной перегонки и сжижения или фракционной перегонки.
Испытание чистоты
Чистоту газа устанавливают по давлению его паров в сжиженном, состоянии . Эффективность фракционной дистилляции проверяют сравнением давления парой отдельных фракций (начальных и -конечных); разница в давлении должна составлять не более 0,2—0,3 мм рт. ст.
Хранение
Сухую двуокись серы можно сохранять в стеклянных сосудах над ртутью, а также в сжиженном состоянии в приемниках, охлаждаемых до температуры ниже температуры кипения двуокиси серы.
Источник
Сернистый газ — физические свойства, получение и применение
Сернистый газ имеет молекулярное строение, аналогичное озону. Атом серы, находящийся в центре молекулы, связан с двумя атомами кислорода. Этот газообразный продукт окисления серы не имеет цвета, издает резкий запах, при изменении условий легко конденсируется в прозрачную жидкость. Вещество хорошо растворимо в воде, обладает антисептическими свойствами. В больших количествах получают SO2 в химической промышленности, а именно в цикле сернокислотного производства. Газ широко используется для обработки сельскохозяйственных и пищевых продуктов, отбеливания тканей в текстильной промышленности.
Систематические и тривиальные названия вещества
Необходимо разобраться в многообразии терминов, относящихся к одному и тому же соединению. Официальное название соединения, химический состав которого отражает формула SO2, — диоксид серы. ИЮПАК рекомендует использовать этот термин и его английский аналог — Sulfur dioxide. Учебники для школ и ВУЗов чаще упоминают еще такое название — оксид серы (IV). Римской цифрой в скобках обозначена валентность атома S. Кислород в этом оксиде двухвалентен, а окислительное число серы +4. В технической литературе используются такие устаревшие термины, как сернистый газ, ангидрид сернистой кислоты (продукт ее дегидратации).
Состав и особенности молекулярного строения SO2
Молекула SO2 образована одним атомом серы и двумя атомами кислорода. Между ковалентными связями имеется угол, составляющий 120°. В атоме серы происходит sp2-гибридизация — выравниваются по форме и энергии облака одного s и двух p-электронов. Именно они участвуют в образовании ковалентной связи между серой и кислородом. В паре О—S расстояние между атомами составляет 0,143 нм. Кислород более электроотрицательный элемент, чем сера, значит, связывающие пары электронов смещаются от центра к внешним углам. Вся молекула тоже поляризована, отрицательный полюс — атомы О, положительный — атом S.
Некоторые физические параметры диоксида серы
Оксид четырехвалентной серы при обычных показателях окружающей среды сохраняет газообразное агрегатное состояние. Формула сернистого газа позволяет определить его относительную молекулярную и молярную массы: Mr(SO2) = 64,066, М = 64,066 г/моль (можно округлять до 64 г/моль). Этот газ почти в 2,3 раза тяжелее воздуха (М(возд.) = 29 г/моль). Диоксид обладает резким специфическим запахом горящей серы, который трудно перепутать с каким-либо другим. Он неприятный, раздражает слизистые покровы глаз, вызывает кашель. Но оксид серы (IV) не такой ядовитый, как сероводород.
Под давлением при комнатной температуре газообразный сернистый ангидрид сжижается. При низких температурах вещество находится в твердом состоянии, плавится при –72…–75,5 °C. При дальнейшем повышении температуры появляется жидкость, а при –10,1 °C вновь образуется газ. Молекулы SO2 являются термически устойчивыми, разложение на атомарную серу и молекулярный кислород происходит при очень высоких температурах (около 2800 ºС).
Растворимость и взаимодействие с водой
Диоксид серы при растворении в воде частично взаимодействует с ней с образованием очень слабой сернистой кислоты. В момент получения она тут же разлагается на ангидрид и воду: SO2 + Н2О ↔ Н2SO3. На самом деле в растворе присутствует не сернистая кислота, а гидратированные молекулы SO2. Газообразный диоксид лучше взаимодействует с прохладной водой, его растворимость понижается с повышением температуры. При обычных условиях может раствориться в 1 объеме воды до 40 объемов газа.
Сернистый газ в природе
Значительные объемы диоксида серы выделяются с вулканическими газами и лавой во время извержений. Многие виды антропогенной деятельности тоже приводят к повышению концентрации SO2 в атмосфере.
Сернистый ангидрид поставляют в воздух металлургические комбинаты, где не улавливаются отходящие газы при обжиге руды. Многие виды топливных ископаемых содержат серу, в результате значительные объемы диоксида серы выделяется в атмосферный воздух при сжигании угля, нефти, газа, полученного из них горючего. Сернистый ангидрид становится токсичным для человека при концентрации в воздухе свыше 0,03 %. У человека начинается одышка, могут наступить явления, напоминающие бронхит и воспаление легких. Очень высокая концентрация в атмосфере диоксида серы может привести к сильному отравлению или летальному исходу.
Сернистый газ — получение в лаборатории и в промышленности
- При сжигании серы в колбе с кислородом или воздухом получается диоксид по формуле: S + O2 = SO2.
- Можно подействовать на соли сернистой кислоты более сильными неорганическими кислотами, лучше взять соляную, но можно разбавленную серную:
- Na2SO3 + 2HCl = 2NaCl + H2SO3;
- Na2SO3 + H2SO4 (разб.) = Na2SO4 + H2SO3;
- H2SO3 = Н2О + SO2↑.
3. При взаимодействии меди с концентрированной серной кислотой выделяется не водород, а диоксид серы:
Современные способы промышленного производства сернистого ангидрида:
- Окисления природной серы при ее сжигании в специальных топках: S + О2 = SO2.
- Обжиг железного колчедана (пирита).
Основные химические свойства диоксида серы
Сернистый газ является активным соединением в химическом плане. В окислительно-восстановительных процессах это вещество чаще выступает в качестве восстановителя. Например, при взаимодействии молекулярного брома с диоксидом серы продуктами реакции являются серная кислота и бромоводород. Окислительные свойства SO2 проявляются, если пропускать этот газ через сероводородную воду. В результате выделяется сера, происходит самоокисление-самовосстановление: SO2 + 2H2S = 3S + 2H2O.
Диоксид серы проявляет кислотные свойства. Ему соответствует одна из самых слабых и неустойчивых кислот — сернистая. Это соединение в чистом виде не существует, обнаружить кислотные свойства раствора диоксида серы можно с помощью индикаторов (лакмус розовеет). Сернистая кислота дает средние соли — сульфиты и кислые — гидросульфиты. Среди них встречаются стабильные соединения.
Процесс окисления серы в диоксиде до шестивалентного состояния в ангидриде серной кислоты — каталитический. Получившееся вещество энергично растворяется в воде, реагирует с молекулами Н2О. Реакция является экзотермической, образуется серная кислота, вернее, ее гидратированная форма.
Практическое использование сернистого газа
Основной способ промышленного производства серной кислоты, для которого нужен диоксид элемента, насчитывает четыре стадии:
- Получение сернистого ангидрида при сжигании серы в особых печах.
- Очищение полученного диоксида серы от всевозможных примесей.
- Дальнейшее окисление до шестивалентной серы в присутствии катализатора.
- Абсорбция триоксида серы водой.
Ранее почти всю двуокись серы, необходимую для производства серной кислоты в промышленных масштабах, получали при обжиге пирита как побочный продукт сталеплавильного производства. Новые виды переработки металлургического сырья меньше используют сжигание руды. Поэтому основным исходным веществом для сернокислотного производства в последние годы стала природная сера. Значительные мировые запасы этого сырья, его доступность позволяют организовать широкомасштабную переработку.
Диоксид серы находит широкое применение не только в химической промышленности, но и в других отраслях экономики. Текстильные комбинаты используют это вещество и продукты его химического взаимодействия для отбеливания шелковых и шерстяных тканей. Это один из видов бесхлорного отбеливания, при котором волокна не разрушаются.
Диоксид серы обладает отличными дезинфицирующими свойствами, что находит применение в борьбе с грибками и бактериями. Сернистым ангидридом окуривают хранилища сельскохозяйственной продукции, винные бочки и подвалы. Используется SO2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Сульфитизация
сока сахарной свеклы обесцвечивает и обеззараживает сырье. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве антиокислительного и консервирующего агента.
Источник