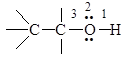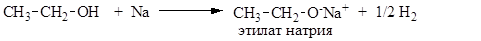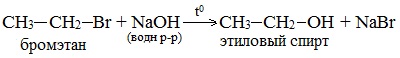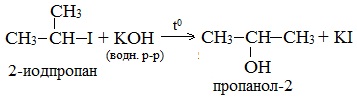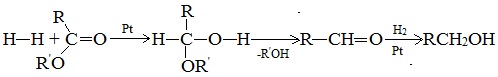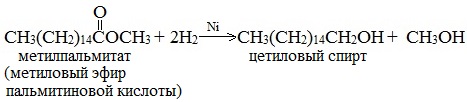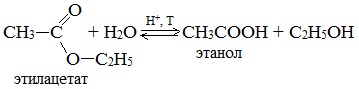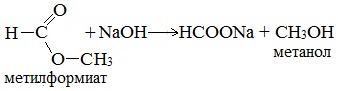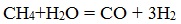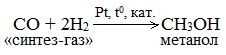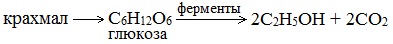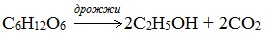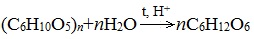Лабораторные методы получения спиртов
1. Гидролиз галогеналканов в водных растворах щелочей происходит по механизму нуклеофильного замещения (см. лекцию №12)
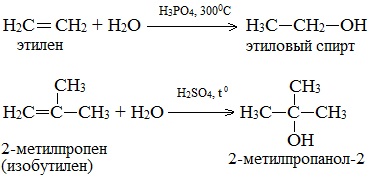
Гидратация алкенов
Присоединение воды к алкену протекает в присутствии кислотных катализаторов (H2SO4, H3PO4, оксид алюминия и другие носители, обработанные кислотами).
Этим методом в крупных масштабах получают низшие спирты, из них важнейшим продуктом является этанол:
из пропилена и н-бутилена — изопропиловый и н-бутиловый спирты:
а из изобутилена — трет-бутиловый спирт:
Электрофильный механизм гидратации уже рассматривался ранее. Присоединение протекает по правилу марковникова, реакционная способность алкенов определяется сравнительной стабильностью образующихся карбокатионов и изменяется в ряду:
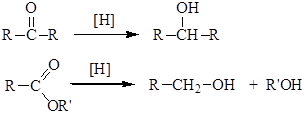
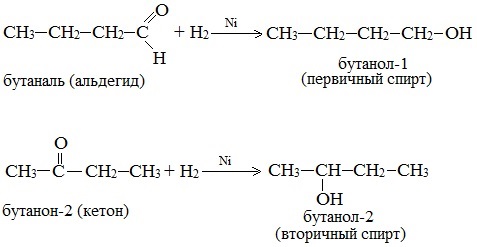
3. Восстановление карбонильных соединений (кетонов и альдегидов), сложных эфиров
Альдегиды и кетоны легко восстанавливаются водородом в присутствии катализаторов (например, Ni, Pd, Pt) в соответствующие первичные и вторичные спирты:
Для восстановления карбонильной группы также широко используются комплексные гидриды металлов — боргидрид натрия NaBH4 (растворитель — вода, этанол) или алюмогидрид лития LiAlH4 (растворитель — абсолютный эфир). Карбонильные соединения также можно восстанавливать атомарным водородом, образующимся при взаимодействии металлического натрия с этиловым спиртом.
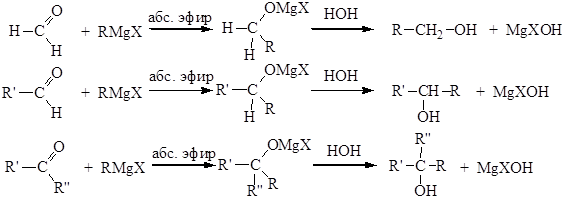
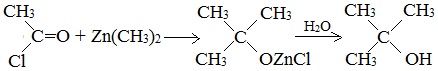
Синтезы спиртов с использованием реактивов Гриньяра
При взаимодействии реактивов Гриньяра (RMgHal) и литийорганических соединений с карбонильными производными образуются алкоголяты металлов, которые при действии воды или разбавленной кислоты можно превратить в соответствующие спирты. Взаимодействие реактивов гриньяра с формальдегидом, другими альдегидами и кетонами представляет собой прекрасный способ получения первичных, вторичных и третичных спиртов:
Промышленные методы получения спиртов
1. Окисление алканов (синтез спиртов С10-С20). Спирты нормального строения С10-С20 представляют интерес в качестве сырья для синтеза поверхностно-активных веществ. Производство этих спиртов путем окисления парафина по методу А.Н. Башкирова было впервые разработано и реализовано в СССР. Окисление ведут кислородом воздуха в присутствии 4-5% борной кислоты, которая связывает образующиеся спирты в эфиры, не подвергающиеся дальнейшему окислению:
Полученные спирты, образующиеся без деструкции углеродной цепи, являются преимущественно вторичными, с примесью гликолей и кетоспиртов.
Эта фракция как сырье для ПАВ имеет небольшую ценность, и метод широкого распространения не получил.
2. Синтез спиртов по методу Фишера-Тропша. При высоком давлении СО и Н2 образует смесь кислородсодержащих соединений (синтол) — спиртов, альдегидов, кетонов, карбоновых кислот и сложных эфиров. Этот метод нашел широкое применение для синтеза метанола:
3. Процесс оксосинтеза. Реакция открыта Реленом в 1938 г. Назначение процесса – получение из алкенов и синтез-газа (СО+Н2) альдегидов и их гидрирование до спиртов:
Первичные спирты С10-С18 линейного строения являются сырьем для производства ПАВ типа алкилсульфатов, которые отличаются высоким индексом биоразлагаемости, спирты С7-С9 служат полупродуктами для получения сложноэфирных пластификаторов, особенно фталатов.
4. Ферментативный гидролизуглеводов под действием бактерий Clostridium acetobutilicum. Этим методом получают н-бутанол в смеси с ацетоном.
Физические свойства спиртов
Многие физические и химические свойства спиртов, особенно низкомолекулярных, (относительно высокие температуры кипения, значительная растворимость в воде), обусловлены способностью гидроксильной группы образовывать межмолекулярные водородные связи.
По мере удлинения углеводородной цепи относительное влияние водородных связей уменьшается, и одноатомные спирты с длинной углеродной цепью приближаются по своим физическим свойствам к соответствующим алканам. Так, только низшие спирты – метиловый, этиловый, изопропиловый и третичный бутиловый – смешиваются с водой в любых соотношениях, а, например, н-гексанол растворяет лишь 0.6% воды.
Температуры кипения спиртов
| Спирт | Температура кипения, °С |
| СН3ОН | 64,5 |
| С2Н5ОН | 78,3 |
| н-С3Н7ОН | 97,8 |
| н-С4Н9ОН | 117,7 |
| н-С10Н21ОН | 231,0 |
Спирты нормального строения кипят выше, чем спирты с разветвленной цепью. При одинаковом числе углеродных атомов первичные спирты кипят при более высокой температуре, чем вторичные, а вторичные спирты – при более высокой, чем третичные. Температуры плавления, наоборот, выше у третичных спиртов. Плотность спиртов меньше 1.
Химические свойства спиртов
В молекуле спирта можно выделить три реакционных центра
1) О-Н-связь: обладает выраженной полярностью вследствие высокой электроотрицательности кислорода по сравнению с водородом, реакции с разрывом О-Н-связи определяют кислотность спирта;
2) неподеленная электронная пара атома кислорода определяет основность и нуклеофильность спирта;
3) С-О-связь: также обладает полярностью из-за различия электроотрицательности кислорода и углерода, разрыв С-О-связи характерен для реакций нуклеофильного замещения и β-элиминирования
В соответствии с перечисленными реакционными центрами для спиртов можно выделить следующие реакции:
2. Нуклеофильное замещение гидроксильной группы
3. Дегидратация спиртов
4. Окисление спиртов.
1. Кислотные и основные свойства спиртов. Спирты способны проявлять себя как кислоты и как основания. Константа диссоциации этанола Ка (рКа=10 -16 ) в 10 10 раз выше, чем Ка ацетилена (рКа=10 -26 ).
В силу своих кислотных свойств спирты легко взаимодействуют со щелочными металлами, образуя соли (алкоголяты):
Кислотность спиртов определяется строением алкильного радикала. Так, кислотность в ряду низших спиртов меняется следующим образом:
Наименьшую кислотность имеет трет-бутиловый спирт, так как соответствующий алкоксид-анион наименее устойчив из-за электронодонорного влияния метильных групп:
Основные свойства спиртов проявляются по отношению к протонным и апротонным кислотам. Донором электронов в молекуле спирта является атом кислорода:
Источник
Лабораторные способы получения этилового спирта
К наиболее часто используемым химическим способам получения спиртов относятся:
1.Гидратация алкенов (промышленный способ получения этанола для технических целей)
(t, Р, кислая среда (катализатор))
2.Щелочной гидролиз галогеналканов (лабораторный способ получения)
(водный раствор щелочи, t)
3.Восстановление альдегидов и кетонов (лабораторный способ получения)
(t, катализатор –Ni)
Особые способы получения метанола и этанола
1.Получение метанола из синтез-газа (водяной газ, генераторный газ)
(t, Р, оксидные катализаторы)
2.Получение этанола ферментативным брожением глюкозы (получение этилового спирта для пищевых и медицинских целей)
1. Гидратация алкенов
Гидратация алкенов используется в промышленности для получения спиртов из продуктов нефтепереработки.
Присоединение воды к алкенам происходит в присутствии разбавленной серной или фосфорной кислот. Эта реакция протекает в соответствии с правилом Марковникова, поэтому первичный спирт можно получить только из этилена, а остальные алкены дают вторичные или третичные спирты:
Этот метод в лабораторных условиях нашел ограниченную область применения для получения третичных спиртов.
2. Гидролиз галогеналканов в водном растворе щелочи
В лабораторных условиях спирты получают действием водного раствора щелочи на алкилгалогениды при нагревании, при этом атом галогена в галогеналкане замещается группой –ОН:
С помощью этой реакции можно получать первичные, вторичные и третичные спирты.
При действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена.
3. Восстановление карбонильных соединений (альдегидов и кетонов)
Дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция – гидрирование альдегидов, кетонов и эфиров карбоновых кислот – является, таким образом, их восстановлением.
При действии водорода в присутствии катализаторов (Ni, Pt, Pd) альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов:
4. Восстановление эфиров карбоновых кислот
Гидрирование сложных эфиров проходит через стадию образования альдегидов:
Этим методом в промышленности из метиловых эфиров высших кислот получают высшие первичные спирты, например:
5. Гидролиз сложных эфиров карбоновых кислот в щелочной среде
Гидролиз сложных эфиров карбоновых кислот протекает как в кислой, так и в щелочной среде (водные или спиртовые растворы NaOH, КОН, а также Ba (OH)2, Ca (OH)2, Ba (OH)2, Ca (OH)2). Однако к образованию спиртов приводит гидролиз, протекающий необратимо в щелочной среде:
6. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
Спирты образуются при многочисленных реакциях металлоорганических соединений с различными соединениями, содержащими карбонильную группу >С=О. Этим способом можно получать как первичные спирты, так и вторичные и третичные:
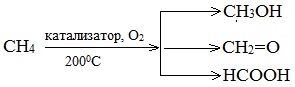
7. Окисление алканов
При мягком окислении метана кислородом воздуха в присутствии различных катализаторов образуются метанол, формальдегид или муравьиная кислота:
Специфические способы получения метанола и этанола
Производство метанола крупнотоннажное, т.к. метиловый спирт является исходным веществом для получения других продуктов органического синтеза.
В промышленности
1. Получение метанола из синтез-газа (водяной газ, генераторный газ)
а) Конверсия природного газа в синтез-газ
Его получают из метана с перегретым водяным паром:
б) Каталитический синтез метанола из оксида углерода (II) и водорода
В качестве катализаторов используют смесь оксидов цинка, меди и хрома, температуру поддерживают в интервале 200-300 о С, а давление – от 40 до 150 атм.
Газ на выходе из реактора содержит 3-5% CH3OH, затем газ охлаждают и конденсируют полученный метанол, а оставшийся газ смешивают с исходным газом и направляют снова в реактор.
Ранее метанол получали сухой перегонкой древесины без доступа воздуха (отсюда его название «древесный спирт»).
2. Получение этанола спиртовым брожением глюкозы
Ферментативный гидролиз крахмала – наиболее древний синтетический процесс, используемый человеком – до сих пор имеет огромное значение для получения этилового спирта.
Протекает только в присутствии ферментов, которые вырабатывают некоторые микроорганизмы, например, дрожжи:
Глюкоза содержится во фруктовых соках. Глюкозу можно получить гидролизом крахмала (зерно, картофель, целлюлозные опилки):
Источник